2021年全国乙卷第13题评析与原创试题命制策略
福建 裴范翔 宁夏 田涛 湖南 周学兴
《普通高中化学课程标准(2017年版2020年修订)》(以下简称为《课程标准》)对水溶液中的离子反应与平衡的描述为:通过对电离平衡、水解平衡、沉淀溶解平衡等存在的证明及平衡移动的分析,形成并发展学生的微粒观、平衡观和守恒观;关注水溶液体系的特点,结合实验现象、数据等证据素材,引导学生形成认识水溶液中离子反应与平衡的基本思路。基于这样的要求,高考以核心价值为引领,以基本事实为载体,以关键能力和必备知识为基础,以考查学生学科素养为目标,设置具有基础性、综合性、应用性和创新性的高考试题。不难看出,立足于微观粒子变化,电解质溶液类试题在考查学生“宏观辨识与微观探析”“变化观念与平衡思想”和“证据推理与模型认知”等维度方面更具典型性和代表性。本文以2021年全国乙卷第13题为例,分析此类题目命题特点,并浅谈此类试题的命制策略,希望对2022年高考复习备考有所帮助。
1.试题情境与命题素材
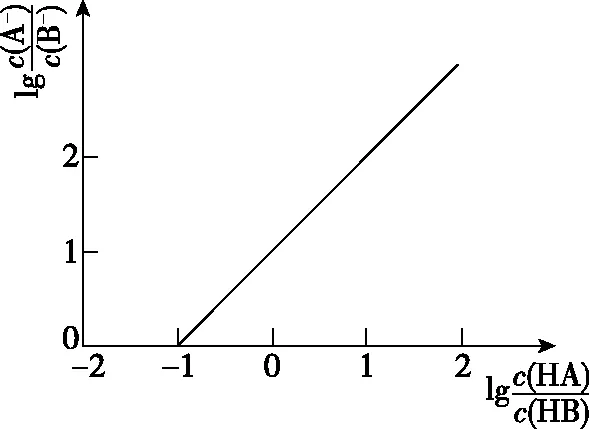
试题素材来源于理论学术情境,据分析应为《无机化学》(高等教育出版社)中课后习题的改编。素材为:“某一元弱酸强碱形成的难溶盐MA,在纯水中的溶解度(不考虑水解)为1.0×10-3mol·dm-3,弱酸的Ka为10-6,试求该盐在c(H+)保持为2.4×10-6mol·dm-3的溶液中的溶解度。”素材中给出了Ksp(MA)与Ka(HA),要求特定c(H+)下的c(M+)。高考试题则反向设问,并进一步提升,变“特殊点处理”为“线性处理”。通过给出c2(M+)与c(H+)的线性关系图像,要求学生求解Ksp(MA)与Ka(HA)及其他问题。
2.能力及核心素养
基于粒子浓度及其影响因素的线性图像关系,要求学生获取图中数据信息推导酸的电离常数、难溶盐的沉淀溶解平衡的关系。从定性与定量相结合的方面对化学曲线综合分析,由浅及深地考查学生对曲线本质、成因、结果的分析能力。具体来看,试题从点和线两个维度评价学生对图像信息获取与加工能力、图像走势的证据识别与推理能力、图像本质的模型构建与认知能力。
以粒子浓度及其影响因素间对应的化学曲线为载体,通过数学处理建立线性函数关系,在综合评价学生对水溶液中粒子行为分析的理解程度的同时,还可以基于对化学曲线图的解读有效评价学生的信息素养,从“微观探析”“平衡思想”“证据推理”“创新意识”等视角评价学生学科核心素养的发展水平,使得该试题具有良好的可信度和区分度。
3.考查特点
本题以HA作为一元弱酸,难溶盐MA饱和溶液中c(M+)与c(H+)变化为背景,给出了c2(M+)随c(H+)变化的线性关系图像。问题设置为离子浓度判断、溶度积常数Ksp计算、电离平衡常数Ka(HA)计算。题目所选择物质为学生们常见的一元弱酸HA和强碱弱酸盐MA,涉及物质种类少,关系简单。同时给出的c2(M+)随c(H+)变化图像为简单的直线,图像简单易读,特殊点数据规则易于计算。以往的水溶液问题通常为静态曲线或单一行为的动态曲线分析,如仅存在水解、电离等过程的分析。本试题则结合了电离平衡与沉淀溶解平衡两种平衡,属于多重平衡体系中粒子浓度及其影响因素间的变化分析。
4.直线型离子平衡题的命制思路
第一步:选取某常数或等式,整合出直线函数方程
数学直线函数通式为y=ax+b。由此可知若想让直线函数是固定的某条曲线,需要a、b为常数。许多物理量之间的数学关系较为复杂,但是朝着直线化的方向思考,最终总能够构建出直线型关系。这样的处理方式有许多,常利用平衡常数等常数构建直线型方程。这为我们提供了命制直线型离子平衡试题的思路。直线型方程可能是一条,也可能是多条。如2017年全国Ⅰ卷13题构建了两条直线型图像。
由上述论证,可知利用平衡常数即可绘制或构建直线方程。离子平衡中,常见的常数有Ka、Kb、Kw、Kh、Ksp等。其中Ka、Kb、Kh相近,与2017年全国Ⅰ卷第13题思路类似。
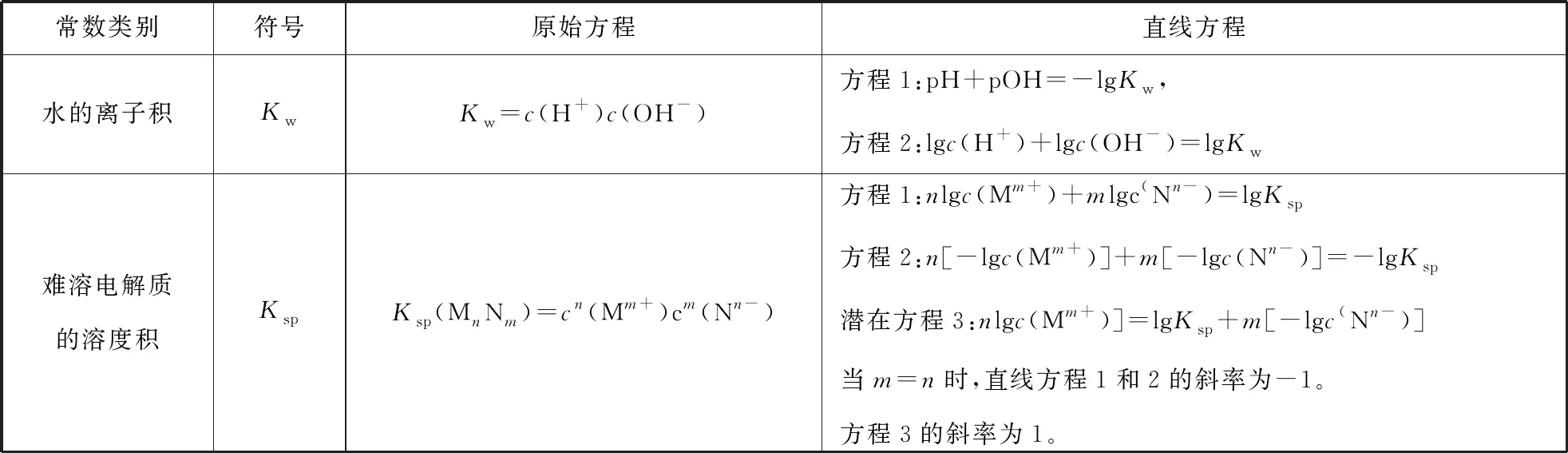
表1 部分常数转化直线函数的关系表
不难发现,在坐标转化时,对数处理,可能将函数关系转化为直线关系,选择不同的数据作为横纵坐标,斜率不尽相同。这样,也就提供了解题思路:要关注横纵坐标的函数关系。
第二步:根据考向细目表,确定考向

直线型离子平衡题,并非在考向上发生了变化,而仅是在图像等信息呈现上发生大的改变,以增加试题“陌生度”,具备高起点,实际上,解题过程中,考查的知识是不变的,以下为离子平衡题的常见考向。
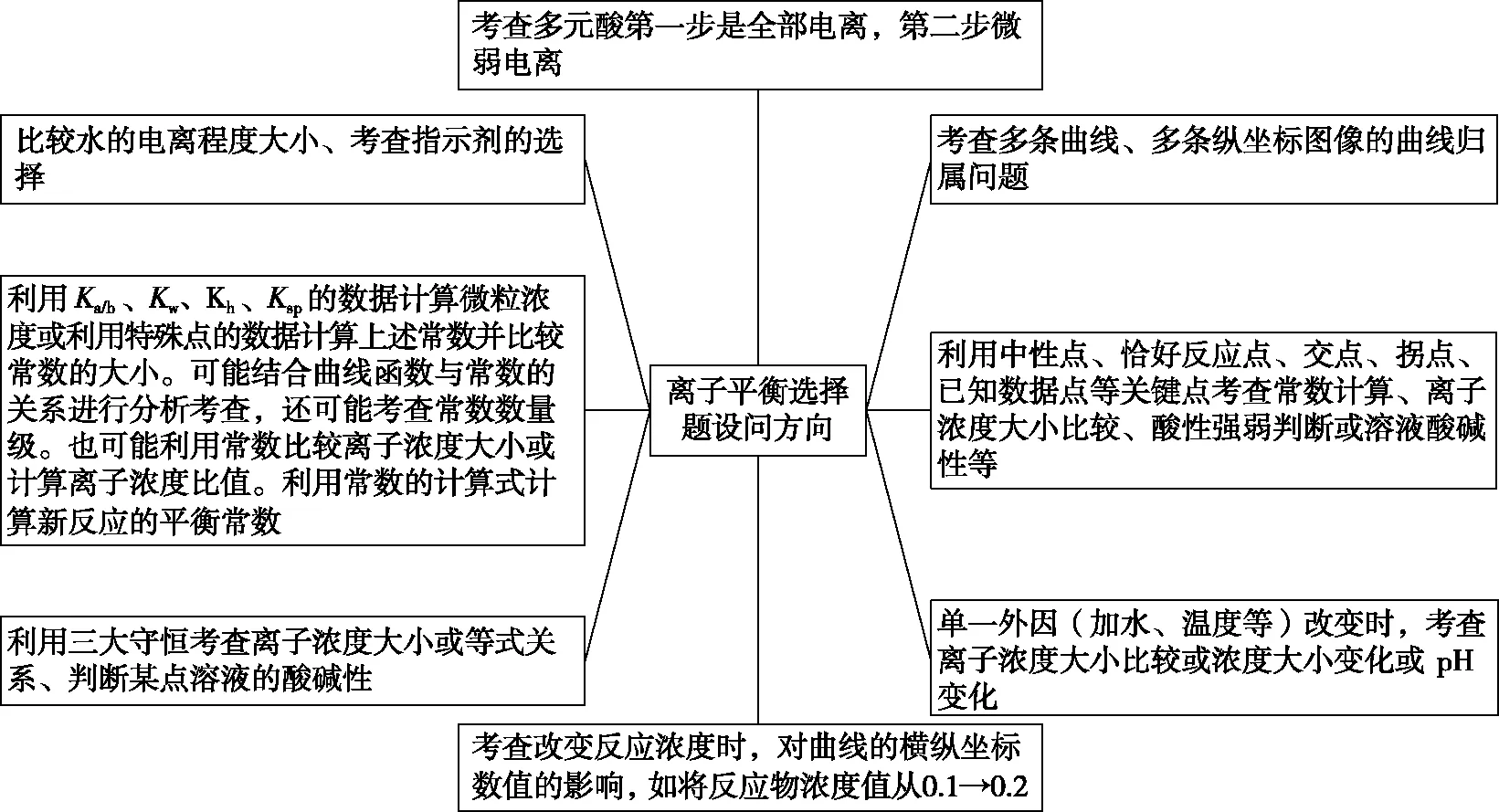
图1 离子平衡题常见考向
第三步:打磨选项
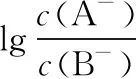
( )
A.Kh(NaB)=5.65×10-9
C.滴入20 mL HA溶液后溶液中存在关系:c(A-)>c(HB)
D.溶液中一定存在关系:c(Na+)+c(H+)=c(B-)+c(OH-)+c(A-)
【答案】C
5.备考建议
(1)知识层面
近几年高考中关于电解质溶液选择题的考查内容多为曲线表征物理意义、电离平衡常数、溶度积常数计算或离子溶度比较等,以《课程标准》来看,上述知识属于应知应会的基本知识。命题角度稳定于曲线所代表的微粒的判断、离子浓度比较、平衡常数计算、平衡移动等方面。相应的解题方法多集中于物料守恒和电荷守恒关系的应用,而平衡常数的计算多通过曲线上的特殊值进行。
复习备考中建议将电解质溶液模块相关知识细化,从平衡的建立、平衡的移动、平衡常数表达式书写与计算、平衡的应用以及离子反应等具体知识点着手,各个突破,建立有效的知识体系,实现知识系统化、网络化、具体化。
(2)能力层面
如前文所述,高考对电解质溶液选择题的考查往往是以图像的形式给出,这也就意味着读懂图表是解决电解质溶液问题的第一步。除分析图表获取有用信息的能力外,还要具备一定的数学运算能力、分析概括能力、逻辑思维能力。以上能力的缺失势必会造成图表看不懂,数据得不到,规律用不上的尴尬困境。防止机械性的记忆和背诵,建立在准确理解概念,迁移应用知识,打破常规的基础上,建立新的认知是提高分析问题和解决问题能力的出路。
(3)方法层面
一是认真研读《课程标准》和课本,明确高考对电解质溶液选择题考查的深度和广度,命题的角度和难度。对课本上出现的中和滴定曲线、沉淀溶解平衡曲线、溶液导电能力曲线等,以分析曲线上各个点、线的物理意义加深理解。二是从命题素材、考查知识点、信息呈现方式的角度强化练习,通过对高考典型代表试题的分析解答,获取电解质溶液选择题在解题方法、必备知识等层面的知识要求和能力要求。在练习中求得进步,获得突破。
解题中要特别注意横纵坐标所表示的物理量,关注图像中线的起点、终点、拐点、交点、变化趋势,注意特殊点,如起点、拐点、交点、终点,所表示的特殊的物理意义。适时将特殊点中存在的得失电子守恒、电荷守恒、物料守恒等等量关系运用于解题,为解题创造方便。注意有用信息的获取,排除干扰信息,从题目信息与已学知识的关联性入手分析问题。此外,特别注意溶液中的溶质成分的变化,抓住“物质变化”这一主线不放松。若存在数学运算,可在建立数学模型的基础上进行数据推理和结论得出。


