从肠道代谢产物探讨银屑病发病机制及潜在治疗方式
王晓旭,张广中
(首都医科大学附属北京中医医院皮肤科,北京 100010)
银屑病是一种免疫介导的难治性、易复发的慢性炎症性皮肤疾病,临床以红斑、鳞屑,甚至脓疱、红皮病等为主要表现。我国的大规模银屑病流行病学调查显示,银屑病的总患病率呈明显上升趋势,已由1984年的0.12%上升至2008年的0.72%,其中以地区为主的银屑病患病率调查显示,银屑病患病率为0.86‰~3.29‰[1]。目前认为,树突状细胞和T细胞所介导的免疫炎症反应在银屑病的病理改变中处于核心地位,但导致这一病理变化的具体原因尚不明确。肠道菌群是寄居在人体肠道的微生物群落,对维持人体免疫平衡以及防止病原体侵入有重要意义。在病理条件下,肠道菌群的组成成分、结构等可能发生改变,而菌群失调可引发免疫炎症反应,最终导致疾病。近年研究发现,肠道菌群失调所引起的慢性炎症反应与银屑病的核心病理机制密切相关[2]。某些具有毒性的肠道代谢产物[如脂多糖(lipopolysaccharide,LPS)和糖脂]可穿过肠道屏障进入血液循环并激活免疫炎症反应,提示肠道菌群失调促进肠道代谢产物释放入血所引发的免疫炎症反应可能是造成银屑病病理变化的关键因素[3]。现就肠道菌群紊乱与银屑病发病的关系进行综述,以期为肠道代谢产物(LPS和糖脂)在银屑病慢性炎症反应中作用机制的研究、银屑病病因病机及其有效治疗方法的探索提供帮助。
1 肠道菌群概述
人体肠道中寄居着大量的微生物,这些微生物与人体共存,被称为人体的“第二大基因库”,其中包括了数量庞大的细菌、真菌、病毒等,其组成的微生物群落称为肠道菌群。正常情况下,肠道菌群对维持和促进人体的多项生理活动均有作用,包括促进人体的营养代谢、防止病原体感染、促进免疫系统成熟和调节免疫应答等,这些生理活动的正常进行可促使肠道菌群与人体之间构成协调的统一体,并有助于维持机体的动态平衡,对促进人体健康具有重要意义。
环境、饮食的改变以及疾病等可破坏人体与肠道菌群的动态平衡,引起肠道菌群失调,进而导致菌群组成的改变,从而诱导人体免疫炎症反应,最终导致疾病的发生。大量研究证实,肠道菌群失调与疾病(肥胖、糖尿病、类风湿关节炎、炎性肠病等)的发生发展关系密切[4-8],这可能与致病菌的大量增殖及其代谢产物入血引发机体炎症反应有关。正常情况下,人体内存在具有抑炎作用的调节性T细胞和促炎作用的促炎性T细胞,当促炎性T细胞发挥促炎作用时,调节性T细胞可发挥抗炎作用,抑制人体自身的免疫反应,从而维持人体的免疫平衡。但有研究发现,肠道菌群失调可降低调节性T细胞的抗炎作用,使人体免疫平衡向促炎的方向发展,从而导致疾病发生[9]。此外,促炎T细胞[如辅助性T细胞(T helper cell,Th细胞) 1和Th17细胞]与多种自身免疫性疾病有关,如银屑病、多发性硬化症、狼疮、类风湿关节炎[9]。此外,自身免疫性疾病又可进一步加重肠道菌群失调,导致疾病慢性炎症反应状态持续存在,形成恶性循环。由此可见,肠道菌群与自身免疫性疾病的发生发展密切相关,可能是研究银屑病病理机制的新方向。
2 银屑病肠道菌群特征
与健康人群相比,银屑病患者的肠道菌群数量、种类及比例均发生明显改变。研究发现,银屑病患者肠道菌群的多样性明显减少,且低肠道菌群多样性人群更易处于低度炎症状态[10-11]。短链脂肪酸(short-chain fatty acids,SCFA)是肠道菌群进行纤维发酵的产物,在促进肠道屏障完整性和发挥抗炎作用方面起关键作用,其主要来源于费氏杆菌,但银屑病患者肠道中费氏杆菌的含量明显低于健康受试者[12-13]。丁酸是SCFA的重要组成成分,主要由厚壁菌门的普拉梭菌属分泌,在促进SCFA发挥抗炎作用和维持肠道屏障完整方面具有重要意义[14]。但有研究指出,银屑病患者肠道中普拉梭菌属的数量显著减少,提示银屑病患者肠道菌群组成成分的改变可能是引起免疫炎症反应的重要因素[15]。另有研究指出,银屑病患者肠道Firmicutes/Bacteroidetes比值升高是银屑病肠道菌群的主要特征,具体表现为Firmicutes丰度升高以及Bacteroidetes丰度降低[16-17]。Firmicutes/Bacteroidetes比值升高可影响肠道碳水化合物的代谢,并导致SCFA生成减少,最终导致慢性炎症反应发生和肠道屏障损害。且肠道屏障功能受损可直接导致病菌及其代谢产物释放入血,促进系统性炎症反应的发生,从而诱发或加重银屑病[18]。可见,银屑病的发生发展与肠道菌群失调密切相关,而菌群失调可通过提高人体内免疫炎症反应水平促进银屑病的病情进展。
3 肠道代谢产物诱发银屑病的免疫炎症机制
目前认为,银屑病是一种由T细胞介导的免疫炎症性疾病,而肠道菌群是驱动免疫炎症性疾病的关键因素,其可作为独立的内分泌器官,通过与宿主之间的相互作用维持宿主能量代谢稳态并刺激宿主免疫[19]。各种因素引起的肠道微生物组成的变化会导致肠道细菌与宿主之间共生关系的异常改变,从而促进免疫炎症的发生。银屑病可导致肠道屏障功能受损,使肠道中某些代谢物质释放入血,从而引起炎症反应,进而加剧银屑病的发展[20]。糖脂和LPS可能是诱发或加重银屑病的关键因素,在促进T细胞免疫炎症反应中发挥重要作用[21-22]。
3.1LPS LPS来源于革兰阴性菌的外细胞膜,其作用于人类或动物等其他生物细胞时,可表现出多种生物活性[21]。研究指出,银屑病常伴有肠屏障的破坏,从而导致细菌及其代谢产物外溢,最终引发或加剧银屑病的免疫炎症反应[20]。LPS结构中的脂质A能够使LPS穿过受损肠屏障进入血液并发挥促炎作用,引起慢性低度炎症的发生[23]。有研究发现,高脂饮食喂养小鼠肠道中革兰阴性菌的比例升高,同时血浆LPS水平升高,证实肠道菌群改变可促进LPS入血,进而导致血浆LPS升高,这是LPS发挥促炎作用的重要环节[24]。
LPS入血后可被多种先天性免疫细胞识别,从而引发人体内免疫联级反应。其中,树突状细胞是一种先天性免疫细胞,具有抗原呈递作用,能够协调先天性和适应性免疫,可在炎症条件下独立激活幼稚T细胞,并将其分化为各种CD4+T细胞亚群[25]。树突状细胞的表型和功能受肠道菌群的影响,其中以肠道代谢产物最明显[26]。细菌、病毒、真菌及LPS属于一种病原体相关分子模式,可被树突状细胞上的模式识别受体识别[27]。模式识别受体在识别微生物成分中起重要作用,其中Toll样受体(Toll-like receptors,TLR)[28]可在神经元、神经胶质细胞和先天免疫细胞中表达,并识别微生物成分(病毒、真菌和细菌等),然后促进免疫炎症反应的激活。在目前已知的人体内TLR家族中,有10种TLR具有基因表达和介导免疫功能,分别称为TLR1~10,其中TLR4是第一个被认识的哺乳动物TLR,也是一种LPS的信号转导受体,可通过识别真菌和细菌的细胞壁成分发挥天然免疫识别作用,对诱发剧烈炎症反应起重要作用[29]。已有研究指出,激活的LPS可促进肿瘤坏死因子-α、白细胞介素(interleukin,IL)-1β和IL-6等炎症因子释放[30]。一方面,肿瘤坏死因子-α、IL-1β和IL-6可直接加剧银屑病的炎症反应;另一方面,IL-1β和IL-6还可促进Th17细胞的增殖分化,进一步扩大银屑病炎症反应的发生发展[31]。
此外,LPS还可通过结合血浆LPS结合蛋白,激活位于巨噬细胞质膜上的受体蛋白CD14,引发炎症反应[32]。LPS与血浆LPS结合蛋白相结合的复合产物还可在巨噬细胞表面结合TLR,从而触发转导信号,激活并编码多种炎症因子的基因表达,如核因子κB和激活蛋白1对诱发和加重银屑病炎症反应起至关重要的作用[33]。以上研究表明,肠道菌群失调可引起LPS外溢入血,激活人体免疫炎症反应,从而加重银屑病。
3.2糖脂 糖脂属于肠道菌群代谢产物之一,可由真菌和分歧杆菌等细菌代谢产生[22]。C型凝集素是一种模式识别受体,在树突状细胞、巨噬细胞、B细胞和中性粒细胞中表达,并可参与糖脂的识别[34]。已有研究表明,糖脂及人工合成的糖脂类似物可结合并激活C型凝集素,诱导炎症的发生[35],这可能是糖脂介导人体免疫炎症反应的关键环节。
C型凝集素在树突状细胞中强表达,为糖脂参与银屑病的炎症反应提供了有利条件[34]。当糖脂与C型凝集素结合后,可激活树突状细胞分泌IL-12和IL-23,而IL-12和IL-23在促进Th1和Th17细胞增殖分化上具有重要作用,其中IL-12作用的受体存在于CD4+细胞上,可促使CD4+细胞向Th1细胞分化[36]。Th1细胞被激活后可促进γ干扰素的分泌。角质形成细胞的异常分化是银屑病的重要病理改变,γ干扰素可改变单层角质形成细胞中基因(约1 200个)的表达,从而促进银屑病斑块和鳞屑的形成[37]。另有研究发现,γ干扰素可在银屑病出现明显皮损表现前就存在分泌异常的现象[38]。与IL-12的受体不同,IL-23的受体不能通过直接作用于CD4+细胞的方式促进Th17细胞分化[39],而存在于Th17细胞上的IL-23受体能够进一步对分化成熟的Th17细胞的增殖发挥作用[40]。IL-17是驱动银屑病发病的主要效应因子,而银屑病严重程度与Th17细胞数量和IL-17的分泌水平呈正相关[41]。IL-17还可通过下调角蛋白细胞中丝蛋白和黏附分子的表达破坏皮肤屏障的完整性,并进一步诱导角质形成细胞过度增殖,这与银屑病皮损的鳞屑表现密切相关[42]。此外,体内Th17细胞的富集在很大程度上取决于肠道菌群的存在和组成[43]。有研究指出,分段丝状细菌可增强小肠固有层中Th17细胞的分化,认为银屑病患者的肠道菌群特征可能是预测Th17细胞或IL-17靶向治疗的有效生物标志物[44-45]。
综上所述,银屑病慢性炎症反应的发生发展与肠道菌群密切相关。银屑病可造成肠道屏障功能受损,为肠道代谢产物的外溢创造条件。LPS和糖脂通过受损的肠道屏障进入血液循环后,通过结合免疫活性细胞上的模式识别受体激活炎症反应,其中树突状细胞上存在多种可识别肠道代谢产物的模式识别受体,包括TLR和C型凝集素,故推测LPS和糖脂可能通过结合模式识别受体激活树突状细胞引发的免疫炎症反应(图1),这可能是肠道菌群引起银屑病炎症反应的潜在机制。
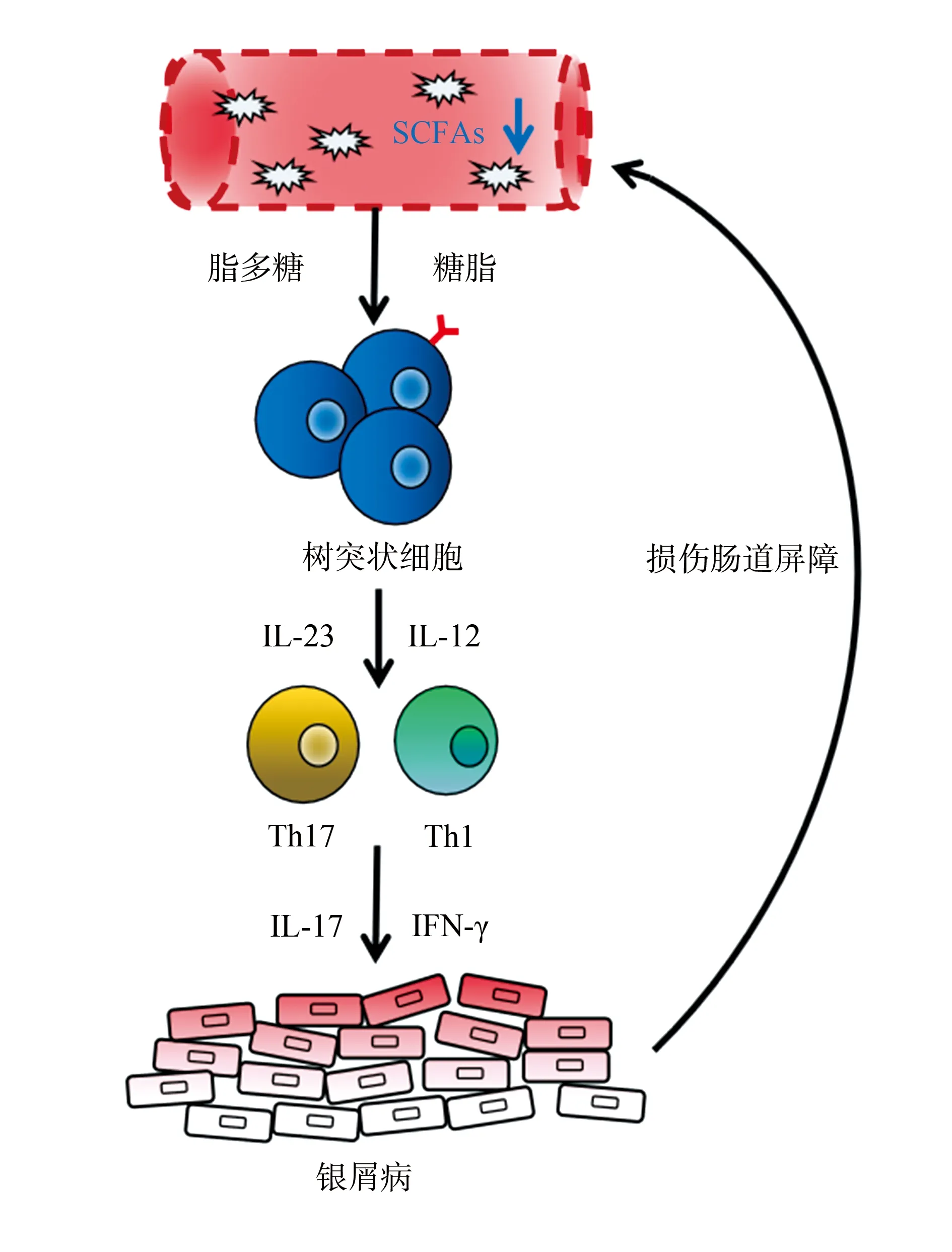
LPS:脂多糖;IL:白细胞介素;Th:辅助性T细胞;INF:干扰素
4 基于肠道菌群的潜在治疗方式
肠道菌群失调与银屑病慢性炎症反应的发生发展紧密相关,从纠正肠道菌群紊乱角度治疗银屑病有一定疗效,这可能是未来治疗银屑病的潜在方式。益生元是一种膳食补充剂,可通过刺激细菌的生长和活性,对宿主产生有益影响。益生元可通过改善肠道黏膜屏障功能恢复肠道通透性,并纠正全身炎症反应[46]。随机对照研究指出,摄入益生菌混合物银屑病患者的皮损表现明显改善,且银屑病皮损面积减小,严重程度指数和银屑病的复发风险降低[47]。而以蔬菜水果和谷物杂粮为主的素食主义者肠道中乳酸杆菌丰度明显升高,这有助于降低银屑病严重程度[48]。丁酸是构成SCFA的主要物质,也是免疫调节的有效分子,可为结肠上皮细胞提供能量。研究显示,丁酸盐可抑制小鼠肠道中的幼稚T细胞向Th17细胞分化,从而降低银屑病炎症反应程度[49]。有研究指出,丁酸盐可抑制血浆和结肠黏膜中的IL-17水平[50],这为利用丁酸治疗银屑病提供了研究基础。另有研究显示,槲皮素可能是治疗银屑病的潜在物质,其可显著降低Firmicutes/Bacteroidetes比值,纠正肠道菌群失调[51-52]。
5 小 结
银屑病的发生发展与肠道菌群关系密切,其核心机制可能与肠道代谢产物(LPS和糖脂)释放入血并激活炎症反应有关。肠道代谢产物介导银屑病炎症反应的基本通路可能是LPS和糖脂与模式识别受体结合后激活树突状细胞,树突状细胞通过分泌IL-12和IL-23激活Th17和Th1细胞,进而Th17和Th1细胞通过分泌γ干扰素和IL-17加重银屑病炎症反应。此外,银屑病的发生发展还可导致肠道屏障功能受损,进一步加重LPS、糖脂外溢,造成恶性循环。肠道菌群的种类、数量繁多,其代谢产物多种多样,未来应进一步探索肠道代谢产物与银屑病免疫炎症反应之间的关系,以寻找代谢产物引发炎症的关键位点,为银屑病发病机制的研究以及新药研发提供支持。

