罗布麻多酚对脑损伤小鼠认知和氧化应激的影响
张健强
(德兴市人民医院外一科神经外科,江西 上饶 334200)
罗布麻是一种在我国北方地区广泛分布的野生植物,特别是在新疆和甘肃地区较常见[1]。在传统医学上,罗布麻已被用以治疗高血压、心力衰竭、水肿和感冒等病症,其不良反应较小,对身体无明显危害,也用作保健茶饮[2-3]。植物多酚作为一类生物活性物质,已经被证实具有抗癌、抗炎、延缓衰老、保护内脏组织等功效[4]。因天然植物多酚的良好生物活性作用,经过现代医学技术开发,已有包括EGCG 在内的多种多酚物质被应用于制造药物[5]。大脑是人体中枢神经系统的核心部位,是人体最复杂的组织系统,大脑受损后对人体意识、行动、生理活动等均有直接影响,甚至威胁生命安全[6]。人体内脏或组织发生损伤后,机体的氧化应激平衡被打破,造成氧化应激失衡,会加剧组织损伤[7]。本研究提取罗布麻多酚,通过建立动物脑损伤模型,观察罗布麻多酚对脑损伤小鼠认知的恢复作用及氧化应激失衡的抑制作用,旨在为罗布麻多酚的进一步应用提供理论依据,现报道如下。
1 材料与方法
1.1 实验动物 6周龄SPF级C57BL/c小鼠40只(体质量20~22 g),雌雄各20只,均购自于江西中医药大学实验动物科技中心。
1.2 试剂 罗布麻购自杭州聚修堂健康科技有限公司;绿原酸标准品购自上海纯优生物科技有限公司;SOD、GSHPx、MDA 试剂盒购自南京建成生物工程研究所;BCA 蛋白测定盒购自天根生化科技有限公司,SDS-PAGE聚丙烯酰胺凝胶、PVDF膜购自美国Invitrogen公司;一抗、二抗购自美国Abcam公司;其他化学试剂均为国产分析纯。
1.3 仪器与设备 BW-MWM101morris 水迷宫由上海软隆科技发展有限公司提供;UV9600紫外分光光度计购自北京北分瑞利分析仪器(集团)公司;LUX 多功能性酶标仪购自美国赛默飞公司;LAS3000成像系统购自日本富士公司。
1.4 方法
1.4.1 罗布麻多酚的提取 将冷冻干燥后的罗布麻磨碎后,称取500 g 的罗布麻粉末,加入4.5 L 的纯水,搅拌状态下进行水浴提取(90 ℃,30 min),重复提取2次,收集滤液得到粗提液。然后将粗提液过HP20 大孔树脂进行大孔树脂吸附,完成吸附后用70%(v/v)的乙醇洗脱,最后得到罗布麻多酚提取液[8]。
1.4.2 罗布麻多酚的纯度测定 称取20 mg绿原酸标准品,加入2 mL 的纯水配制成绿原酸标准液,然后稀释成不同浓度的标准品液,再分别取1.0 mL 的不同浓度标准品液加于25 mL 容量瓶中,然后再加入Folin-Ciocalteu 试剂(3.0 mL)与标准品液反应5 min,之后再加入4.5 mL饱和的Na2CO3溶液于容量瓶中,最后加纯水定容。室温下避光反应20 min后在747 nm 处测定反应液的吸光度值,根据不同浓度标准品液和吸光度值绘制标准曲线,再将样品提取液重复以上步骤测定吸光度值,对照标准曲线得到罗布麻多酚的含量[9]。
1.4.3 分组 40只实验小鼠随机分为正常组、模型组、罗布麻多酚低浓度灌胃(AVPL)组和罗布麻多酚高浓度灌胃(AVPH)组,每组10只。适应性饲养1周后,对除正常组外其他小鼠进行麻醉(2%戊巴比妥钠,50 mg/kg),然后将小鼠固定于手术台上,用脱毛膏脱去小鼠颈部的毛,仔细观察后准确对颈外动脉远端进行结扎,再在颈外动脉远心端用手术剪刀剪出约5 mm小口,用尼龙线由小口插入,轻轻推进尼龙线,直至不能推进为止进行固定,对小鼠进行缺血处理30 min,然后抽出尼龙线进行灌注,建立小鼠脑损伤模型[10]。造模24 h 后观察有无出现死亡情况,然后对AVPL 组和AVPH 组小鼠分别灌胃100、200 mg/kg AVP,持续4周,然后进行后续测定。
1.4.4 空间学习和记忆能力评估 将水迷宫的圆形池平均划分为4 个象限,小鼠开始灌胃AVP 的首日记录为第1 天,然后在第24 天开始每天训练小鼠寻找圆形池中的隐藏平台,将小鼠放在4个象限的相同位置,促使小鼠找寻平台,直至找到为止,每次找寻时间为60 s,记录小鼠停留在平台所在象限的时间,每天训练1 次,持续4 d。第28 天,灌胃AVP后6 h,撤去圆形池中的平台,记录小鼠在平台所在象限停留时间和穿越平台次数[11]。
1.4.5 新物体识别实验 选取10 m×10 m 的空旷场地作为小鼠训练场,小鼠开始灌胃AVP 的首日记录为第1 天,然后在第24天开始每天训练,将小鼠放入训练场中,使其自由活动,适应和熟悉试验场,每天训练10 min。第28 天,完成后进行2次识别实验,每次5 min。第1次在训练场中选择2个区域放置20 cm×20 cm的正方体物体让小鼠识别,第2次在训练场中和第1次实验相同区域放置1个与之前相同的正方体,另外再放置1 个高度同样为20 cm 的三角体。记录2 次实验小鼠探索每个物体的时间。然后计算小鼠在第2 次实验中的辨别指数,即探索新物体(三角体)的时间/探索2个物体的总时间×100%11]。
1.4.6 脑组织指标测定 断颈处死小鼠后,取0.5 g 小鼠脑组织,用PBS 缓冲液洗涤后进行匀浆,然后4 000 r/min 离心10 min,吸出上层液用试剂盒检测小鼠脑组织的SOD 酶活力、GSH-Px酶活力和MDA水平。
1.4.7 Western blot实验 断颈处死小鼠后,取0.5 g小鼠脑组织,用PBS缓冲液洗涤后进行匀浆,然后加入裂解液进行裂解(4 ℃,20 min),进行离心分离(4 000 r/min,10 min),吸出上清液。然后用BCA 蛋白测定盒检测提取出的蛋白总量。取100 μL(蛋白含量30~50 μg)裂解液进行上样,在SDS-PAGE聚丙烯酰胺凝胶上进行电泳,然后在PVDF膜上进行蛋白转膜。然后加入能覆盖转膜的封闭液和稀释后的一抗,4 ℃下孵育12 h,再进行洗膜,加入二抗液后在室温下孵育1 h,再次洗膜,最后用化学发光试剂进行蛋白表达的显色[12]。
1.5 统计学方法 采用SAS 9.1统计软件进行数据分析,计量资料以“±s”表示,比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 罗布麻多酚中多酚物质含量分析 通过测定不同浓度下绿原酸标准品液的吸光度值,以绿原酸标准品液浓度为Y轴,吸光度值为X轴绘制标准曲线为Y=0.1946X-0.0004(R2=0.9976)。然后测定AVP 提取液的吸光度值,对照标曲线计算,最后得到AVP 的含量为74.75%,纯度较高,可进行后续实验。
2.2 4 组小鼠空间学习和记忆能力比较 模型组逃避潜伏时间长于正常组,穿越平台次数少于正常组,差异有统计学意义(P<0.05);AVPL组和AVPH组逃避潜伏时间均短于模型组,穿越平台次数多于模型组,且AVPH 组均优于AVPL组,差异有统计学意义(P<0.05),见表1。
表1 4组小鼠空间学习和记忆能力比较(±s)Table 1 Comparison of spatial learning and memory ability of mice among four groups(±s)

表1 4组小鼠空间学习和记忆能力比较(±s)Table 1 Comparison of spatial learning and memory ability of mice among four groups(±s)
注:与正常组比较,aP<0.05;与模型组比较bP<0.05;与AVPL组比较,cP<0.05
穿越平台次数(次)6.37±0.41 1.52±0.26a 2.97±0.25ab 5.18±0.33abc组别正常组(n=10)模型组(n=10)AVPL组(n=10)AVPH组(n=10)逃避潜伏时间(s)24.35±3.25 55.63±5.11a 42.79±3.62ab 35.71±3.34abc
2.3 4组小鼠对新旧物体辨别指数比较 AVPH组和AVPL组对新旧物体辨别指数为(51.60±3.39)%和(45.36±3.17)%,明显高于模型组的(38.79±3.66)%,但低于正常组的(61.28±2.36)%,差异均有统计学意义(P<0.05)。
2.4 4组小鼠脑组织SOD、GSH-Px和MDA水平比较 模型组、AVPL 组、AVPH 组SOD、GSH-Px 酶活力均低于正常组,MDA 水平高于正常组,且AVPL 组、AVPH 组SOD、GSH-Px酶活力均高于模型组,MDA水平低于模型组,差异有统计学意义(P<0.05),见表2。
表2 4组小鼠脑组织SOD、GSH-Px酶活力和MDA水平比较(±s)Table 2 Comparison of SOD,GSH-Px enzyme activities and MDA level in brain tissue among four groups of mice(±s)
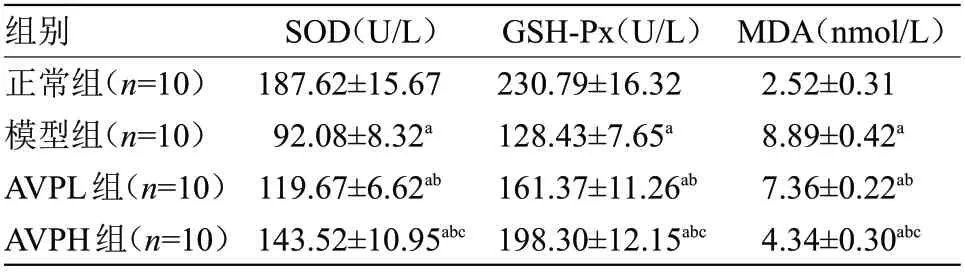
表2 4组小鼠脑组织SOD、GSH-Px酶活力和MDA水平比较(±s)Table 2 Comparison of SOD,GSH-Px enzyme activities and MDA level in brain tissue among four groups of mice(±s)
注:SOD,超氧化物歧化酶;GSH-Px,谷胱甘肽过氧化物酶;MDA,丙二醛
MDA(nmol/L)2.52±0.31 8.89±0.42a 7.36±0.22ab 4.34±0.30abc组别正常组(n=10)模型组(n=10)AVPL组(n=10)AVPH组(n=10)SOD(U/L)187.62±15.67 92.08±8.32a 119.67±6.62ab 143.52±10.95abc GSH-Px(U/L)230.79±16.32 128.43±7.65a 161.37±11.26ab 198.30±12.15abc
2.5 4组小鼠脑组织cAMP和p-CREB蛋白表达分析 正常组小鼠脑组织的cAMP 和p-CREB 蛋白表达最强,模型组cAMP和p-CREB蛋白表达明显下调。AVPL组、AVPH组可抑制cAMP和p-CREB蛋白表达下调,见图1。
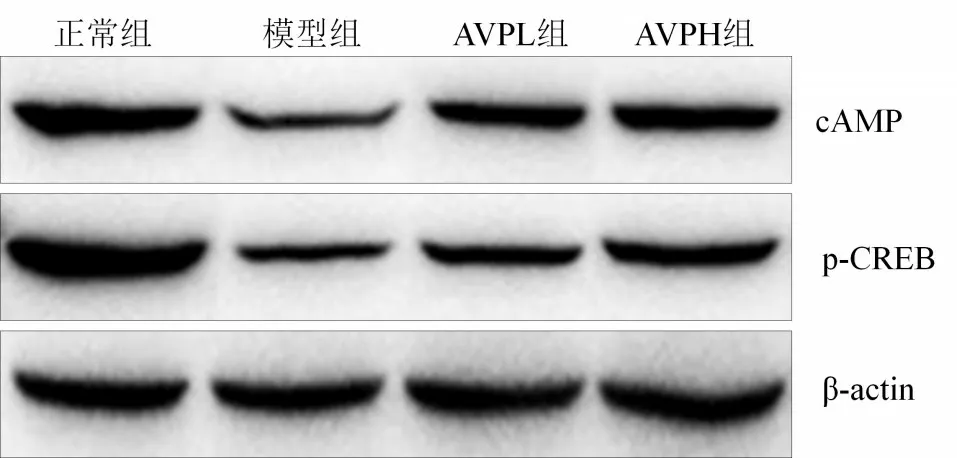
图1 4组小鼠脑组织cAMP和p-CREB蛋白表达分析Figure 1 Analysis of cAMP and p-CREB protein expression in brain tissue among four groups of mice
3 讨论
脑损伤引起中枢神经系统的损伤后会造成行动异常、认知和社会性残缺等问题[13]。通过小鼠动物模型可以观察脑损伤造成的行为学异常,脑损伤会导致小鼠在空间学习能力、记忆能力和新物体识别能力出现明显变化[14]。本研究结果表明,模型组逃避潜伏时间长于正常组,穿越平台次数少于正常组,差异有统计学意义(P<0.05);AVPL 组和AVPH组逃避潜伏时间均短于模型组,穿越平台次数多于模型组,且AVPH 组均优于AVPL 组,差异有统计学意义(P<0.05),提示,AVP作用后,小鼠出现的行为学缺损被显著抑制,空间学习能力、记忆能力和新物体识别能力均得到一定程度的恢复。由此可以初步判断AVP具有修复脑损伤的作用。
多酚物质具有抗氧化效果,能抑制氧化应激的效果,从而修复组织。脑损伤发生后一般会引起脑组织氧化应激,而氧化应激又会加剧脑损伤[15]。SOD 和GSH-Px 均是机体内重要的抗氧化酶,机体内的抗氧化酶活力降低时,会加剧组织损伤。MDA 是一些氧化损伤的最终产物,在一定程度上可反映机体受到氧化应激损伤的水平[16]。因此,通过检测SOD、GSH-Px酶活力和MDA水平可作为检测机体氧化应激损伤的评价标准[17]。本研究结果表明,模型组、AVPL 组、AVPH 组SOD、GSH-Px 酶活力均低于正常组,MDA 水平低于正常组,且AVPL组、AVPH组SOD、GSH-Px酶活力均高于模型组,MDA 水平低于模型组,差异有统计学意义(P<0.05),表明小鼠出现脑损伤后,脑组织中的SOD 和GSH-Px酶活力和MDA水平显著变化,AVP发挥可多酚物质的活性作用,调节氧化应激,修复脑组织的作用。
cAMP 在机体中发挥调节物质代谢和调节生物学功能的重要作用,特别是其能作为信号传递物质,调节机体内其他代谢,起到抗组织损伤、抗缺血和抗缺氧的能力[18]。环磷腺苷效应元件结合蛋白作为机体内的调节基因转录的蛋白质,是一种特定出现在脑细胞中的分子,通过刺激特定基因,制造脑组织需要的蛋白质,在保持记忆力中发挥重要作用[19]。cAMP/CREB/BDNF信号通路是保持中枢神经正常的重要信号通路,同时,该通路也与学习能力和记忆力形成直接相关[20]。本研究结果表明,脑损伤小鼠脑组织中cAMP和p-CREB 蛋白表达显著下降,AVP 可抑制cAMP 和p-CREB蛋白表达下调,从而修复中枢神经系统,抑制脑损伤的作用。
综上所述,AVP 对氧化应激有明显的抑制作用,对缺血性脑损伤可修复中枢神经、改善记忆力和学习能力的作用。表明AVP是一类具有缺血性脑损伤干预作用的生物活性物质,具有一定的开发利用价值,值得进一步深入研究。

