Sn改性铜基催化剂用于合成气间接制乙醇的反应性能研究
冀渐飞,孟园园,李天善,房克功,王俊文,张 侃,卫国强
(1. 太原理工大学 化学化工学院,山西 太原 030024;2. 中国科学院山西煤炭化学研究所,山西 太原 030001)
作为一种重要的有机化学品,乙醇不仅是基本溶剂和化学合成的基本原料,也是一种燃料/燃料添加剂[1]。 现有的燃料乙醇主要生产方法为生物质发酵法和乙烯水合法。 生物质发酵法使用谷物粮食、富含纤维素的木材等作为原料[2,3],但以粮食等农作物为消耗的生物质制乙醇工艺在我国有一定的局限性。 而乙烯水合法消耗乙烯以及使用硫酸等腐蚀性物质,不符合绿色化学的理念,也难以大规模发展。 鉴于我国“富煤、贫油、少气”的能源结构以及对外原油依存度逐年攀升的现状,开发出一条以煤合成气为起点的非石油乙醇生产新工艺有助于降低我国对石油资源的依赖,促进煤炭的清洁高效转化利用,具有重大的战略和现实意义。
从煤基合成气出发制备乙醇的工艺主要有直接法和间接法。 直接法使用Cu基、Rh基、Mo基等均相催化剂来控制CO解离和C-C偶联过程实现合成气直接制C2+醇产物[4,5]。 由于使用的贵金属原料生产成本较高、目标产物的选择性差和产物碳分布较广等不利因素,限制了其工业化应用。 而间接法主要包括CO活化、羰基化和氢化三个步骤[6-9],并寻找这三个过程最佳的反应参数实现耦合催化。 间接法原料CO来源广泛,反应条件温和,催化剂廉价易得,满足绿色化学中对原子经济性的要求,近年来受到了研究者们的青睐。Li等[10]以合成气和二甲醚为原料,通过使用丝光沸石和CuZnO串联床层催化剂, 把羰基化生成的乙酸甲酯完全转化为乙醇和甲醇,这部分工作首先为耦合催化提供了理论指导。 耦合催化实质上是将一个反应过程分解为两到三个反应过程,通过改变某一催化中心的活性达到促进靶向转化的目的,进而提高目标产物的选择性。 目前研究者主要致力于羰基化组分的改性和优化从而提高乙醇选择性或反应活性,而关于加氢组分影响的报道较少。 虽然2020年Kang等[9]使用水蒸气处理的丝光沸石和Pt-Sn负载的SiC使乙醇选择性突破性地达到了约90%,但其使用贵金属Pt作为活性组分,不满足工业化经济性的要求。 铜廉价易得,用途广泛,对铜基催化剂进行改性从而提高耦合催化的反应活性,是一种最有前途的方法,同时也充满了挑战性。
本文提出设计三明治型串联催化床层,第一层催化剂用于将合成气转化为二甲醚,第二层催化剂用于二甲醚羰基化生成乙酸甲酯,第三层催化剂用于乙酸甲酯加氢生成乙醇和甲醇。 加氢催化剂作为整个催化体系必不可少的组分之一,多年来由经济实惠的铜基催化剂作为代表[11]。 实验通过在铜基催化剂中引入金属Sn作为助剂,重点探讨了不同质量分数的Sn对水煤气变换和合成气制乙醇耦合催化性能的影响。
1 实验部分
1.1 实验试剂及原料
硝酸铜(Cu(NO3)2·3H2O,分析纯)、硝酸锌(Zn(NO3)2·6H2O,分析纯)和硝酸铝(Al(NO3)3·9H2O,分析纯),均购自国药集团化学试剂有限公司;碳酸铵((NH4)2CO3,分析纯),购自成都华夏化学试剂有限公司;结晶四氯化锡(SnCl4·5H2O,分析纯),购自上海阿拉丁试剂有限公司。 HZSM-5(n(Si)/n(Al) =25)和HMOR(n(Si)/n(Al) = 12.5)沸石分子筛购自天津南化催化剂有限公司。
1.2 催化剂的制备
CuZnAl催化剂的制备:采用正加共沉淀法将一定量的碳酸铵溶液逐滴滴加到硝酸铜、硝酸锌和硝酸铝的混合溶液中(n(Cu):n(Zn):n(Al) = 4.5:4.5:1),形成的浆液在80 °C下搅拌2 h。 将沉淀物在室温下老化12 h, 过滤后用去离子水和乙醇洗涤数次得催化剂前体。将催化剂前体在110 °C下干燥过夜,然后置于马弗炉中350 °C下煅烧3 h,还原后制得CuZnAl催化剂,记为CZA。 CuZnAl催化剂和HZSM-5分子筛物理混合获得CZA/HZSM-5。
采用离子交换法制备铜和锌双金属改性HMOR。 将一定量的硝酸铜和硝酸锌溶解在150 mL去离子水中,得0.2 mol/L的硝酸铜和硝酸锌溶液(两种金属总物质的量浓度为0.2 mol/L,通过离子交换方法使得Zn负载量约为Cu负载量的4倍),然后以每15 mL溶液添加1 g HMOR的比例添加HMOR, 在60 °C下回流搅拌16 h,产物经过滤、洗涤后在110 ℃下干燥过夜,于马弗炉中550 °C下煅烧3 h后,在300 °C下还原10 h制得CuZn-HMOR。
采用等体积浸渍法制备具有不同质量分数Sn的CuZnAl催化剂。 首先配备质量分数为0.1%、0.6%和1.2%的SnCl2溶液, 将其缓慢滴加到CZA催化剂上, 同时用玻璃棒不断搅拌并充分混合直至CZA催化剂表面被完全润湿。 将浸渍后所得催化剂放入超声震荡仪中超声处理3 h,然后在90 °C下干燥12 h,置于马弗炉中在360 °C下焙烧5 h后得到Sn-CZA催化剂, 不同质量分数Sn处理的CZA命名为αSn-CZA(α = 0.1,0.6,1.2)。
将上述催化剂在5~10 MPa压力下造粒,粉碎并筛分至20~40目备用。 将2.25 g CZA/HZSM-5放置于第一床层,4.5 g CuZn-HMOR放置于第二床层,2.25 g αSn-CZA催化剂放置于第三床层。
1.3 催化剂的表征
采用SHIMADZU-6000型X射线粉末衍射仪测定催化剂的晶体形态和结晶度,Cu Kα辐射,电流30 mA,电压40 kV,扫描范围2θ为5°~85°,扫描速率为8(°)/min。
采用Quantachrome Autosorb iQ型物理吸附分析仪分析催化剂样品的比表面积、孔容及孔径。 所有样品均在高真空的条件下进行预处理,在-196 °C下记录催化剂的吸/脱附数据。 由BET方程计算得到样品的比表面积, 采用BJH法计算样品的孔容和最可几孔径。
H2-TPR表征在配备有热导检测器的TP-5076动态吸附仪上进行,用于分析金属氧化物中铜物种的还原情况。 首先在N2气氛下将50 mg样品加热至400 °C并保持30 min, 脱除样品外表面及孔内的水和其他杂质; 冷却至30 °C后, 切换为5%H2/N2还原气;待基线平稳后将样品以10 °C/min的速率由30 °C升至900 °C, 同时通过热导检测器记录体系中H2的消耗量。
采用FEI F3型透射电子显微镜对催化剂的形貌和活性金属负载情况进行分析。 先将催化剂样品置于玛瑙研钵中充分研磨,然后置于乙醇溶剂中进行超声处理,用吸管吸取2~3滴清液滴于超薄碳膜(钼网)中,晾干后进行测试分析。
1.4 催化剂的性能评价
本实验采用连续型固定床反应装置,在一个反应器装置内由合成气经三个串联床层催化转化制乙醇。 该装置主要由供气、温度、压力和流量控制、反应器以及产物分离等六部分组成,反应器为不锈钢材质,管长900 mm,内径15 mm,内部配备测温热电偶套管,装置示意如图1所示。 串联床层催化剂装填在反应管中间部位,然后用瓷环(10~20目)填充反应管。确保反应管气密性良好之后,用30 mL/min H2在250 °C下对催化剂进行预还原处理,持续时间为3 h。 待温度降至200 °C切换n(H2):n(CO) = 1:1的合成气,在反应压力下稳定3 h后记录数据。 反应产物经冷肼气液分离,气相产物由GC-920型气相色谱仪使用面积归一法进行数据分析,由配备有热导(TCD)检测器的5A分子筛填充柱检测H2和CH4; 由配备氢离子火焰(FID)检测器的碳分子筛填充柱检测CO、CH4和CO2; 由配备FID检测器的氧化铝填充柱检测CH4及各种低碳烃类,各气体组分百分比通过CH4关联得到。液相产物由GC-950型气相色谱仪使用外标法进行数据分析, 由配备FID检测器的AE.FFAP毛细管色谱柱检测。CO转化率(XCO)和乙酸甲酯、乙酸、甲醇、乙醇和C2+醇类产物的选择性(Si)分别由式(1)、式(2)计算:

图1 合成气制乙醇反应装置示意

式中,nCO,inlet为原料气中CO的物质的量,mol;nCO,outlet为尾气中CO的物质的量,mol;Ci为转化为产物i的CO的物质的量,mol;C为转化的CO的总物质的量,mol。
2 结果与讨论
2.1 催化剂表征
2.1.1 XRD表征
CZA和αSn-CZA的XRD衍射谱如图2所示。 所有样品均可清楚地观察到CuO和ZnO的衍射峰,且并没有明显的与Al2O3相关的衍射峰,这可能与Al2O3无定型的性质有关[12]。除此之外,所有样品的XRD谱图中均未检测到与Sn相关的衍射峰,这说明通过浸渍法引入的Sn物种在载体CZA上分散均匀[12,13]。值得注意的是,与CZA样品相比,αSn-CZA样品对应于CuO物种的衍射峰强度略有升高,并且1.2Sn-CZA的衍射峰强度变化最明显,这说明助剂Sn成功负载在CZA载体上,并且CuO晶粒的结晶度与Sn负载量呈现正相关[14]。
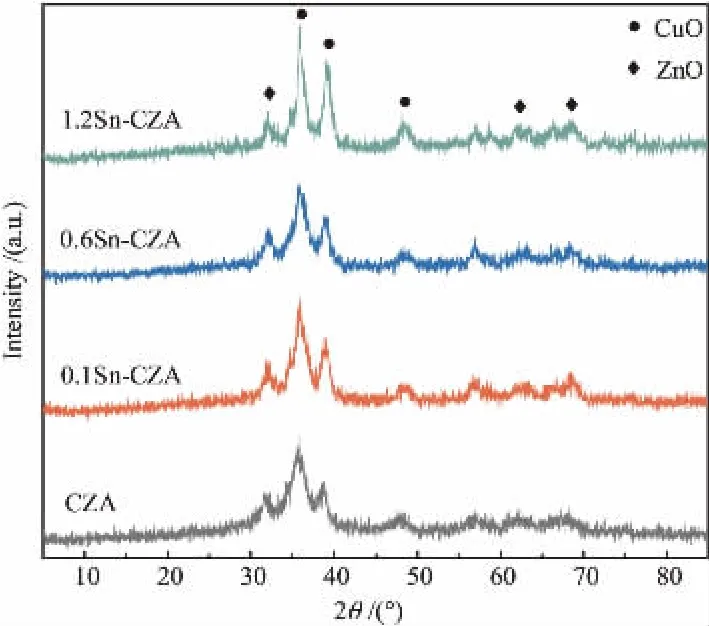
图2 不同Sn负载量CZA催化剂的XRD谱图
2.1.2 N2吸/脱附表征
CZA和αSn-CZA的N2吸/脱附结果和孔径分布如图3所示。 由图3(a)可知,样品均具有明显的滞回环,等温线均属于Ⅳ型,这是由于板状层的聚集使得催化剂中存在大量狭缝型孔道[15]。 CZA催化剂的吸/脱附曲线在p/p0接近于1时有明显的上升趋势, 表明CZA具有介孔或大孔结构。 催化剂样品的孔径分布如图3(b)所示,可知CZA和αSn-CZA的孔径主要集中在8~12 nm,说明介孔是CZA及αSn-CZA的主要孔道结构。 值得注意的是,1.2Sn-CZA滞回环有最缓慢的上升趋势,这说明随着Sn负载量的提高,催化剂孔道中介孔的占比逐渐减少[14]。同时引入助剂Sn后,催化剂样品的微孔数量比改性前明显增加,这可能与部分Sn物种进入介孔及催化剂的二次焙烧有关。各催化剂的孔结构特性如表1所示。 由表1可知,CZA 催化剂具有最大的比表面积128.094 m2/g,αSn-CZA相比CZA比表面积明显降低,且随着Sn负载量越高催化剂的比表面积越小。 除此之外,本文还发现四种催化剂样品具有相似的最可几孔径,这说明Sn的引入并不会造成CZA明显的孔道堵塞或坍塌,Sn物种在CZA载体上分散良好, 这与XRD表征结果相一致。
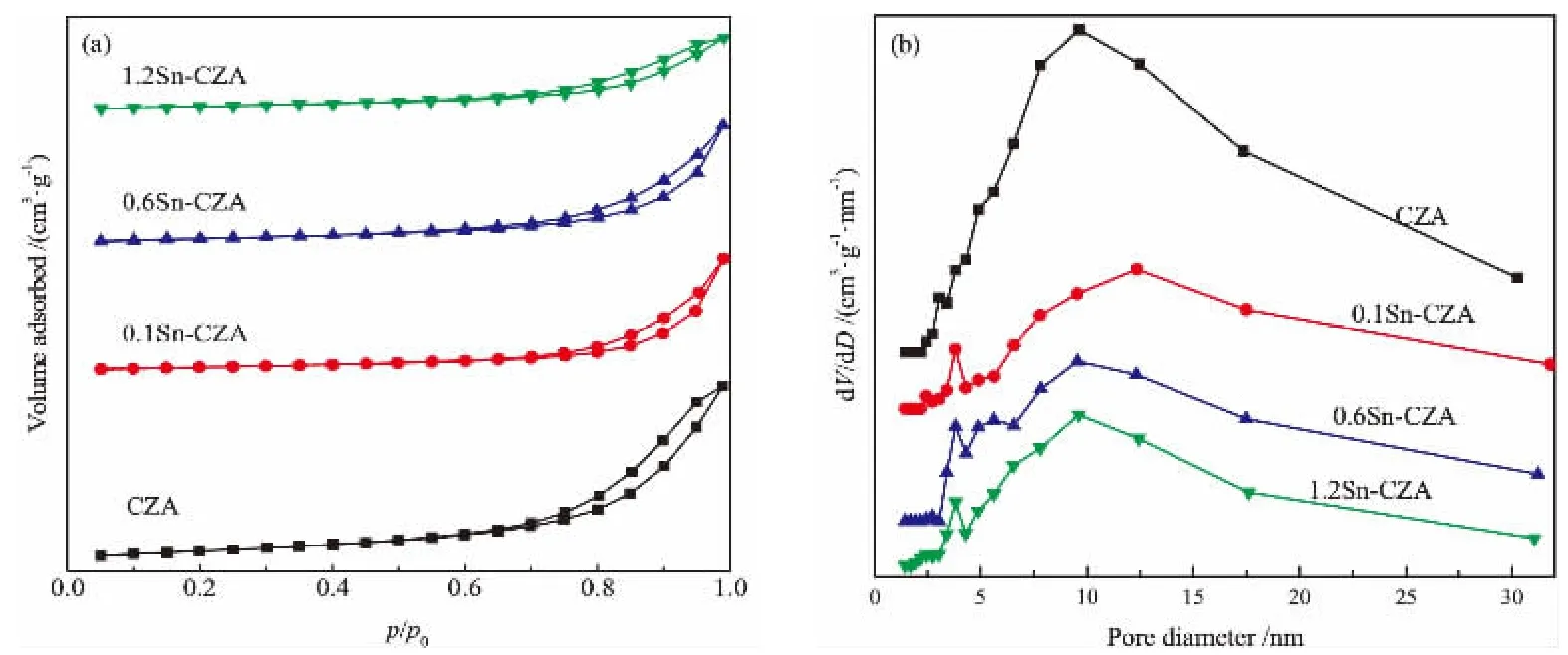
图3 不同Sn负载量CZA催化剂的(a)N2吸/脱附曲线和(b)孔径分布
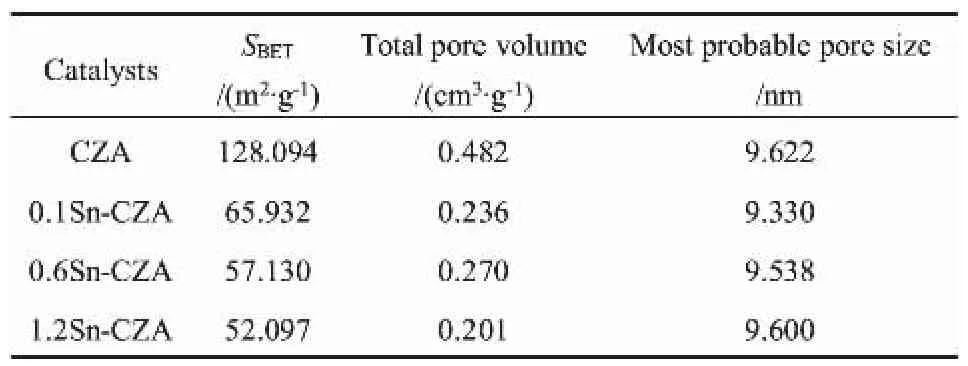
表1 各催化剂的孔结构特性
2.1.3 H2-TPR表征
采用H2-TPR分析样品的还原性质, 结果如图4所示,可知CZA中CuO在222 °C时被还原。 未掺杂Sn时,CZA的还原温度最低, 随着Sn的负载量从0.1%增加到1.2%,CuO还原温度逐渐增高,这说明引入Sn后改变了CuO的表面特性并与铜物种产生协同作用, 并且在Pt催化剂中也观察到了加入Sn后相似的作用,通过两种金属(Pt和Sn)形成的合金还原行为可以解释这种现象[9]。 根据文献报道,在经典的CZA体系中Al离子的引入会增强ZnO与Cu物种之间的相互作用,导致TPR图谱中宽峰的出现[16]。 本文四种催化剂的还原温度均显示了较宽的分布, 尤其是1.2Sn-CZA显示了最明显的宽峰, 这可能是由于引入Sn后会与Cu产生相互作用从而丰富了可还原的Cu种类[14]。
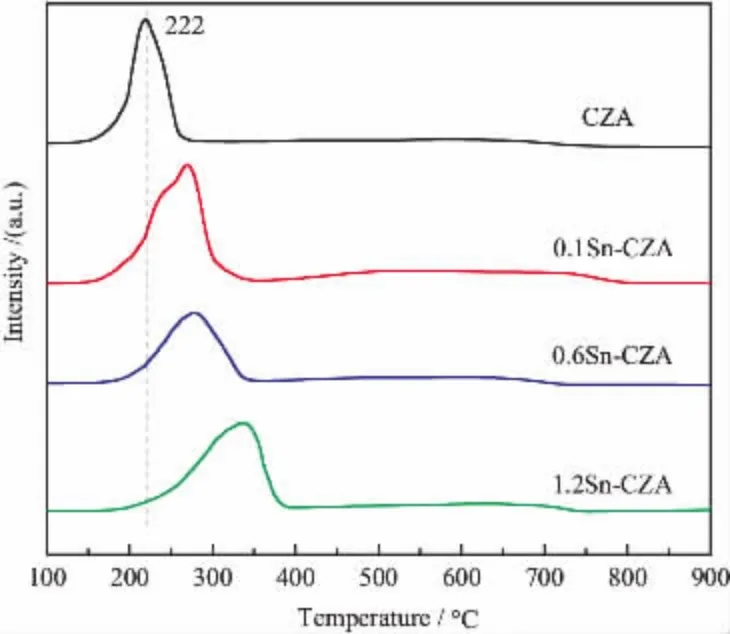
图4 不同Sn负载量CZA催化剂的H2-TPR曲线
2.1.4 TEM表征
图5为不同催化剂的透射电镜分析图像, 用以对催化剂的形貌和活性金属负载情况进行分析。 如图5(a)所示,铜锌氧化物均匀地分散在氧化铝载体上。 据报道,在CZA催化剂中铜的活性与Zn覆盖率之间有较强联系[18]。 TEM图像结果显示在CZA催化剂中没有明显的铜物种聚集,这是甲醇合成和乙酸甲酯加氢的前提。从图5(b)~图5(d)中可以看出,加入Sn后图像显示聚集的纳米颗粒形态平均粒径在10 nm左右。同时,HRTEM(图5(e))清晰地显示了归属于铜锡合金(101)晶面的晶格条纹,这种铜锡合金具有六方晶体结构,其中铜和锡原子以周期性方式分散[19]。这种合金的存在导致了铜物种更难被还原, 与H2-TPR中还原峰后移的现象相对应。

图5 (a)CZA、(b)0.1Sn-CZA、(c)0.6Sn-CZA 和(d)1.2Sn-CZA催化剂的TEM图及(e) 0.1Sn-CZA的HRTEM图
2.2 合成气制乙醇催化性能及稳定性评价
2.2.1 不同耦合模式下的CO转化率和产物选择性
首先研究了在不同耦合模式下由合成气间接法制乙醇的催化性能,具体的CO转化率和产物选择性如表2所示。 在耦合模式A、B、C、D下的反应器出口都检测到了大量CO2存在, 这说明反应过程中发生了水煤气变换(WGS)反应[20]。根据实验设计,第一层合成气在CZA/HZSM-5上发生合成气制二甲醚的反应,二甲醚在第二层CuZn-HMOR上发生羰基化反应生成乙酸甲酯, 乙酸甲酯在第三层αSn-CZA上加氢生成甲醇和乙醇。 在第一层上发生的合成气制二甲醚反应涉及甲醇脱水过程, 反应生成的水会在CZA上发生WGS反应生成CO2[6]。 由表2可知,在耦合模式B下获得了最高的乙醇选择性14.17%,其中CO2选择性为53.31%。 当耦合模式为A时,CO2选择性为60.48%。 实验结果表明,适量Sn的引入有利于抑制WGS反应生成CO2,并增强CZA的加氢活性。 这主要归功于Sn与Cu的强相互作用,由于Sn引入不会明显改变CuO物种的粒径,所以Sn很可能通过形成CuSn合金改变了Cu的电子性质或表面分布,进而加强了CZA的加氢活性。Sn的促进作用是由Sn负载量决定,负载量并非越高越好。 当催化剂组成为耦合模式D时,在13.80%的CO转化率下仅获得9.07%的乙醇选择性,而CO2选择性为65.27%,这说明高Sn负载量反而会促进WGS反应, 进而对合成甲醇产生不利影响,这可能与活性Cu物种更难被还原有关。 此外,从表2中还可知1.2Sn-CZA催化剂也促进了烃类(HCs)的生成,10.67%的HCs选择性明显高于其他Sn促进催化剂。 经过对比发现耦合模式D下的乙酸甲酯选择性最低,仅为0.01%。 假设实验中第二层催化剂的羰基化效果相似, 这表明耦合模式D下有更多的乙酸甲酯发生了加氢转化。 烃类选择性高的原因之一可能是乙酸甲酯加氢生成的乙醇进一步发生了脱水反应生成乙烯,这也在一定程度上促进了CO的转化[6,8]。
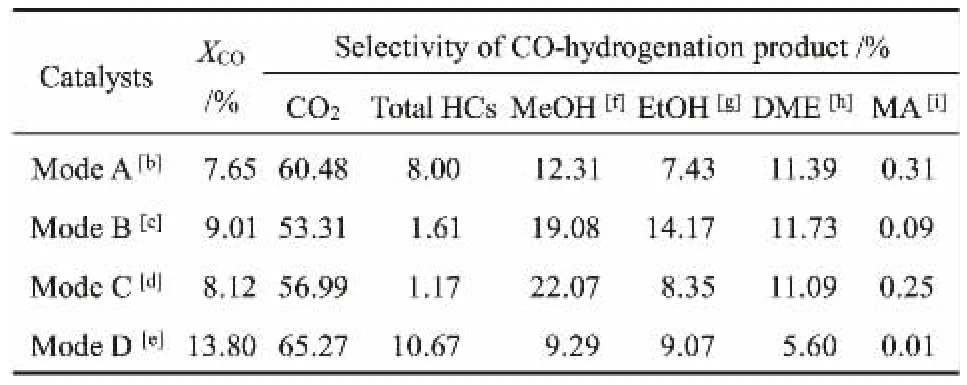
表2 不同耦合模式下合成气转化的主要产物分布[a]
2.2.2 不同耦合模式下催化剂稳定性测试
串联催化体系的稳定性测试结果如图6所示,可知适当负载量的Sn不仅提高了产物中乙醇的选择性,还增加了反应稳定性。 当采用0.1Sn-CZA作催化剂时,整个催化体系在48 h内并没有明显失活。随着Sn负载量升高,虽然CO转化率有所提高,但整个催化体系的稳定性下降。
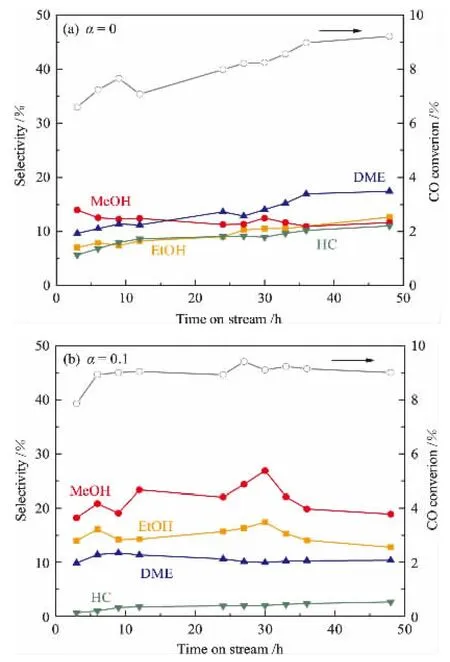
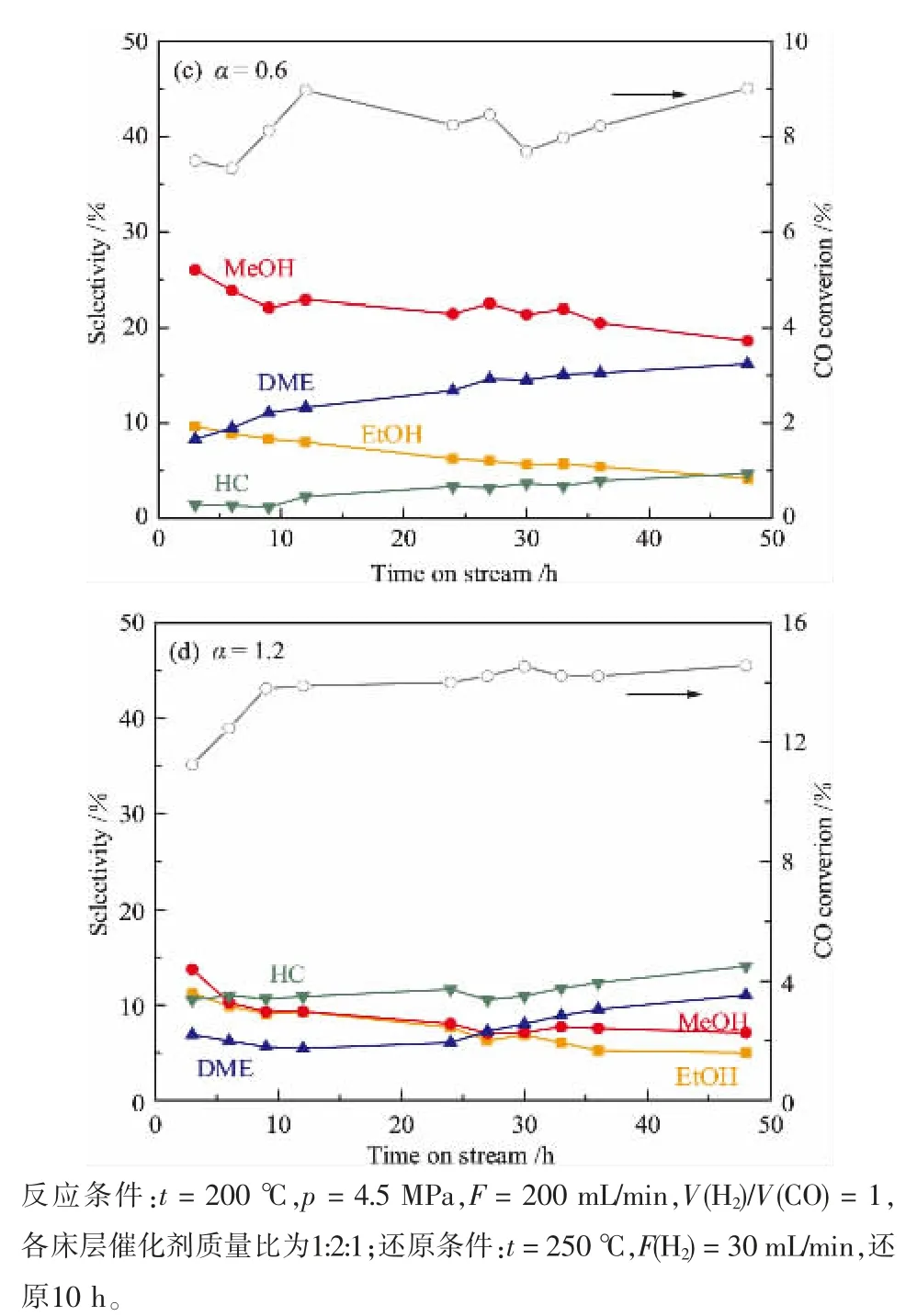
图6 不同Sn负载量CZA催化剂串联床层CZA/HZSM-5-CuZn-HMOR-αSn-CZA催化合成气制乙醇活性测试
此外,从图6中还可以看出甲醇和乙醇选择性呈正相关,甲醇和二甲醚选择性成负相关。 1.2Sn-CZA催化体系的甲醇合成活性最差,这可能是因为负载量过高时,Cu物种中甲醇合成活性位点被覆盖,从而降低了甲醇合成活性[9,21]。 由于甲醇通过羰基化生成乙酸,进而加氢会生成乙醇,因此甲醇的合成活性也会影响产物中乙醇的选择性。
3 结论
本文使用共沉淀法和等体积浸渍法制备了金属氧化物和沸石分子筛催化剂,并采用串联耦合的方法通过三床层将合成气在一个反应器内催化转化为乙醇。 将不同质量分数的Sn物种浸渍在CuZnAl催化剂上,重点研究了Sn对铜物种结构以及合成气制乙醇催化性能的影响。 结果表明:(1)在CuZnAl催化剂上浸渍Sn会形成CuSn合金,Cu与Sn之间的强相互作用不仅抑制了反应体系中发生的WGS反应,还提高了乙醇的选择性和反应稳定性;(2)适量的Sn会对反应产生积极影响,当Sn负载量为0.1%时由合成气制乙醇的反应在48 h内没有明显失活, 当Sn负载量为1.2%时会减弱活性铜物种的分散性,虽然提高了CO转化率,但同时也促进WGS反应、增加烃类的选择性,从而降低了甲醇的选择性。

