基于中医方证代谢组学策略研究知柏地黄丸质量标志物
刘绍博,孙晖,卢盛文,张爱华,王慧,魏文峰,韩金润,王喜军
(黑龙江中医药大学药学院,国家中医药管理局中医方证代谢组学研究中心,黑龙江 哈尔滨 150040)
知柏地黄丸作为治疗肾阴虚证的经典方剂,其独特的治疗效果,备受中医界的推崇。现代药理研究证明,知柏地黄丸对激素代谢紊乱具有良好的治疗作用,可以有效调控下丘脑-垂体-肾上腺轴等靶腺轴激素代谢紊乱症[1-3]。同时,在成分研究中,发现知柏地黄丸的化学成分复杂,含有包括生物碱、皂苷、单萜、黄酮类成分在内的多种化学物质。在体外检测到的96种化学成分中,25种来自关黄柏,22种来自知母,可见知母与关黄柏的重要性与配伍规律结果相一致。但现阶段知柏地黄丸的质量控制标准并没有完全表现出上述结果[4-5]。
根据《中国药典》要求,知柏地黄丸的质量控制标准为:马钱素不低于3.6 mg(大蜜丸);丹皮酚不低于5.0 mg(大蜜丸)。首先,知柏地黄丸是由众多药材组成,且化学物质繁杂的方剂,两种化学物质的标准不能完全、准确地反映知柏地黄丸的质量。其次,根据文献结果以及前期实验基础,我们发现关黄柏与知母是知柏地黄丸发挥疗效的重要组成部分,但马钱素和丹皮酚不是关黄柏与知母的主要成分,这与知柏地黄丸的配伍规律相矛盾。
本实验以中医方证代谢组学为研究策略[6-9],结合UPLC-MS高通量液质联用技术,构建了肾阴虚大鼠模型与知柏地黄丸药物有效性评价体系,通过代谢组学分析确定血液代谢标记物,并在有效状态下,寻找知柏地黄丸的血中移行成分,确定知柏地黄丸的药效物质基础。最终,根据药效物质基础的研究结果,依据中药质量标志物的基本原则,确定知柏地黄丸治疗肾阴虚证的潜在中药质量标志物。
1 材料
1.1 仪器
AcquityTM UPLC液相色谱仪(Waters 集团公司,美国);SynaptTM G2-Si质谱分析系统(Waters 集团公司,美国);MassLynx V4.1工作站(Waters 集团公司,美国);Sorvall ST 16R台式离心机(美国Thermo Scientific公司);KQ-500DB超声波清洗器(昆山市超声仪器有限公司);SL-1000XLS型移液器(梅特勒·托利多仪器有限公司,上海);氮吹仪(美国Organomation公司);Unique-R20多功能超纯水系统(厦门锐思捷水纯化技术有限公司,中国);Thermo Scientific 995 超低温冰箱(美国Thermo Scientific公司)。
1.2 药品与试剂
知母、熟地黄、山药、山茱萸、茯苓、泽泻、牡丹皮,7味中药材购于北京同仁堂哈尔滨总店,关黄柏购自于世一堂哈尔滨总店。乙腈为色谱级(德国Merck公司),甲醇为色谱级(美国Fisher公司),色谱级甲酸购自于天津科密欧化学试剂有限公司,亮氨酸脑啡肽来自美国Sigma公司。
1.3 药液的制备
取购买的中药饮片经高速多功能粉碎机粉碎后,过120目筛,得到细粉,经查知柏地黄丸的成人用量为9 g/次,每日2次,故算得大鼠所需剂量为1.62 g·kg-1·次-1,取知柏地黄丸细粉末,加适量0.5%的CMC-Na溶液溶解,超声处理约30 min,制成浓度为0.162 g/mL的灌胃溶液。
1.4 实验动物
清洁级SD大鼠,雄性,6周龄,体质量(220±20)g,由黑龙江中医药大学实验动物中心提供,动物许可证号(SCXK2015-0001)。室温饲养,动物自由摄食饮水。
2 方法
2.1 模型分组与复制
实验采用给予氢化可的松溶液的方式[10],复制肾阴虚证大鼠模型。取雄性SD大鼠50只,采用随机数表法,随机分成2组,即:空白对照组(C,n=20),肾阴虚证模型组(M,n=30),实验开始前进行7 d的适应性培养。实验开始后,M组大鼠灌胃给予氢化可的松溶液(50 mg·kg-1·d-1),共4 d,同时空白对照组每天灌胃给予生理盐水直到实验结束。
2.2 给药
自第5天起,模型组随机抽取10只大鼠,成立知柏地黄丸治疗组(Z,n=10),M组每天灌胃给予0.5%的CMC-Na溶液,同时Z组灌胃给予浓度为0.162 g/mL的知柏地黄丸溶液,C组每天给予0.5% CMC-Na溶液,持续7 d。
2.3 生物样品制备
所有动物采样前禁食12 h,并自由饮水,腹腔注射3%戊巴比妥那麻醉,肝门静脉取血,静置30 min后,离心取血清(4 ℃,3 500 r/min,15 min),所有血清样品均采用甲醇沉淀法进行蛋白去除[11],并采用0.22 μm微孔滤膜过滤后进行分析。
2.4 基础代谢与生化指标检测
治疗开始后,每日记录大鼠的体质量变化。实验最后一天,将各组大鼠放入小动物能量代谢仪中,24 h后取出,标准化测量各组大鼠的饮食量、饮水量、耗氧量、呼出量、总能量消耗与自主活动总量等基础代谢指标。生化指标采用全自动生化分析仪进行分析,检测过程中严格按照操作说明执行。
2.5 代谢组学分析条件
色谱柱:ACQUITY UPLCTMHSS C18柱(2.1 mm×100 mm,1.8 μm);流动相A为0.1%甲酸-乙腈,流动相B为0.1%甲酸-水;洗脱梯度:0~1.5 min,2%~16% A,1.5~2 min,16%~20% A,2~4 min,20%~60% A,4~5 min,60%~70% A,5~8 min,70%~75% A,8~9.5 min,75%~99%。质谱条件:采用电喷雾离子源(ESI),正离子模式下:毛细管电压为2.6 kV;锥孔电压为40 V;离子源温度为110 ℃;脱溶剂气温度为350 ℃,脱溶剂气流量为600 L/h;锥孔反吹气流量为50 L/h。负离子模式下:毛细管电压为2.4 kV;锥孔电压为40 V;离子源温度为110 ℃;脱溶剂气温度为350 ℃,脱溶剂气流量为600 L/h;锥孔反吹气流量为50 L/h。数据采集设置为0.2 s,扫描延迟为0.1 s。质量数据采集范围为50~1 200 Da。为获准确的质量采集,在4 ng/mL的浓度下采用亮氨酸脑啡肽进行质量锁定,在10 mL/min的流速下通过锁定喷雾界面进行使用,以确保MS分析的准确性。
2.6 体内成分分析的样品前处理
取大鼠血清2 mL,精密加入40 μL磷酸,超声处理1 min,涡旋混匀30 s后,上样到预先以2 mL甲醇、2 mL水活化平衡好的HLB固相萃取小柱上,适当加压缓慢成滴通过小柱,以2 mL水淋洗,洗液弃去,再以2 mL纯甲醇洗脱,收集甲醇洗脱液,40 ℃下氮气吹干,残渣以150 μL浓度为60%甲醇复溶,在4 ℃,13 000 r/min离心15 min,取上清液作为供试品溶液进UOLC-Q-TOF-MS分析。
2.7 知柏地黄丸体内分析条件
色谱柱:ACQUITY UPLCTMHSS T3柱(2.1 mm×100 mm,1.8 μm);柱温: 30 ℃;流速:0.3 mL/min;进样体积:4 μL;流动相A为0.1%甲酸-乙腈,流动相B为0.1%甲酸-水;洗脱梯度:0~1.5 min,2%~16% A,1.5~5 min,16%~20% A,5~8 min,20%~27% A,8~11 min,27%~30% A,11~15 min,30%~70% A,15~18 min,70%~99%。质谱条件:采用电喷雾离子源(ESI),正离子模式下:毛细管电压为3.0 kV;锥孔电压为30 V;离子源温度为110 ℃;脱溶剂气温度为350 ℃,脱溶剂气流量为600 L/h;锥孔反吹气流量为50 L/h。负离子模式下:毛细管电压为2.8 kV;锥孔电压为40 V;离子源温度为110 ℃;脱溶剂气温度为350 ℃,脱溶剂气流量为600 L/h;锥孔反吹气流量为50 L/h。数据采集设置为0.2 s,扫描延迟为0.1 s。质量数据采集范围为50~1 200 Da。为获准确的质量采集,在4 ng/mL的浓度下采用亮氨酸脑啡肽进行质量锁定,在10 mL/min的流速下通过锁定喷雾界面进行使用,以确保MS分析的准确性。
2.8 数据处理
2.8.1 统计学分析
所得数据采用Graphpad Prism 8.0软件进行单因素方差分析(one-way ANOVA),P<0.05为差异有统计学意义。
2.8.2 生物标记物分析
经UPLC-Q-TOF-MS提取代谢数据,所得血液ESI-MS代谢轮廓数据导入Progenensis QI软件后,进行数据的前处理,所得离子进一步进行PCA分析,得到Score plot图,随后利用EZinfo 2.0软件进行OPLS-DA分析,根据所得vip图,并结合组间差异t检验的分析结果,确定潜在生物标记物,进而依据HMDB数据库进行相关检索,最终利用Masslynx 4.1软件Massfragment模块对圈定的生物标记物进行二级结构验证[12]。
2.8.3 血中移行成分分析
通过QI软件处理后,利用EZinfo软件对各组数据进行进一步的PCA分析及OPLS-DA分析,随后进行S-plot及Variables-Trend分析,同时依据Masslynx 4.1软件中的Metabolynx模块,最终确定知柏地黄丸治疗肾阴虚证模型的有效状态下血中移行成分[13]。
2.8.4 关联性分析
采用血清化学成分与代谢标记物关联性性分析法[14-15](Plotting of Correlation between Marker Metabolites and Serum Constituents,PCMS),对知柏地黄丸显效成分与肾阴虚证生物标记物进行关联,以相关系数r1为0.6和r2为0.7进行设定,确定0.6≤r≤1为潜在药效物质基础的筛选标准,圈定治疗肾阴虚证模型的潜在药效物质基础。
3 结果
3.1 模型评价结果分析
两组大鼠的初始体质量没有显著性差异。但自造模的第二天开始,模型组体质量开始迅速下降,与空白对照组相比,差异极显著(P<0.01),见表1。模型组的耗氧量、二氧化碳呼出量和呼吸商均有极显著性差异,并呈下降趋势(P<0.01)。模型组大鼠饮水量极显著性增加(P<0.01),摄食量和能量消耗量极显著性减少(P<0.01)。模型组在运动方面有极显著性差异(P<0.01),具体分析结果如表2所示。模型组与空白对照组比较,cAMP、cGMP、CORT、17-OHCS、血清肌酐均有明显变化,各项变化均有显著或极显著性差异(P<0.01,P<0.05),具体分析结果见表2。综上所述,模型组大鼠体质量减轻、运动量减少、无食欲、饮水量增加、下丘脑-垂体-肾上腺轴(HPA)发生改变,与临床患者的病理表现相符,大鼠肾阴虚证模型复制成功。
3.2 代谢组学分析结果
模型复制成功后,对空白对照组与模型组进行血液代谢轮廓分析,得到相应的PCA与OPLS-DA得分图和S&VIP-plot图,如图1所示。依据二级质谱信息联合数据库分析,最终共表征肾阴虚大鼠模型的血液代谢标记物26个,具体信息如表3所示。
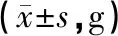
表1 各组大鼠体质量变化
表2 各组大鼠基础代谢与生化指标变化
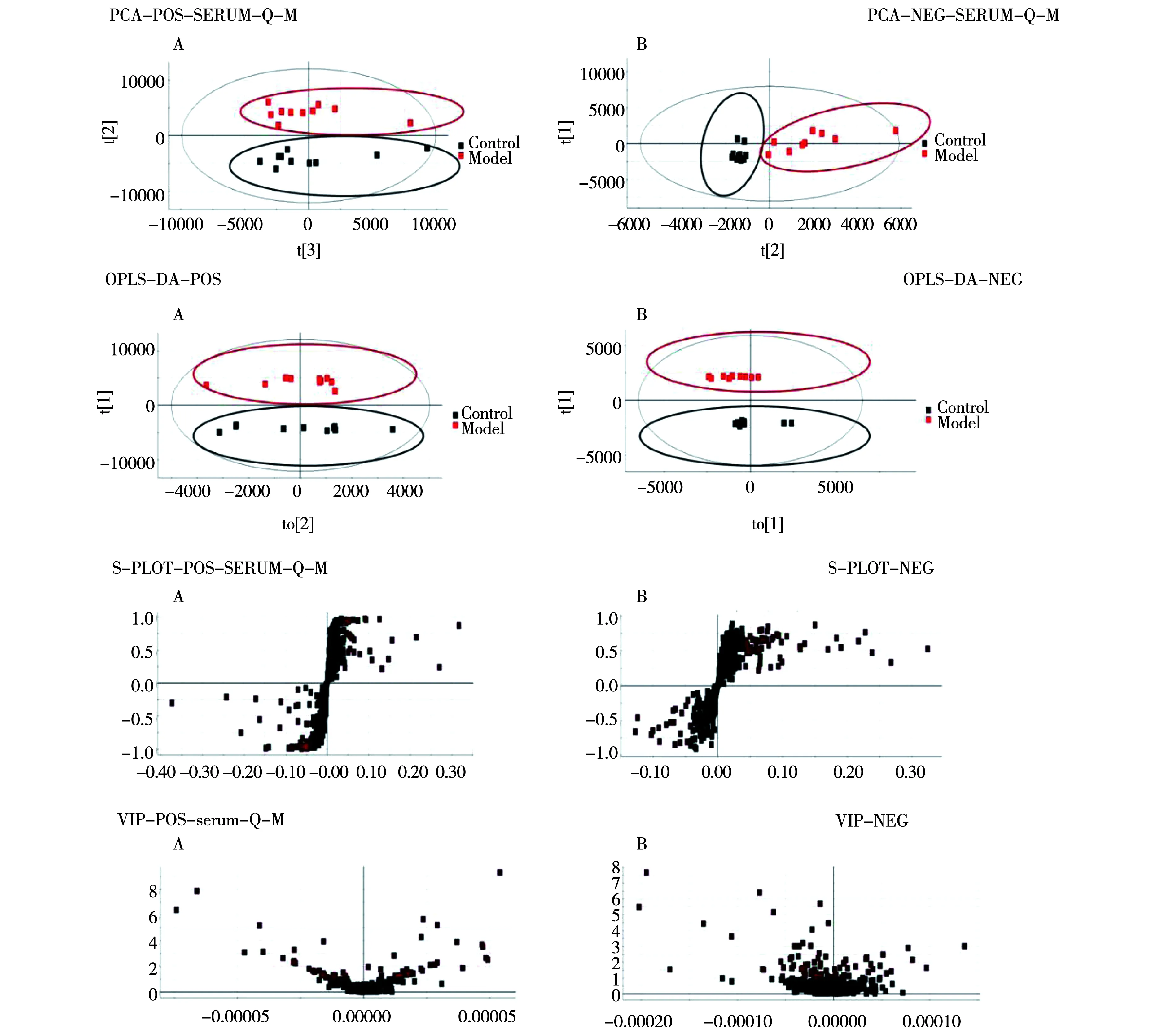
注:A.正离子模式;B.负离子模式;自上而下分别为大鼠PCA分析、大鼠OPLS-DA分析、大鼠S&VIP-plot分析。图1 生物标记物的分析鉴定
3.3 药物有效性评价分析
在体质量方面,如表4所示,知柏地黄丸治疗组与空白对照组在最后一天没有显著性差异。但模型组体质量上升缓慢,直至最后一天,仍与空白对照组保持显著性差异(P<0.05)。基础代谢结果显示,与空白对照组相比,知柏地黄丸治疗组各项差异均无显著性。但模型组的耗氧量、呼出二氧化碳量、呼吸熵、能量消耗、自主活动、饮食量与饮水量等各项指标则差异极为显著(P<0.01)。生化分析结果表明,知柏地黄丸治疗组各指标与空白对照组比较,差异均无显著性,而模型组与空白对照组比较时,发现cAMP、cGMP、CORT等各项生化指标显著性明显(P<0.05),见表5。综上所述,知柏地黄丸治疗组,经过治疗后,大鼠体质量持续增加,运动量显著提高,食欲增加,饮水量减少,下丘脑-垂体-肾上腺轴(HPA)紊乱出现回调。而模型组仍然保持显著的病理状态,上述结果表明知柏地黄丸治疗肾阴虚证的疗效是肯定的。
3.4 知柏地黄丸血中移行成分分析
如图2所示,空白对照组与模型组区分明显,说明模型组大鼠的代谢扰动仍然存在,而知柏地黄丸治疗组的矢量位置趋近对照组,说明经过治疗后,知柏地黄丸对肾阴虚证模型大鼠起到明显改善作用,在26个血液潜在生物标记物中,经过知柏地黄丸治疗后,共有19个发生显著性回调,见图3。随后,利用UPLC-HDMS技术对知柏地黄丸治疗肾阴虚有效状态下的血中移行成分进行分析,共发现了38个原型成分入血,9个为代谢成分,详细信息见表6和表7。
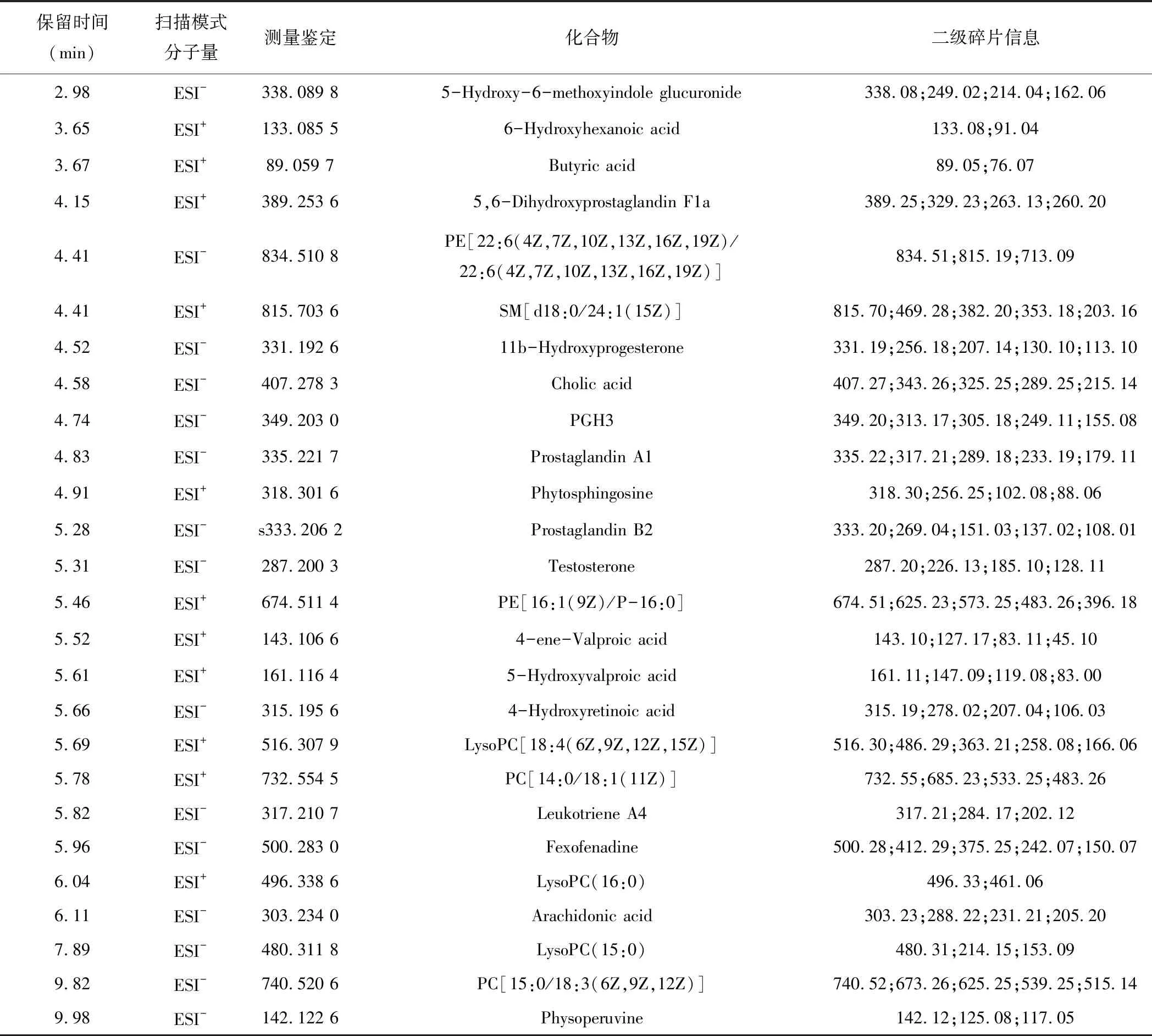
表3 肾阴虚模型大鼠血液代谢标记物的具体信息表
表4 各组大鼠治疗期的体质量变化
表5 各组大鼠治疗期的基础代谢与生化指标变化
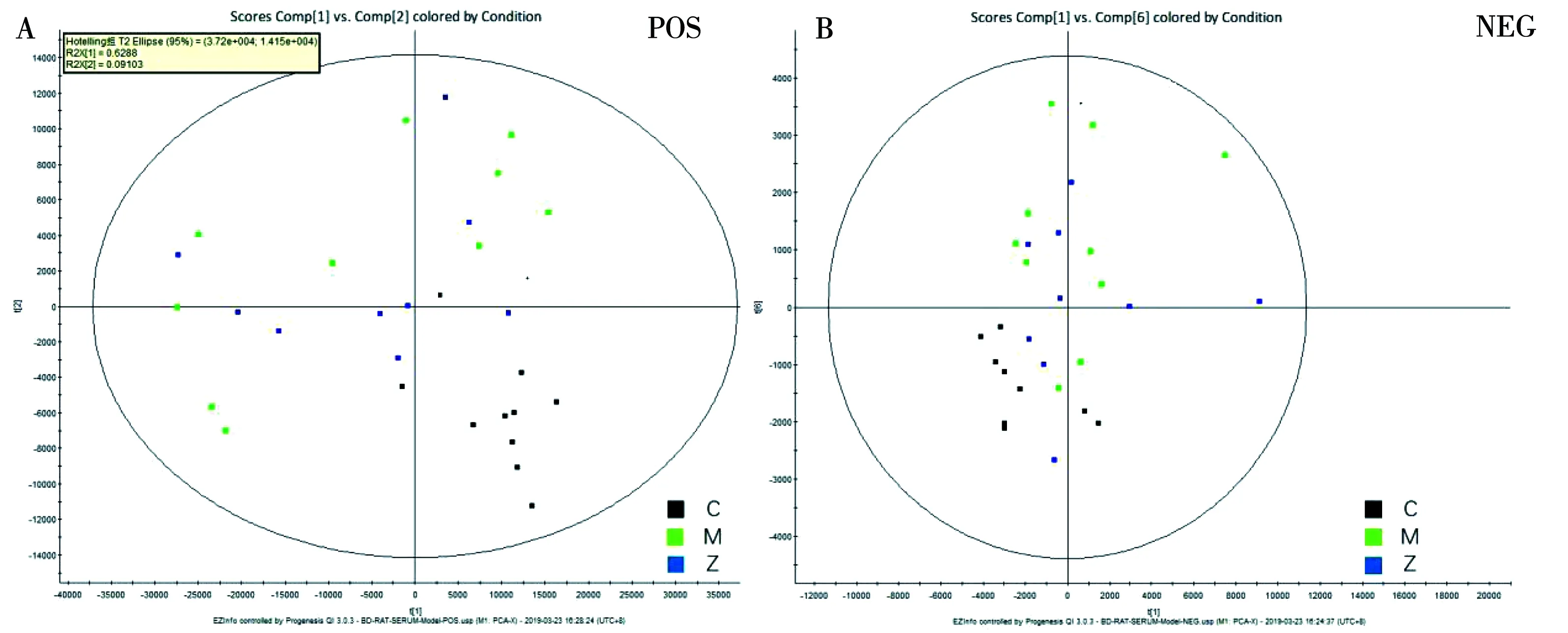
注:A.正离子模式;B.负离子模式;C.空白对照组,M.模型组,Z.知柏地黄丸治疗组。图2 各组大鼠血液代谢轮廓分析图
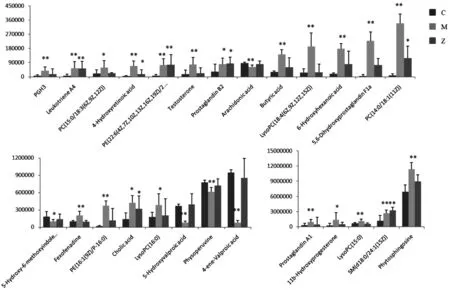
注:C.空白对照组,M.模型组,Z.知柏地黄丸治疗组;与C组大鼠比较,*P<0.05,**P<0.01。图3 各组大鼠血液代谢标记物含量变化图

表6 原型入血成分分析表征结果
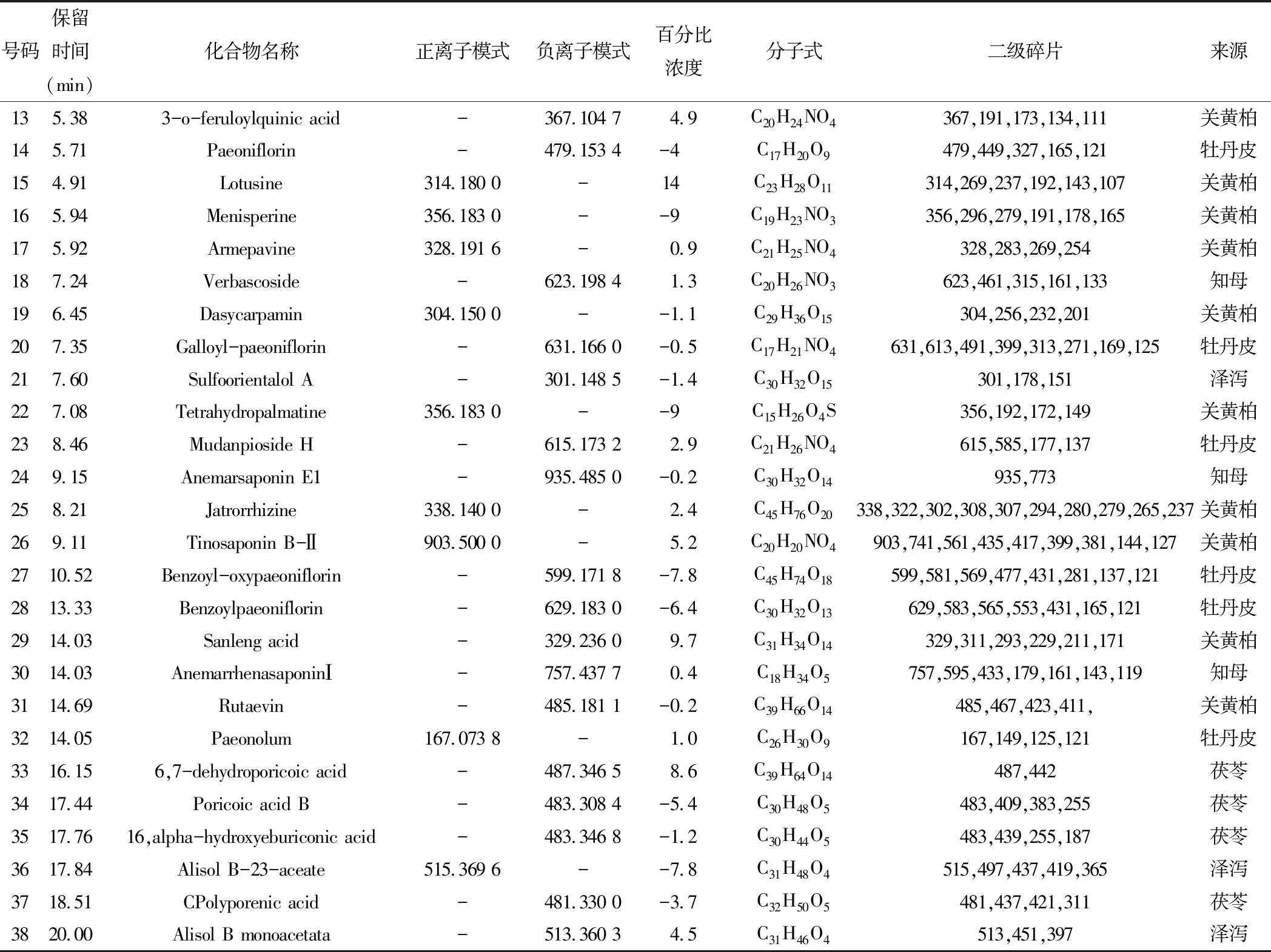
续表6
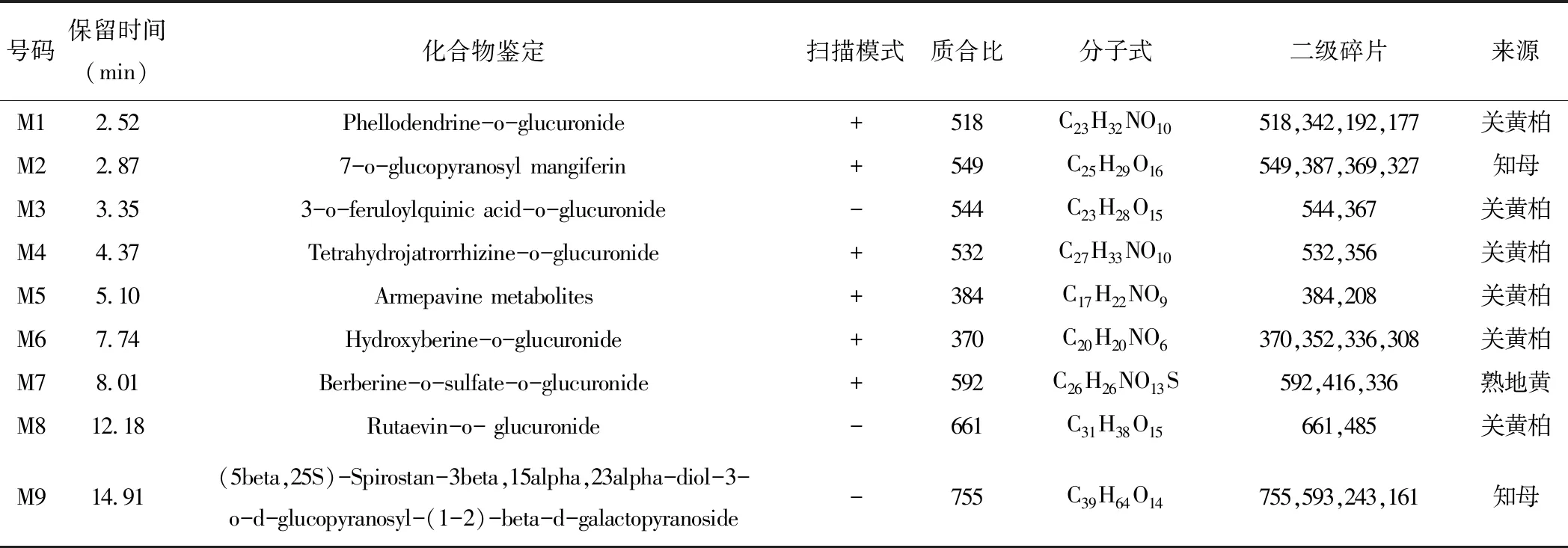
表7 药物代谢成分分析表征结果
3.5 知柏地黄丸治疗肾阴虚证的药效物质基础研究
将中药血清中移行成分与生物标记物含量变化合并导入PCMS软件,通过双变量BCA分析。设置本试验研究相关系数1为0.6,相关系数2为0.7,如图4所示,其中10个为极度相关性成分,1个为高度相关性成分,极度相关性成分分别为:棉子糖、没食子酸、1,7-O-没食子酸-D-景天庚酮糖、泽泻醇B单乙酸酯、四氢胡萝卜素-O-葡萄糖醛酸盐、小檗碱-O-硫酸盐-O-葡萄糖醛酸盐,藤本代谢物为高度相关性成分,以上11个成分为知柏地黄丸治疗肾阴虚证模型大鼠的潜在药效物质基础。根据Q-marker的基本条件,Q-marker应具有独特的固有成分,并保持清晰的化学结构,具有生物活性,可进行定性和定量分析,符合中药配伍理论。最后,确定知柏地黄丸治疗肾阴虚证的质量标志物为药效物质基础中的原型成分:丹皮酚、没食子酸、棉子糖、芍药苷、药根醇、泽泻醇B单乙酸酯。
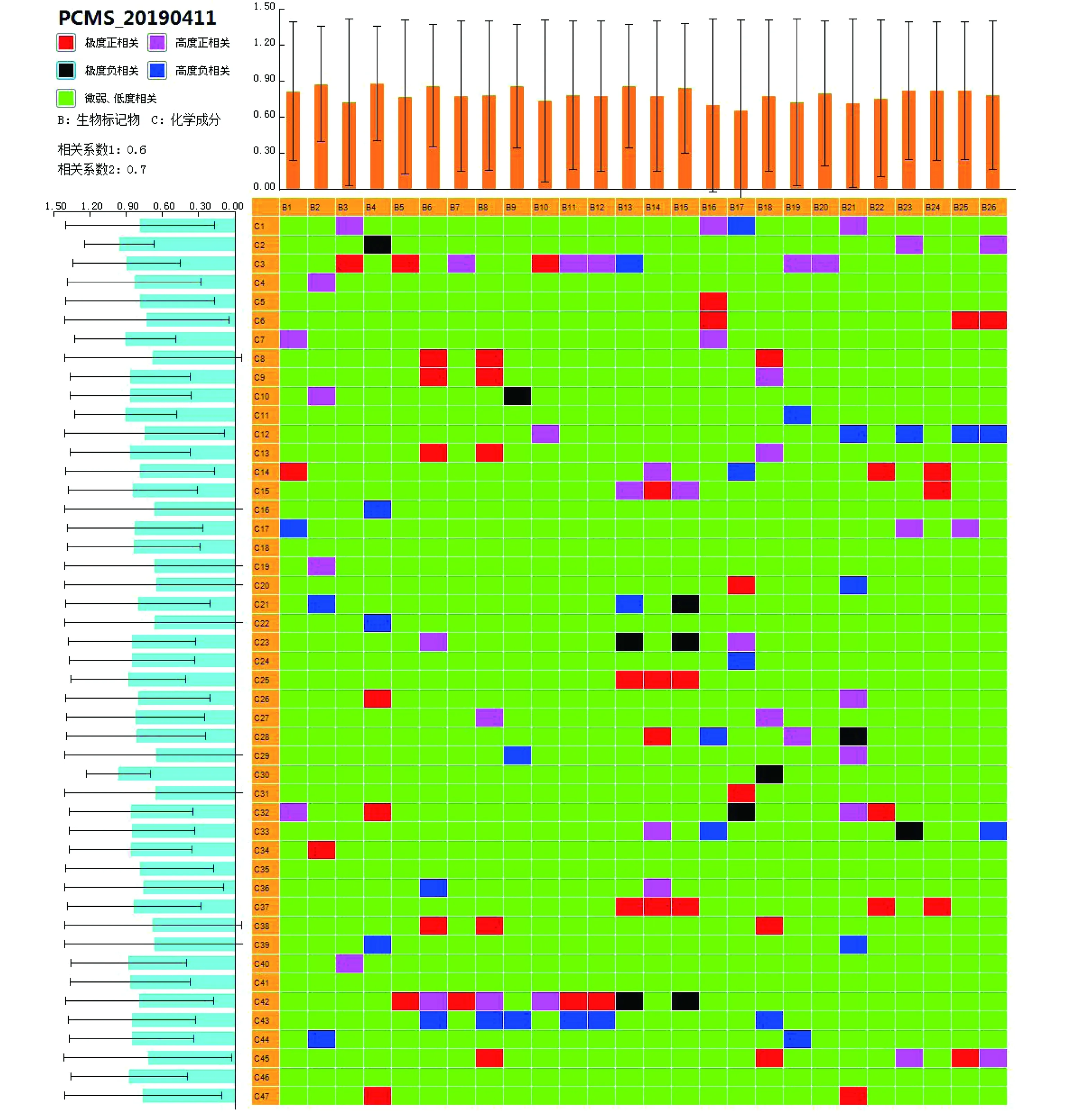
图4 知柏地黄丸血中移行成分与肾阴虚模型血液潜在生物标记物的相关性分析
4 讨论
通过代谢组学的研究方法,共找到26个肾阴虚血液代谢标记物,主要与花生四烯酸代谢、甘油磷脂代谢、类固醇激素生物合成、戊糖与葡萄糖醛酸相互转化、淀粉和蔗糖代谢、糖基磷脂酰肌醇、鞘脂代谢、视黄醇代谢、丁酸代谢、一级胆汁酸生物合成相关。
其中PGH3(前列腺素H3)、Prostaglandin A1(前列腺素A1)、Prostaglandin B2(前列腺素B2)与花生四烯酸均属于花生四烯酸代谢通路。花生四烯酸是人体内一种必须脂肪酸,也是一种重要的不饱和脂肪酸,花生四烯酸主要以磷脂的形式存在于细胞膜上[16-17]。在正常状态下,游离的花生四烯酸含量较低,但当细胞膜受到各种刺激时,花生四烯酸便从细胞膜磷脂池中被释放出来,在环氧酶的作用下,经合成不稳定的环内过氧化合物后,形成PGH2,最后由PGH2形成多种前列腺素物质,参与多种前列素的合成。而前列腺素作用广泛,可以通过抑制内分泌细胞中环腺苷酸(cAMP)的释放水平,进而影响激素的合成与释放,例如促使甲状腺素分泌和肾上腺皮质激素的合成等,从此点讲,肾阴虚与神经内分泌紊乱具有密切的关系[18]。
糖代谢是指葡萄糖、糖原等在体内的一系列复杂的化学反应,是机体中糖的主要来源,与人体的生命活动息息相关[19-21]。机体内糖代谢途径有很多,其中糖醛酸途径以及淀粉和蔗糖代谢在葡萄糖代谢中占有一部分作用[22]。本实验在氢化可的松的作用下,线粒体的功能处于紊乱状态,从而导致能量代谢(糖代谢)紊乱。在本实验中模型组戊糖喝葡萄糖醛酸相互转化的过程当中发现标记物5-羟基-6-甲氧基吲哚葡萄糖醛酸含量低表达,推测模型组内大鼠可能出现一定低血糖的症状。

