双佐剂新型冠状病毒灭活疫苗免疫原性及中和效价的测定
王瑞博,许定花,刘家胜,张 弓,柯江伟,龚昱斌,李方仲,韩 璐,徐国华,司小伟,沈吉友,邵聪文
(浙江天元生物药业有限公司,浙江 杭州 311100)
0 引言
2019年末开始,席卷全球并蔓延至今的严重急性呼吸道综合症疫情,是由新型冠状病毒(SARS-CoV-2)所引起的[1].疫情发生后,国内外迅速组织开展多种新型冠状病毒疫苗的研究[1-2],其中传统的灭活疫苗由于其安全、不存在散毒的危险、便于贮存和运输、产生抗体水平高等优点,很快进入临床并用于全球的免疫接种[3].
新型冠状病毒灭活疫苗(Inactivated SARS-CoV-2 vaccine)含有病毒的所有抗原,免疫动物后可以产生针对病毒所有蛋白的抗体,从而使机体获得适应性免疫[4].其中,病毒表面棘突蛋白(S蛋白)是SARSCoV-2的所有结构蛋白的主要抗原成分,负责诱导宿主免疫反应[5-6],与疫苗引起中和抗体水平关联度很大[7].而且,靶向S蛋白的抗体可以诱导针对病毒感染的保护性免疫[8],因此,S蛋白的特异性抗体效价是检测新冠疫苗保护作用的重要标志.但从当前国内研发进展较快的几款新冠病毒灭活疫苗动物和临床试验数据看出,中和抗体数值偏低,且在免疫效果和免疫时间上可能都存在不足[3,9-10].因此,必须通过添加佐剂的方式来提高疫苗的免疫效果.
CpG是一类合成的、含有1个或多个非甲基化的单链DNA,可通过DC细胞的吸附和内吞作用,被细胞质内膜上TLR9受体识别,引发天然免疫和获得性免疫应答,从而介导对病毒和细菌的清除,增强免疫效果[11].CpG还能协同刺激抗原特异性B细胞和T细胞分化,有效地激活获得性免疫,并刺激B细胞分泌IL-6、IL-10等细胞因子和表达MHCⅡ、B7-1、B7-2等表面分子,阻止B细胞的凋亡,增强特异性抗体的分泌[12];同时,CpG还能直接激活单核细胞、巨噬细胞和树突细胞,引起这些细胞分泌IL-12、TNFα等Th1样为主的细胞因子,增强细胞免疫的效果[13].国外已有Dynavax公司的CpG佐剂乙肝疫苗上市销售.
本文拟在当前铝佐剂新型冠状病毒灭活疫苗的基础上,添加CpG佐剂制成双佐剂新冠灭活疫苗,可以有效地提高当前血清效价和中和抗体水平,并降低抗原用量,降低生产成本,提高疫苗产率以及未来全球新冠疫苗的使用覆盖率,造福人类.
1 材料
1.1 主要试剂及材料
Vero细胞,购买于ATCC,编号CCL-81;COVID-19新型冠状病毒毒株(毒株号:ZJU-CV)由浙江大学传染病诊治国家重点实验室分离;β-丙内酯购买于SERVA;核酸酶购买于Merck;氢氧化铝为自制;CpG佐剂来源于南京华普生物技术股份有限公司;BALB/C小鼠购买于北京维通利华实验动物技术有限公司;纯化后的灭活病毒原液,公司自制;新冠重组S1蛋白,购自北京义翘神州生物技术有限公司;阴性血清,取自免疫前的动物.
1.2 仪 器
冰箱购自海尔集团有限公司,型号为HYC-390;电热恒温培养箱购自美国STIK集团公司,型号为CTHI-250B;纯化层析系统购自GE,型号为AKTA Pure;酶标仪购自美谷分子(Molecular Devices),型号为VersaMax.
2 方法
2.1 灭活疫苗原液的制备
从液氮罐中取出相应数量的Vero细胞,复苏并置于37℃培养箱培养传代,直至达到生产规模细胞数量.然后在P3操作区进行生产用病毒液的制备,在接种前用MEM培养液将毒种稀释至相应梯度,然后加入到细胞工厂,混匀完毕后旋紧盖子,放入35℃培养箱培养.当病变达到50%~80%后,收集培养上清并按1∶4 000比例加入β-丙内酯灭活20h.灭活完毕后,取样在Vero细胞盲传,以细胞病变法检查病毒,结果应均为阴性.
转到普通洁净操作区进行超滤浓缩30到50倍,添加核酸酶消化Vero细胞DNA,然后用纯化层析系统纯化,收获样品溶液第一峰到收集瓶中.除菌过滤,取样进行蛋白含量和抗原含量测定,加入人血白蛋白至0.3%~0.5%,即为原液.
2.2 不同配方灭活疫苗半成品及成品的制备
在无菌操作间A级层流下,配制半成品原液:新冠单价抗原总蛋白的终浓度为2、4、8μg/mL,人血白蛋白的终浓度为0.3%~0.5%,氢氧化铝(自制)终浓度为450μg/mL,CpG佐剂终浓度为5、20、40、80 μg/mL,然后分装至无菌西林瓶中,0.5mL/瓶,即为成品.所有样品配方分组及规格见表1.
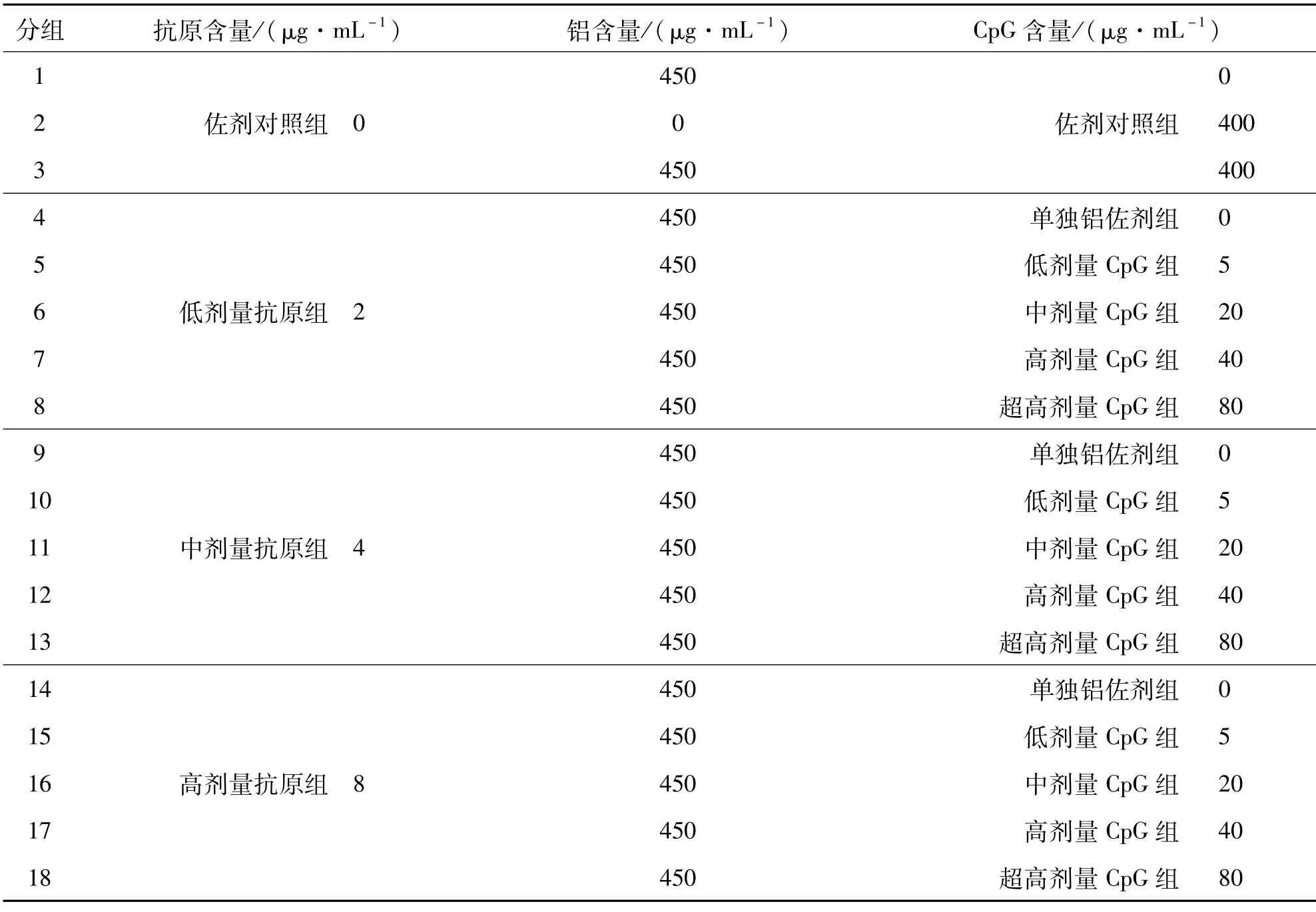
表1 新冠灭活疫苗成品配方规格Tab.1 Formulation of COVID-19 inactivated vaccine
2.3 动物免疫及处理
选取18~20 g的BALB/C小鼠(购买于维通利华),按照表1配制分组进行实验,每组8只,雌雄各半;每组按设计的免疫程序,在D0和D14天分别以腹腔注射免疫小鼠,每次注射0.5mL.按实验设计时间,分别在D0、D6、D13、D21和D28采血并分离血清,所有血清检测全病毒和S1蛋白特异性IgG,以及病毒中和抗体;按统计学计算每组动物血清IgG和病毒中和抗体几何平均效价(GMT值).
2.4 免疫动物特异性抗体水平检测
先用包被液稀释纯化后的灭活病毒原液和S1重组蛋白抗原,包被到酶标板中,2~8℃过夜.次日,用TPBS(含吐温-20的PBS溶液)清洗3遍,加入封闭液(含10%脱脂奶粉的PBS溶液)在37℃下封闭1h.然后用TPBS清洗3遍,加入用封闭液稀释成不同比例的新冠病毒实验血清(取自2.3中的不同组免疫小鼠)或阴性血清(取自免疫前的小鼠),37℃下结合1h.TPBS清洗3遍后,加入用封闭液以1∶4 000稀释后的酶标二抗,37℃下结合1h.TPBS清洗3遍后,加入显色液在室温下显色3~5min,然后加入终止液终止反应.
酶标仪下,在450 nm波长处读值.以每个96孔板中的阴性孔读数平均值的2.1倍作为Cutoff值判断阴阳性,从而确定每个血清样品的效价.
2.5 中和抗体检测
在P3洁净操作区内,取毒种一支接种到准备好的Vero细胞中,置35℃培养箱培养.当细胞发生病变感染率≥80%则可收集.收集后进行病毒滴度的测定,用培养基维持液稀释至200 TCID50/50μL,备用.将待测血清样本用无血清MEM培养基作连续1∶10稀释,然后过滤除菌,同时取阴性对照小鼠血清同法作系列浓度稀释为阴性对照.取96孔培养板,按纵向(A-G)每孔加入50μL稀释的待测血清和50μL 200 TCID50的病毒液,每个血清浓度设3个复孔.轻柔混匀血清和病毒液,37℃孵育1 h.
将传代培养的Vero细胞消化吹散后,用培养液将细胞浓度调准至2×105/mL.取100μL细胞加入至上述含病毒/血清混合物的培养板孔中并混匀,放置于35°C细胞培养箱中继续培养.接种后第4天观察细胞病变(CPE)情况,第6天最终判定结果.判定结果是需满足:抗体本身无明显细胞毒性;正常细胞对照成立;病毒对照CPE达++++.以能抑制细胞不受100 TCID50的新型冠状病毒感染所致的细胞病变效应的血清最高稀释度,为该血清样本的抗病毒中和活性或效价.
3 结果
3.1 不同配方规格新冠疫苗成品的制备
配制好的双佐剂新冠灭活疫苗成品从抗原含量上来说,分为低(组4-8)、中(组9-13)、高(组14-18)三个剂量,组合低、中、高、超高剂量的CpG佐剂,用以在动物上评价佐剂的剂量影响.同时,配方组还设计了佐剂对照组(组1-3).
3.2 不同配方新冠疫苗免疫动物后特异性抗体效价
最先检测了D21的血清样品,发现佐剂对照组的全病毒效价很高,背景影响较大,所以,其他天血清仅做了S1蛋白特异性抗体水平的检测.各组配方疫苗在D06天就产生了S1蛋白特异性的抗体,然后逐渐增高.由于在D28天就终止了免疫实验,所以无法确定D28的抗体水平是否为最高.结果见图1.
在D28天(图1d)的结果中,与单独铝佐剂组相比(组4、9),低、中剂量抗原组在添加CpG后,S1蛋白抗体效价远大于单独铝佐剂组,效价水平可以达到200 000以上,但超高剂量CpG组(组8、13)下的效价水平反而比其他CpG剂量组要低.而在高剂量抗原下,超高剂量CpG组抗体效价水平又有所恢复(组18).


图1 免疫后小鼠血清中新冠病毒特异性抗体效价Fig.1 Titers of SARS-CoV-2 specific antibodies in mouse serum after immunization
3.3 不同配方新冠疫苗中和抗体效价
通过灭活疫苗体外细胞效力试验来检测血清中的中和抗体水平,各组几何平均效价(GMT值)具体结果见表2.各组配方疫苗在D13天才产生了较低水平的中和抗体,然后逐渐增高.在D21天就已经达到了较高的水平,同样由于在D28就终止了免疫实验,无法确定是否为最高.

表2 新冠灭活疫苗中和抗体效价Tab.2 Neutralization titer of COVID-19 inactivated vaccine
在D28天的结果中,低剂量抗原下,添加CpG后(组5、6、7、8),中和效价水平明显高于单独铝佐剂组(组4),但不同剂量CpG组差别不大,效价均达到了600以上.中剂量抗原下,整体结果与低剂量抗原组相似,但水平略高,效价均达到了1000以上;但超高CpG剂量组(组13)水平反而低于其他组(组9、10、11、12).而在高剂量抗原下,添加CpG后,中和抗体效价水平(组15、16、17、18)反而低于单独铝佐剂组(组14).
4 讨论
本文评价了一种双佐剂新冠病毒灭活疫苗免疫原性,由于氢氧化铝是常用的佐剂类型,因此实验设计中固定了氢氧化铝的浓度,只改变CpG的浓度来进行研究.而中和抗体效价检测方法设计中,根据新冠病毒培养的特性,个别参数上稍做了调整,如本研究使用的病毒培养温度为35°C,是由于此温度下可降低Vero细胞的增值速度,利于新冠病毒的扩增;血清标本未做灭活处理,是想综合评价免疫血清的效果,避免补体去除后,无法参与抗原核抗体结合过程,造成结果的偏颇;实验中使用200TCID50的病毒进行实验,而非一般使用100TCID50的病毒,原因是200TCID50的病毒可以保证100%的病变;观察天数选择上,发现第6天和第7天并无区别,因此选择第6天为最终判定结果.
在检测灭活疫苗特异性抗体效价时,本想选用灭活病毒原液作为包被抗原,但由于灭活病毒原液在制备过程中添加了人血白蛋白等原料,尽管在后期纯化工序去除了大部分非病毒成分的杂蛋白,但仍有少量残余.这些异源物质在动物实验中也会引起显著的免疫应答效应,使得背景值过高,影响特异性抗体水平的判定.因此,只能通过检测病毒S蛋白特异性抗体水平来评价疫苗的免疫原性,而S蛋白上的受体结合区(Receptor-Binding Domain,RBD)作为宿主细胞表面结合的关键靶点位于S1亚单位中[14-15],且成本造价也远低于重组S蛋白.实际上,市售的许多检测试剂盒中,对于S蛋白含量测定所提供的标准品均为重组的S1亚基蛋白.因此,本实验中最终选取了S1重组蛋白作为直接包被抗原来检测病毒S蛋白特异性抗体.后期若能获得完全不含人血白蛋白的纯化灭活病毒抗原,则可进一步对结果进行优化.
与单独铝佐剂疫苗组相比,添加CpG之后,小鼠血清中的新冠病毒特异性抗体效价以及中和抗体滴度都有明显的提高,特别是在低、中抗原含量下就能达到很好的免疫效果,这对延长血清中抗体的持续时间,提高疫苗的有效保护时间都有很大的意义.但也可以看出,过量的CpG佐剂可能会抑制免疫效应,该结果与聂杰等的结果[16]类似,在相同抗原剂量下,低剂量CpG均表现出更优的免疫效果;但zhang等的结果[17]则正好相反,高剂量CpG组获得较低剂量组更为显著的免疫增强效果.这可能与CpG的不同免疫方式有关,而且说明CpG与抗原之间有量效关系.后续需要进一步研究CpG佐剂与抗原之间相互作用的机理,进而阐明其抑制免疫效应的原因.
5 结论
通过以上实验和分析,可以得到如下结论:
1)利用CpG佐剂的“增强效应”,可以使新冠病毒灭活抗原在较低的剂量下,就能产生较高水平的S蛋白特异性抗体效价及中和抗体效价.该特性在实际生产中可以有效降低单剂新冠抗原的使用量,提高单位产能.
2)通过不同配方组别中和抗体效价的分析,选择出优选新冠灭活疫苗的配方组,即新冠病毒抗原总蛋白含量2~4μg/mL,CpG含量为5~40μg/mL,铝含量450μg/mL.此外,CpG佐剂的优势还表现在可同时诱导细胞免疫,提高疫苗的保护效果.因此,下一步计划在大鼠模型上开展细胞免疫、安全性评价等一系列工作.

