173对生育异常夫妇的外周血染色体核型分析
王艳丽 位婷婷 张超楠 刘新新 郝戈芳 李乐瑶 郭文文
(河南省生殖健康科学技术研究院、国家卫生健康委出生缺陷预防重点实验室、河南省人口缺陷干预技术研究重点实验室,河南 郑州 450002)
生育异常在临床上比较常见,主要包括不孕不育(指育龄夫妇同居且未避孕,女方1年未受孕),不良孕产史(指既往有异常妊娠史,主要包括胚胎停育、胎儿畸形、死胎、流产史、产后大出血等)。引起不良孕产史夫妇的原因十分复杂,包括免疫、遗传、内分泌、感染、环境等因素[1]。随着现代人们生活方式的改变、环境的改变、性传播疾病发生率逐年增加和年轻化等因素,导致不孕不育症的病发率呈增长趋势,对社会和家庭带来很大困扰[2,3]。
遗传因素是生育异常的重要原因之一,目前临床上尚无有效手段治疗染色体病。夫妻双方行染色体检查是出生缺陷一级预防的重要手段,有助于临床遗传咨询工作。本文通过回顾性分析来本院就诊的173对夫妇染色体核型结果,探讨外周血染色体核型异常和染色体多态性对生育的影响,为优生优育,遗传咨询提供临床借鉴。
1 资料和方法
1.1 研究对象 筛选2016年9月至2019年3月期间来本院就诊的173对夫妇,年龄19~40岁,平均30岁,临床诊断为不孕不育,不良孕产史(临床表型主要包括胚胎停育、胎儿畸形史、复发性流产等)。
1.2 方法
1.2.1 实验原理 染色体带型是指运用一种或多种显带技术,使得染色体某个区域和附近的片段比较起来,显得深染或浅染,这个明显和周围区别的区域就命名为带。本文采用G显带方法,通过培养人外周血细胞,获取大量增殖的有核细胞(主要指淋巴细胞),经过一系列处理,使核内处于分裂中期的染色体暴露出来,固定在载玻片上,并通过胰酶消化和吉姆萨染色方法,使染色体呈现深浅不同的带型,DNA结合疏松的组蛋白被胰蛋白酶分解掉,染色后这些区段成为浅带,而那些组蛋白和DNA结合牢固的区段可被染成深带。通过条带识别,核型分析,判断染色体是否存在异常及异常的方式。
1.2.2 实验步骤
1.2.2.1 接种收获 取样均取得患者同意并签署前知情同意书。采患者外周血2~3ml于肝素钠抗凝管中,使用注射器将外周血接种到2个培养瓶(含培养基6ml)内,每瓶用2.5ml注射器注入30滴,在37℃恒温培养箱中孵育72h。提前半小时从培养箱中取出外周血培养瓶,每瓶加入8~10滴秋碱(浓度为0.03%~0.04%),37℃水浴20min,将外周血转移至15ml离心管内,1800rpm离心6min,每管加入低渗液(0.075mol/l KCl)至10ml刻度,37℃水浴35min,用固定液(甲醇∶冰乙酸=2∶1)进行预固定及第一次固定,再用固定液(甲醇∶冰乙酸=3∶1)进行第二次固定及第三次固定。
1.2.2.2 滴片显带 将上述细胞悬液悬空滴2~3滴于洁净冰冻载玻片上,每人滴4张片子。过火焰,80℃烤片2h,用胰酶显带,吉姆萨染液染色后,使用染色体核型分析软件进行分析处理。
1.2.3 外周血染色体核型分析原则 本研究结果处理原则:每个样本分析5个细胞,所分析细胞的染色体分辨率应达到320条带水平。至少计数20个细胞,记录任何观察到的染色体数目或结构异常。对可能有性染色体异常病例的标本,至少计数30个细胞。对于嵌合体(由2种或多种具有不同核型的细胞系所组成的个体称为嵌合体),依据计数100个核型中异于主细胞系的核型≥3个,则结果报为嵌合体,并标注嵌合比例。本研究则在400~550条带水平对外周血染色体进行核型分析,分辨率更高,可分辨>5Mb的染色体数目异常和结构异常。命名原则依据人类细胞基因组学国际命名体系(2016)[4]的有关规定命名。
2 结果
173对夫妇按就诊原因中不良孕产史分为胚胎停育、胎儿畸形、复发性流产及其他4组。173对夫妇的就诊原因和占比情况见表1。

表1 173对夫妇的就诊原因和占比情况(n=173)
173对夫妇共346例染色体结果中异常核型16例(其中2对夫妇双方核型都异常,13对夫妇只有一方核型异常),异常检出率为4.6%。其中女性异常6例,占总异常核型的37.5%;男性异常10例,占总异常核型的62.5%。染色体多态性24例。
本文异常核型中检出数目异常核型1例,男方核型为超雄综合征47,XYY,临床表现为无家族史,外貌正常,智力发育正常,肌张力正常。女方核型正常,但生育异常。检出染色体结构异常12例,平衡易位核型11例,未知结构增加核型1例。检出11号染色体臂间倒位1例,临床表现为其妻复发性流产。染色体多态性核型中检测出9号倒位4例,异染色质区增加4例,异染色质区减少1例,随体柄增加15例。具体异常染色体和染色体多态性核型统计见表2,本文典型正常核型分析图见图1,本文典型异常核型和染色体多态性核型分析图见图2。

图1 本文典型正常核型分析图
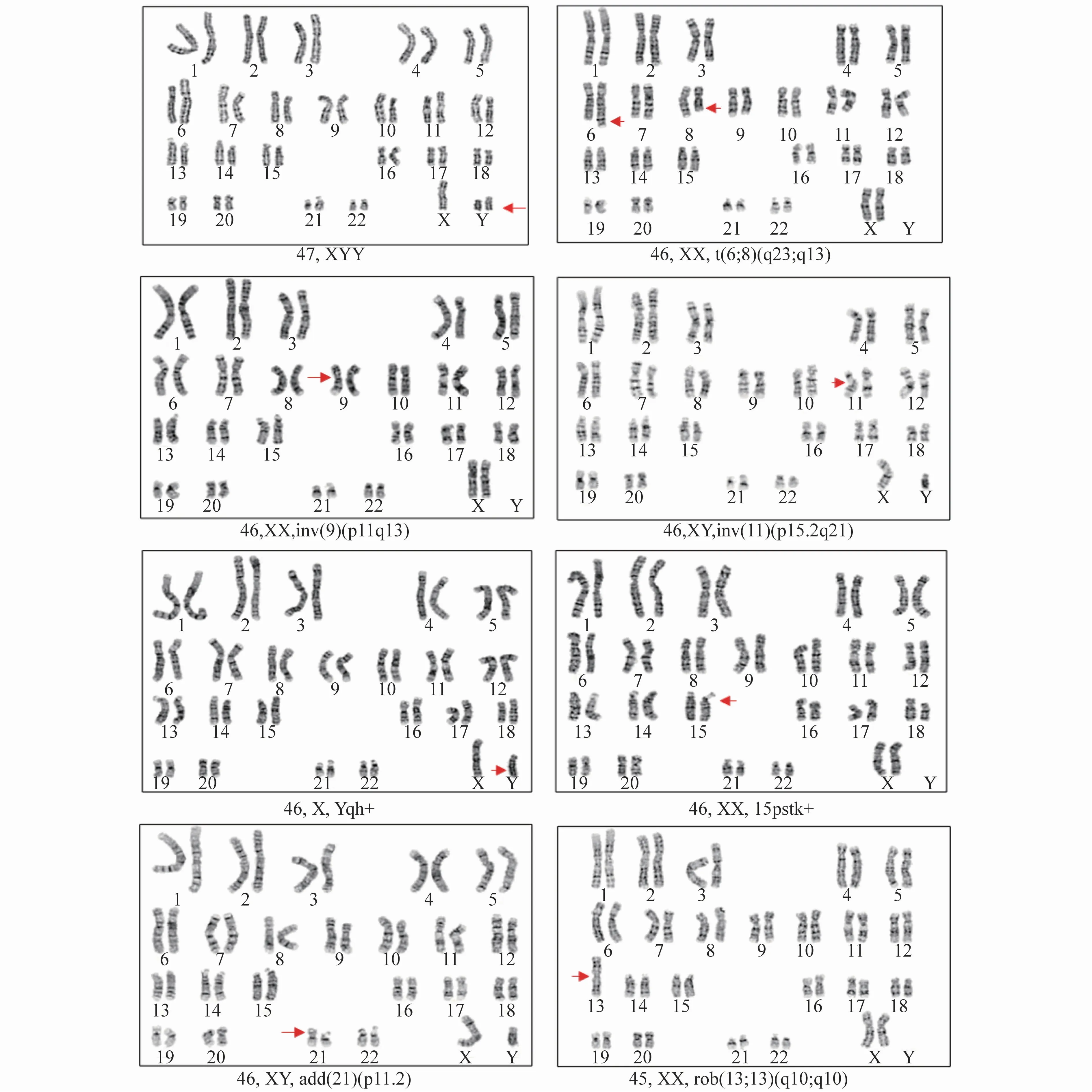
图2 本文典型异常核型和染色体多态性核型分析图,箭头所指为异常核型定带位置

表2 染色体异常核型和染色体多态性列表
3 讨论
染色体存在于细胞核内,是遗传信息的主要携带者,是遗传基因的载体。染色体异常是导致新生儿出生缺陷的主要原因,可以引起女性不孕不育、流产、死胎、胎儿畸形及胎儿生长发育受限等不良后果[5]。
染色体异常包括染色体数目异常和结构异常。染色体数目异常分为亚二倍体、超二倍体、三倍体、多倍体等;染色体结构异常包括缺失、重复、倒位、易位等。染色体异常会导致染色体病,如Patau综合征(47XX/XY,+13)、爱德华氏综合征(47XX/XY,+18)、唐氏综合征(47XX/XY,+21)、特纳综合征(45,X)、猫叫综合征(46,XX/XY,5P-)等[6]。一般在胚胎早期即引起自发流产,存活者通常表现有生长发育迟缓、智力低下、先天性畸形和性发育异常等[7],给家庭带来感情上的创伤和社会经济上的严 重负担。染色体异常胚胎的形成,除了高龄的原因外,大部分是由于父母一方或者双方染色体异常,在受精卵形成过程中形成了异常的配子导致的。
3.1 染色体核型异常与生育异常的相关性 本文结果显示,染色体核型异常检出率为4.6%,其中染色体结构异常的检出率为3.7%,结构异常中易位核型占比3.5%(平衡易位占比2.3%,罗伯逊易位占比1.2%);倒位核型占比0.3%;未知染色体增加核型占比0.3%。染色体数目异常的检出率为0.3%,远低于染色体结构异常。
3.1.1 平衡易位并不导致染色体整体性的减少或增加,通常无表型异常,因此很难发现。本文结果显示,平衡易位者大多不影响怀孕,但却是导致胎儿流产、死胎、新生儿畸形的重要原因[8-10]。夫妻一方为染色体平衡易位携带者时,生育正常核型后代的概率是1/18,生育平衡易位携带者后代的概率是1/18,胚胎早期停育或生育严重染色体病患儿的概率是16/18。该夫妇严格避孕,若自然受孕,胎儿发育至孕18~24周时需进行产前诊断,或该夫妇可行胚胎植入前遗传学诊断(preimplantation genome diagnosis,PGD)技术获取后代,以避免因新生儿出生缺陷给家庭带来的不良后果。
3.1.2 罗伯逊易位属于特殊类型的易位,分为同源型和异源型,通常发生在D组和G组核型之间,两个染色体的长臂和短臂分别相连,因短臂只有异染色质区,易丢失,因此核型命名为45条染色体。对于同源罗氏易位核型,该种罗氏易位患者生育时,因为所有胚胎都会携带单体或三体,而这些染色体是有问题的,建议通过供体配子(供体人工授精、供体卵)获取后代。若夫妻一方为非同源罗伯逊易位携带者,生育正常后代的概率是1/6,生育罗氏易位携带者后代的概率是1/6,胚胎早期停育或流产的几率是4/6,该夫妇若自然受孕,胎儿发育至孕18~24周时需进行临床遗传咨询,做产前诊断检测,该夫妇也可通过技术获取后代[11]。
3.1.3 染色体倒位分为臂内倒位和臂间倒位,倒位不影响携带者表型,但倒位的长短,影响胎儿成活,易引起流产[12]。若夫妻一方为臂间倒位携带者时,其子代1/4染色体正常,1/4为染色体倒位携带者,2/4为染色体不平衡性异常;若夫妻一方为臂内倒位携带者时,其子代1/4染色体正常,3/4为染色体异常。建议该夫妇若自然受孕,胎儿发育至孕18~24周时需进行临床遗传咨询,做产前诊断检测,该夫妇也可通过PGD技术获取后代。
3.1.4 染色体数目异常中,47,XYY综合征,又称超雄综合征,在临床上较少见,属于性染色体异常疾病,患者多数具有生育能力,但少数有生精障碍,可能原因是多余的Y染色体影响了精子的生成引起的[13]。
染色体多态性属于非病理性差异,但是近年来有研究发现染色体多态性与不孕不育,复发性流产等临床表现相关[14]。其中,1、9、16号染色体由于高度重复的DNA序列引起有丝分裂的异常进行,而染色体短臂增长可形成异常配子,导致生育异常的发生[5]。染色体多态性核型中以随体柄增加(stk+)和异染色质区(qh+)增加或减少(qh-)为主。
研究报道,9号染色体臂间倒位与不孕不育、流产、胎儿发育异常相关[15]。有学者认为9号染色体臂间倒位是否有临床意义与其具体倒位发生的区段有关系[16]。临床中的9号染色体臂间倒位通常指的核型为46,XX,inv(9)(p11q13),目前临床工作中尚未见9号染色体臂间倒位有位于9p11q13区间以外的形式,本研究共检出9号染色体臂间倒位者3例,其中女性2人,男性1人,占总人数的0.87%,与梁济慈等[18]报道的9号染色体臂间倒位在生育异常中的比例0.87%相近[17],而略高于代海兵等报道的0.46%。夫妻一方为9号染色体臂间倒位携带者,若自然受孕,胎儿发育至孕18~24周时需进行临床遗传咨询,做产前诊断检测。
综上所述,染色体核型异常和染色体多态性与生育异常密切相关。因此,对生育异常夫妇进行外周血染色体检查是必要的检测手段,为临床孕前遗传咨询提供依据,有利于做好出生缺陷防控工作,促进优生优育,减轻家庭和社会负担。

