HPLC 分析7 种抗氧剂在注射用盐酸吉西他滨中的迁移情况
刘贞,郑双双,钟振华,夏红英,熊欣,程奇珍
江西省药品检验检测研究院,国家药品监督管理局中成药质量评价重点实验室,江西省药品与医疗器械质量工程技术研究中心,江西 南昌 330029
药物与包装材料之间的相容性,直接关系到药品的安全性和有效性,是药品行业亟待深入了解和研究的内容[1-2]。注射剂给药后直接进入循环系统或组织,属于与包装系统发生相互作用可能性较高的高风险制剂[3-4]。
注射用盐酸吉西他滨是冻干制品,其包装材料主要为硼硅玻璃管制注射剂瓶和药用卤化丁基橡胶塞。药用卤化丁基橡胶塞在生产过程中,通常会加入硫化剂、硫化促进剂、抗氧剂、填充剂、防焦剂、着色剂、活性剂等添加物[5-7]。当药物与胶塞接触时,胶塞中的这些化学成分有可能缓慢地迁移至药物中,影响药品的稳定性和安全性。在诸多添加物中,抗氧剂较为常见。目前广泛使用的抗氧剂主要分为酚类、酯类等,酚类抗氧剂常作为主抗氧剂,而硫代酯类和亚磷酸酯类抗氧剂常作为辅助抗氧剂[8-11]。酚类抗氧剂主要包含抗氧剂BHT、抗氧剂3114、抗氧剂1010、抗氧剂1076、抗氧剂1330 等。抗氧剂168 是亚磷酸酯类常用抗氧剂。本试验主要考察胶塞中常用抗氧剂BHT、1310、3114、1010、1330、1076、168 在注射用盐酸吉西他滨中的迁移。
1 仪器和试剂试药
Dionex Ultimate 3000 高效液相色谱仪,Mettler toledo MS105 型电子天平,Memmert HPP749 恒温恒湿实验箱,VELP Scientifica Vortex WX 涡旋混合器。
抗氧剂1310(批号D5GJF-SL)、抗氧剂BHT(批号VLMAF-NM,含量99.0%)、抗氧剂3114(批号ROX6O-FJ,含量98.0%)、抗氧剂1330(批号P6WVJ-AA,含量95.0%)、抗氧剂1076(批号WECNC-BL,含量98.0%)、抗氧剂168(批号EJ6HG-GE,含量98.0%),均购自梯希爱(上海)化成工业发展有限公司;抗氧剂1010(批号C10271799,含量94%)购自上海麦克林生化科技有限公司。甲醇(色谱纯,sigma-aldrich),二氯甲烷(色谱纯,Anaqua chemicals supply)。溶剂:二氯甲烷-甲醇(1∶1)。
注射用盐酸吉西他滨12 批次:A 公司190211(规格:0.2 g)、190115(规格:1.0 g),B 公司AA1D7005A(规格:0.2 g)、AA2D8005A(规格:1.0 g),C 公司E1811012(规格:0.2 g),D 公司090181201(规格:0.2 g),E 公司190107(规格:0.2 g)、190218(规格:1.0 g),F公司181025(规格:0.2 g)、180326(规格:1.0 g),G公司201901012(规格:0.2 g),H 公司20180704(规格:0.2 g)。
2 方法与结果
2.1 色谱条件
采用Inertsil ODS-3 色谱柱(4.6 mm×250 mm,5 μm),柱温35 ℃;以甲醇为流动相A、1%醋酸为流动相B,梯度洗脱(0~8 min,85%→100% A;8~36 min,100% A;36~39 min,100% →85% A;39~50 min,85% A),流速1.0 mL/min;检测波长277 nm;进样体积20 μL。
2.2 溶液的制备
取抗氧剂1310、BHT、3114、1010、1330、1076、168 各适量,精密称定,分别加二氯甲烷溶解并定量稀释制成每1 mL 中约含1 mg 的溶液,作为各对照品贮备液。精密量取抗氧剂1310、1076 贮备液各2 mL,抗氧剂BHT 贮备液1 mL,抗氧剂3114、1010、1330、168 贮备液各5 mL,至50 mL 量 瓶中,用甲醇稀释至刻度,摇匀,作为混合对照品溶液S0。用溶剂定量稀释制成不同浓度的对照品溶液S1~S10。
取注射用盐酸吉西他滨,将药粉混合均匀,取药粉约0.4 g,精密称定,至10 mL 比色管中,精密加入溶剂5 mL,涡旋(2 000 rpm)1 min,静置,用0.45 μm 滤膜滤过,取续滤液作为供试品溶液。
2.3 专属性
取混合对照品溶液S2、供试品溶液、溶剂分别进样。结果表明(图1~3)溶剂对测定无干扰,各抗氧剂峰与相邻峰均能完全分离。
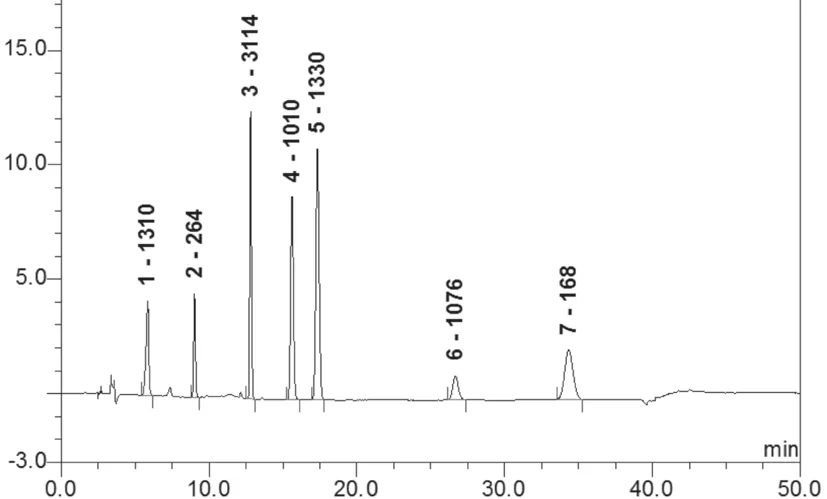
图1 混合对照品溶液的HPLC图
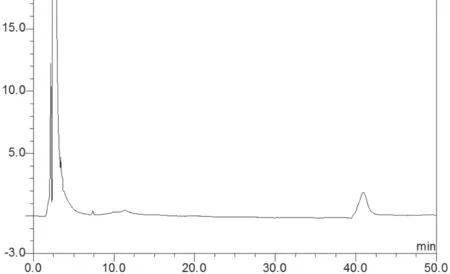
图2 供试品溶液的HPLC图
图3 溶剂的HPLC图
2.4 线性和范围
取混合对照品溶液S1~S7 进样,以峰面积为纵坐标、对照品浓度为横坐标,绘制标准曲线。7 种抗氧剂在相应浓度范围内均具有良好的线性关系,见表1。
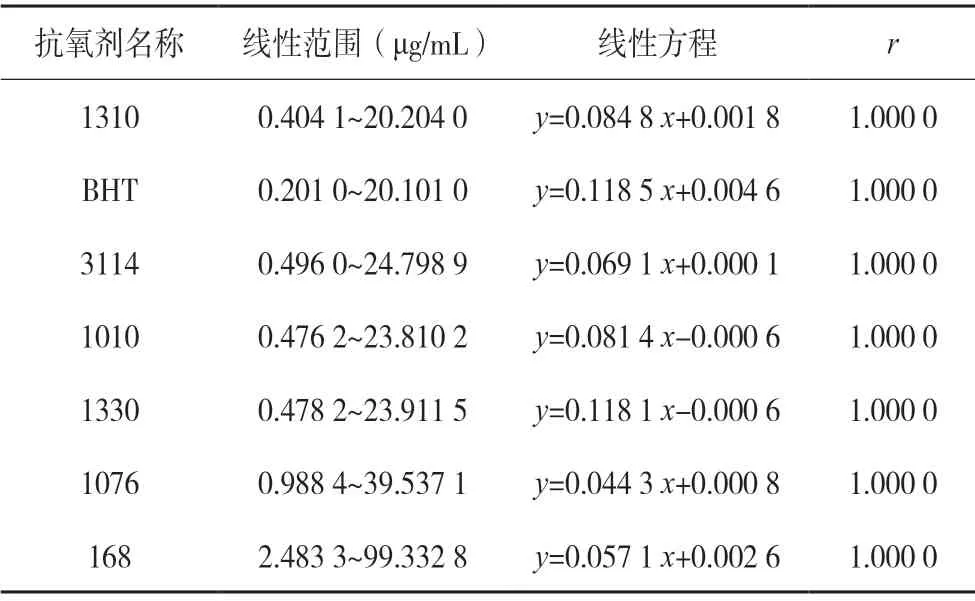
表1 抗氧剂线性和范围(BHT:n=7,其他:n=6)
2.5 回收率试验和重复性试验
取注射用盐酸吉西他滨(F 公司,批号190120,规格0.2 g),照“2.2”项下制备供试品溶液,供试品本底溶液中未检出各待测抗氧剂。
取混合均匀的注射用盐酸吉西他滨(F 公司,批号190120,规格0.2 g)药粉约0.4 g,精密称定,至10 mL 比色管中,分别精密加入混合对照品溶液S2 0.8、1.0、1.2 mL,再分别精密加入溶剂4.2、4.0、3.8 mL,涡旋(2 000 r/min)1 min,静置,用0.45 μm 滤膜滤过,取续滤液作为加样回收溶液,低、中、高每个浓度水平平行制备3 份,同时考察方法的回收率和重复性。抗氧剂1310、BHT、3114、1010、1330、1076、168 的平均回收率分别为89.7%、97.3%、98.4%、98.8%、98.9%、93.6%、97.6%,RSD分别为1.9%、1.3%、0.6%、0.7%、0.7%、1.7%、1.0%。
2.6 进样精密度和溶液稳定性
取混合对照品溶液S4 进样6 次,抗氧剂1310、BHT、3114、1010、1330、1076、168 峰面积的RSD分别为1.4%、1.5%、0.5%、0.9%、0.7%、1.4%、0.6%。
取“2.5”项下中浓度水平回收溶液分别在0、5、10、15、20、25 h 记录色谱图,抗氧剂1310、BHT、3114、1010、1330、1076、168 峰 面 积 的RSD 分别为1.5%、1.6%、1.4%、0.9%、1.0%、1.9%、0.5%,说明各抗氧剂在25 h 内稳定性良好。
2.7 检测限和定量限
取混合对照品溶液S5~S10 分别进样,测得各抗氧剂检测限、定量限见表2。

表2 抗氧剂AET计算结果
2.8 供试品的测定
取注射用盐酸吉西他滨分别正置、倒置于温度40℃±2℃,相对湿度75%±5%的恒温恒湿箱中进行加速试验,于第3 个月月末取出,照“2.2”项下制备供试品溶液。同时测定对应的未加速供试品。另取对应批次的室温保存(0 月)胶塞,洗净晾干,剪碎,混合均匀,取约1 g,精密称定,至25 mL比色管中,精密加入溶剂10 mL,超声30 min,放冷至室温,用0.45 μm 滤膜滤过,取续滤液作为胶塞提取溶液。
测定结果显示,所有企业胶塞中共检出了四种抗氧剂:抗氧剂1310 的检出量分别为23.5 μg/g(B 公司,规格0.2 g)、25.9 μg/g(B 公司,规格1.0 g)、13.4 μg/g(C 公 司,规 格0.2 g)、7.0 μg/g(D 公 司,规格0.2 g)、12.1 μg/g(E 公司,规格0.2 g)、14.5 μg/g(E 公司,规格1.0 g)、15.6 μg/g(F 公司,规格0.2 g)、21.3 μg/g(F 公司,规格1.0 g),抗氧剂BHT 的检出量分别为56.7 μg/g(D 公司,规格0.2 g)、122.0 μg/g(F 公司,规格1.0 g)、105.2 μg/g(G 公司,规格0.2 g),抗氧剂1010 的检出量分别为22.1 μg/g(A公司,规格0.2 g)、17.9 μg/g(A 公司,规格1.0 g)、77.7 μg/g(C 公司,规格0.2 g)、22.7 μg/g(H 公司,规格0.2 g),抗氧剂1076 的检出量分别为91.8 μg/g(B公司,规格0.2 g)、189.9 μg/g(B 公司,规格1.0 g)、355.5 μg/g(E 公司,规格0.2 g)、516.8 μg/g(E 公司,规格1.0 g)、489.3 μg/g(G 公司,规格0.2 g)。
盐酸吉西他滨药粉中只有D 公司0.2 g 规格和F公司1.0 g规格共2个批次检出了抗氧剂BHT,图4,所有批次药粉中均未检出其他抗氧剂。
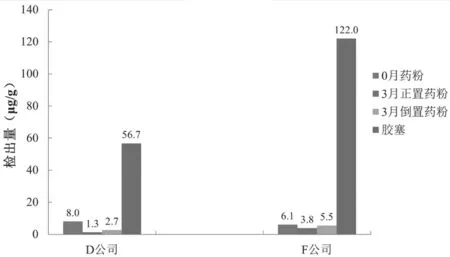
图4 加速试验抗氧剂BHT检出情况
3 讨论
抗氧剂3114、1010、1330、1076、168 的推荐日允许最大暴露量(permitted daily exposure,PDE)分别为25、10、5、0.3、2.5 mg/d。抗氧剂1310 为抗氧剂1010 和1076 潜在的降解产物,参考两个前体PDE值较低者进行安全性评估,因此抗氧剂1310 的PDE值采用0.3 mg/d[12]。抗氧剂BHT 的每日口服最大允许摄入量为0.125 mg/kg[13]。参考ICH Q3D,在无口服生物利用度数据或职业暴露限度的情况下,以口服PDE 值除以校正因子100 计算注射PDE 的推算值。成年人体重以50 kg 计,抗氧剂BHT 注射PDE=0.125 mg·kg-1·d-1×50 kg/100=0.062 5 mg/d。另外需对产品的分析评价阈值(analytical evaluation threshold,AET)进行计算[3,14]。表2 显示所建立分析方法的灵敏度能够满足各抗氧剂AET 值低浓度水平的测定需要。
抗氧剂1310、1010、1076 迁移至盐酸吉西他滨药粉中的可能性很低;而药粉中检出了抗氧剂BHT 对应批次的胶塞中亦检出了抗氧剂BHT,推测药粉中的抗氧剂BHT 可能是由胶塞迁移引入的。图4 显示加速3 月的药粉中抗氧剂BHT 的检出量相对于室温保存(0 月)的药粉中检出量有所下降,推测可能是在加速试验条件下抗氧剂BHT 发生了一定程度的降解;加速3 月倒置药粉中抗氧剂BHT的检出量比加速3 月正置药粉中检出量高,这为抗氧剂BHT 的迁移提供了进一步的证据。2 个批次药粉中抗氧剂BHT 的检出量均低于其AET 值,见图5,可认为由抗氧剂BHT 迁移导致的安全性风险小。
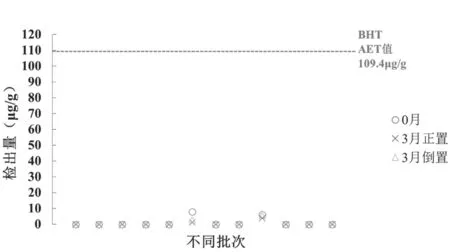
图5 注射用盐酸吉西他滨药粉中抗氧剂BHT检出情况
综上所述,本试验建立的分析方法可用于测定注射用盐酸吉西他滨药粉中抗氧剂1310、3114、1010、1330、1076、168 和BHT 的迁移量。根据测定结果均未检出抗氧剂1310、3114、1010、1330、1076、168 的迁移;抗氧剂BHT 可能会迁移至药粉中,但迁移量很少,药粉中抗氧剂BHT 的检出量低于AET 值,对该药品的安全性影响小。

