甘草素通过调控miR-216b-5p对肺腺癌细胞增殖凋亡及化疗敏感性的作用研究
陈钰龙,王华启,张莉蓉
(郑州大学第一附属医院 1.药学部、2.呼吸与危重症医学科,3.郑州大学基础医学院,河南 郑州 450000)
肺腺癌是非小细胞肺癌最常见的组织学类型,目前尽管临床对其治疗取得一定进展,但晚期患者预后仍较差,病死率高[1]。以顺铂为主药物化疗为肺腺癌主要治疗手段之一,但也较易复发,肿瘤细胞对顺铂药物耐药性已逐渐成为影响患者化疗效果及预后的关键因素,目前尚无可逆转化疗多药耐药有效方法[2]。甘草为中医常用药材之一,其活性成分甘草素能对肿瘤细胞血管生成进行抑制,阻滞细胞周期,影响肿瘤细胞凋亡、增殖基因调控,具有潜在药用价值[3]。研究还发现[4],甘草素可经调节鼻咽癌CNE-2细胞自噬,增强放疗敏感性。王勇等[5]还提出,甘草素抑制肺癌细胞增殖、调节细胞凋亡、增强放疗敏感性的机制可能与调控WIG-1基因表达有关,但就其他机制尚未具体明确。微小RNA(microRNA,miR)-216b-5p为miR-216家族成员之一,是一种肿瘤抑制因子,在多种肿瘤组织中表达降低,且参与相应肿瘤细胞增殖、分化、凋亡等过程,目前临床就其在肺腺癌肿瘤细胞增殖凋亡以及化疗敏感性中作用研究较少。基于此,本研究开展实验,重点分析了甘草素对肺腺癌细胞增殖凋亡及化疗敏感性的影响,并探讨其机制。
1 材料与方法
1.1 材料
1.1.1细胞株 人肺腺癌H1299细胞株购自上海通派生物科技公司。
1.1.2主要试剂、仪器 甘草素(美国Sigma公司,批号:S05167),顺铂(碧云天生物技术研究所,批号:181026),10%胎牛血清、青霉素、链霉素(美国Invitrogen公司,批号:R6081),DMEM培养基(美国Sigma公司,批号:S10262),Cell Counting Kit-8(CCK-8)检测试剂盒(北京百奥莱博科技有限公司),甲基噻唑基四唑(Methylthiazolyltetrazolium,MTT)比色法试剂盒(美国BioVision公司),微小核糖核酸-216b-5p(microRNA-216b-5p,miR-126b-5p)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)试剂盒(湖北武汉富鑫远科技有限公司),兔抗人mTOR、磷酸化-mTOR(phosphorylated-mTOR,p-mTOR)、Bcl-2、β-actin一抗及山羊抗兔IgG二抗(美国Abcam公司)。ELx800型酶标仪(美国Bio-Tek公司),AS-90型流式细胞仪(美国赛默飞世尔科技有限公司),BX43显微镜(日本奥林巴斯株式会社),数字图像分析系统(美国通用公司)。
1.2 方法
1.2.1细胞培养、分组及干预 人肺腺癌H1299细胞株置于含10%胎牛血清、1%青霉素及1%链霉素DMEM培养基,放置在CO2培养箱培养,温度37 ℃,体积分数5%,每隔2 d,以0.25%胰蛋白酶消化传代一次。取对数生长期H1299细胞,细胞浓度调至1.0×107个·L-1,在96孔板内接种,每孔100 μL,培养24 h。待细胞贴壁,去除旧培养液。甘草素使用前以生理盐水溶解成终浓度10.0 mg·L-1溶液。甘草素设10、20、40、60、80 mg·L-15个浓度组,另设对照组(加50 μL/孔,不含甘草素培养液),处理24 h后收集全部细胞。
1.2.2化疗敏感性检测 采用CCK-8法检测。取1.2.1中各组细胞,96孔板内接种,各组复孔数均为5。待细胞贴壁,以不同浓度(0.625、1.25、2.5、5、10 mg·L-1)顺铂干预各组细胞,另设空白孔,仅加200 μL培养液。各组细胞处理24 h后,加5 μL CCK-8,放置在37 ℃、5% CO2培养箱培养,共4 h。各孔加含0.1% DMSO的DMEM溶液,振荡10 min。观察结晶溶解后,置于酶标仪检测。记录酶标仪570 nm波长处吸光度(absorbance,A)值,计算药物半数抑制浓度(half maximal inhibitory concentration,IC50)=(实验孔A值/空白孔A值)×100%,评估化疗敏感性。
1.2.3细胞增殖活性检测 采用MTT比色法检测。取“1.2.1”中各组细胞,接种于96孔板,观察细胞贴壁后,以最接近IC50值浓度2.5 mg·L-1顺铂干预各组细胞24 h。各孔加5 g·L-1MTT液20 μL,置于37 ℃、5% CO2培养箱避光培养。完成培养后,800 r·min-1离心,离心半径10 cm,10 min,弃上清液。分别在各孔加标准浓度DMSO溶液200 μL,震荡10 min,混匀。观察细胞内紫蓝色结晶溶解后,置于酶标仪检测。记录酶标仪570 nm波长处A值,评估细胞增殖活性。
1.2.4细胞凋亡检测 采用流式细胞术检测。取“1.2.1”中各组细胞,接种于96孔板,观察细胞贴壁后,以2.5 mg·L-1顺铂干预各组细胞24 h。各孔加不含EDTA胰酶消化,细胞以EP管收集,磷酸盐缓冲液冲洗2次。各管加1× binding buffer 200 μL,重悬细胞,再以Annexin V-PE 5 μL加入细胞重悬液内,混匀,室温,避光孵育10 min。各管加7-AAD 5 μL,吹打,混匀。4 h内,以流式细胞仪检测各组细胞凋亡率/%=(凋亡细胞数/总细胞数)×100%。
1.2.5miR-216b-5p、mTOR、Bcl-2 mRNA相对表达量检测 采用RT-qPCR法检测。取“1.2.1”中各组细胞,接种于96孔板,观察细胞贴壁后,以2.5 mg·L-1顺铂干预24 h,开始实验。以TRIzol试剂盒提取总RNA,逆转录成cDNA。严格按照说明书进行RT-qPCR扩增,引物序列见Tab 1。反应条件:94 ℃,5 min,预变性;94 ℃,35 s,变性;58 ℃,35 s,退火;72 ℃,35 s,延伸,共35次循环。以2-△△CT法计算miR-216b-5p、mTOR、Bcl-2 mRNA相对表达量。

1.2.6mTOR、p-mTOR、Bcl-2蛋白相对表达量检测 采用蛋白质印迹法检测。取“1.2.1”中各组细胞,接种于96孔板,观察细胞贴壁后,以2.5 mg·L-1顺铂干预24 h,开始实验。各组加100 μL细胞裂解液,冰上裂解,提取细胞总蛋白。4 ℃,12 000 r·min-1离心,离心半径10 cm,10 min,取上清液。BCA蛋白试剂定量检测蛋白,沸水浴变性10 min,冰上冷却10 min。各泳道分别加20 μL总蛋白样品,SDS-聚丙烯酰胺凝胶电泳,蛋白分离,转膜,5%脱脂奶粉封闭2 h。加mTOR、p-mTOR、Bcl-2、β-actin(1 ∶1 000)一抗,摇床孵育过夜。TBST液清洗,重复3次,每次10 min。加二抗(1 ∶3 000),室温孵育2 h。TBST液清洗,重复3次,每次10 min。加ECL试剂显色,凝胶成像系统拍照。目的蛋白相对表达量以目的蛋白与内参条带灰度值比值表示。

2 结果
2.1 化疗敏感性各组IC50值比较,差异有统计学意义(P<0.05)。与对照组比较,甘草素10、20、40、60、80 mg·L-1组IC50值降低,且甘草素80 mg·L-1组<甘草素60 mg·L-1组<甘草素40 mg·L-1组<甘草素20 mg·L-1组<甘草素10 mg·L-1组(P<0.05)。见Tab 2。

Tab 2 Comparison of IC50 values in each group
2.2 细胞增殖能力各组MTT实验细胞增殖活性比较,差异有统计学意义(P<0.05)。与对照组比较,甘草素10、20、40、60、80 mg·L-1组MTT实验细胞增殖活性升高,且甘草素10 mg·L-1组<甘草素20 mg·L-1组<甘草素40 mg·L-1组<甘草素60 mg·L-1组<甘草素80 mg·L-1组(P<0.05)。见Tab 3。

Tab 3 Comparison of experimental A MTT cells in each group
2.3 细胞凋亡各组细胞凋亡率比较,差异有统计学意义(P<0.05)。与对照组比较,甘草素10、20、40、60、80 mg·L-1组细胞凋亡率升高,且甘草素10 mg·L-1组<甘草素20 mg·L-1组<甘草素40 mg·L-1组<甘草素60 mg·L-1组<甘草素80 mg·L-1组(P<0.05)。见Fig 1、Tab 4。

Fig 1 Comparison of apoptosis in each group detected by flow cytometry

Tab 4 Comparison of apoptotic rate in each group
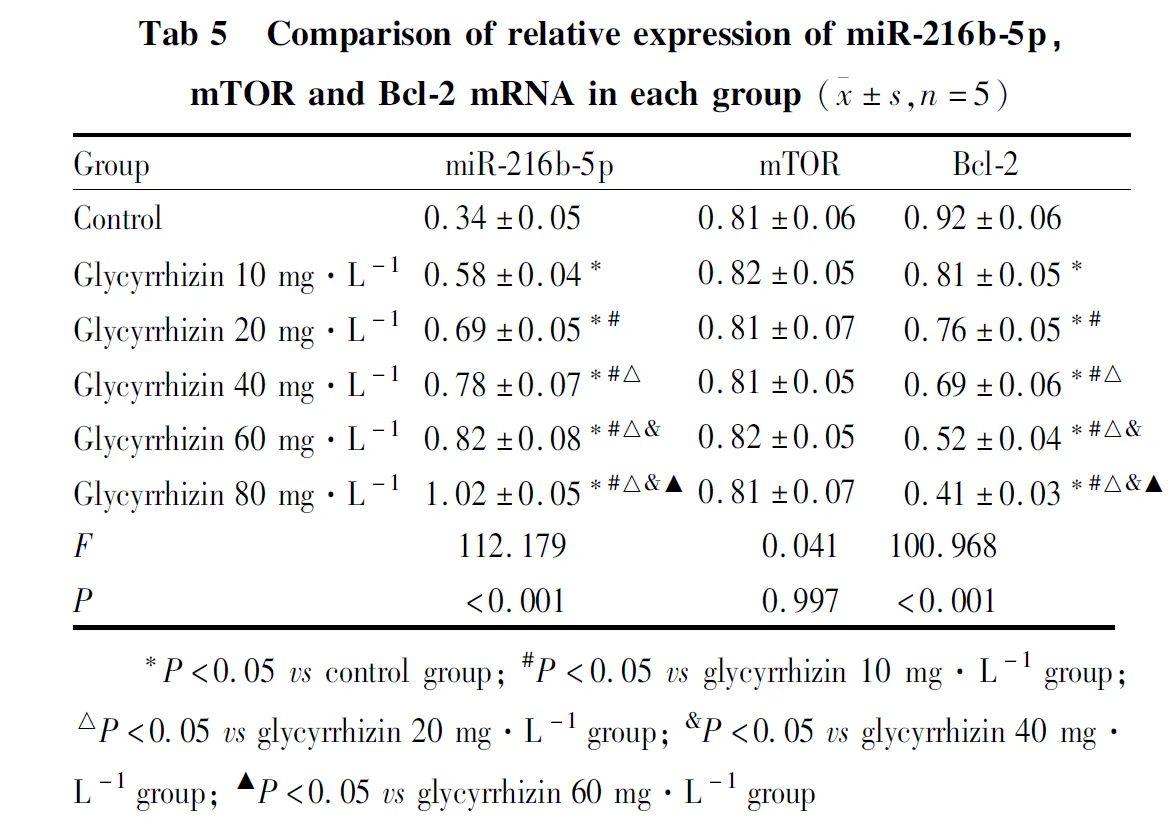
2.4 miR-216b-5p、mTOR、Bcl-2 mRNA相对表达量各组miR-216b-5p、Bcl-2 mRNA相对表达量比较,差异有统计学意义(P<0.05);各组mTOR mRNA相对表达量比较,差异无统计学意义(P>0.05)。与对照组比较,甘草素10、20、40、60、80 mg·L-1组miR-216b-5p mRNA相对表达量升高,Bcl-2 mRNA相对表达量降低,且miR-216b-5p mRNA相对表达量,甘草素10 mg·L-1组<甘草素20 mg·L-1组<甘草素40 mg·L-1组<甘草素60 mg·L-1组<甘草素80 mg·L-1组,Bcl-2 mRNA相对表达量,甘草素80 mg·L-1组<甘草素60 mg·L-1组<甘草素40 mg·L-1组<甘草素20 mg·L-1组<甘草素10 mg·L-1组(P<0.05)。见Tab 5。
2.5 mTOR、p-mTOR、Bcl-2蛋白相对表达量各组p-mTOR、Bcl-2蛋白相对表达量比较,差异有统计学意义(P<0.05);各组mTOR蛋白相对表达量比较,差异无统计学意义(P>0.05)。与对照组比较,甘草素10、20、40、60、80 mg·L-1组p-mTOR、Bcl-2蛋白相对表达量降低,且甘草素80 mg·L-1组<甘草素60 mg·L-1组<甘草素40 mg·L-1组<甘草素20 mg·L-1组<甘草素10 mg·L-1组(P<0.05)。见Fig 2、Tab 6。

Fig 2 Protein expression of mTOR, p-mTOR and Bcl-2 in each group

Tab 6 Comparison of relative expression of mTOR, p-mTOR and Bcl-2 protein in each group
3 讨论
肺腺癌在临床上较为常见,多数患者确诊时已处于中晚期,化疗、放疗及综合治疗等保守治疗仍无法有效挽救生命,而肿瘤细胞对化疗药物产生耐药性是保守治疗无效主要原因之一。肺腺癌细胞对化疗药物耐药的机制较为复杂,包括细胞异常凋亡、细胞膜内酶系统异常、DNA损伤修复系统增强、细胞自噬等[6]。因此,临床采取有效措施提升肺腺癌患者化疗敏感性,以控制病情,改善治疗效果、预后,具有重要意义。近年来,单味中药及中药活性成分的应用已逐渐成为抗肿瘤研究领域热点之一,在肿瘤治疗方面具有多途径、多靶点及多效性特点,前景广阔[7]。
甘草为常见中草药之一,具有平阳秘、旺气血、宽经脉等作用,其有效成分甘草素还具有抗肿瘤的药理作用[8]。报道显示[9],甘草素且可经细胞色素C、Bcl-2家族等多种途径,参与肿瘤细胞凋亡、自噬过程。王宇[10]经研究发现,甘草素能对人肺腺癌A549细胞迁移进行抑制,且作用机制可能与阻碍磷脂酰肌醇-3激酶/蛋白激酶B通路有关。但目前,临床就甘草素对肺腺癌细胞增殖凋亡及化疗敏感性影响及机制尚无明确定论。本研究结果显示,随甘草素应用浓度增加,人肺腺癌H1299细胞MTT实验A值升高,这提示甘草素对人肺腺癌H1299细胞增殖有一定抑制作用,且抑制作用随浓度增加而逐渐增强。另外,甘草素应用后H1299细胞凋亡率升高,IC50值降低,这提示甘草素还可促进H1299细胞凋亡,提升化疗敏感性,效果呈剂量依赖性。
miRNA是一种短链非编码RNA分子,可经由结合靶基因mRNA的3′端非编码区一些特异性序列,对靶基因mRNA进行降解,调控基因表达[11]。其中,miR-216可抑制非小细胞肺癌的细胞增殖、侵袭能力[12]。秦巧红等[13]研究发现,子宫内膜癌组织中miR-216b-5p存在低表达,且能对肿瘤细胞增殖、迁移及侵袭能力进行抑制,可能成为肿瘤治疗潜在靶点。还有学者提出[14],miR-216b-5p表达上调可逆转人前列腺癌细胞对紫杉醇耐药性,提升化疗敏感性。另外,miR-216b-5p可介导mTOR通路,参与肿瘤发生、发展及治疗过程[15]。mTOR是一种丝/苏氨酸蛋白激酶,参与调控细胞生长、生殖、凋亡及血管内皮再生等生理过程。报道显示[16],多种肿瘤细胞中存在抑癌基因磷酸酶与张力蛋白同源基因突变、缺失,可最终导致mTOR信号通路激活,促进肿瘤细胞增殖、迁移,增加肿瘤细胞抗凋亡效应,在逻辑上促进肿瘤细胞耐药发生。Bcl-2是一种凋亡调节因子,在细胞凋亡信号转导途径中发挥重要作用。研究还发现[17],Bcl-2在TP53野生型胶质母细胞瘤细胞中可对mTORC1/2抑制剂耐药。张艳等[18]也发现,抑制mTOR通路可增强宫颈癌紫杉醇耐药株对紫杉醇敏感性。这些研究均提示,miR-216b-5p介导的mTOR信号通路可能在肺腺癌疾病控制中发挥重要作用。本研究结果显示,甘草素应用后miR-216b-5p mRNA相对表达量提升,Bcl-2 mRNA相对表达量及p-mTOR、Bcl-2蛋白相对表达量降低,且呈剂量依赖性,提示甘草素可上调miR-216b-5p表达,抑制mTOR信号通路,这可能是甘草素发挥抑制肺腺癌细胞增殖、促进细胞凋亡及提升化疗敏感性的重要作用机制之一。
综上所述,甘草素可抑制人肺腺癌H1299细胞增殖,促进细胞凋亡,提升化疗敏感性,作用机制可能与上调miR-216b-5p表达、抑制mTOR信号通路有关。本研究不足之处在于仅分析了甘草素经调控miR-216b-5p表达介导mTOR信号通路的作用,未就其他途径进行分析,而甘草素影响肺腺癌细胞增殖凋亡及化疗敏感性途径较多,故今后仍需进一步分析。

