基于网络药理学和分子对接技术探讨功劳叶、仙鹤草药对治疗缺血性中风的作用机制
张田义,赖新星,李婷婷,解小龙,刘伟地,杨芩瑜,李 影,高 颖
(北京中医药大学 1. 东直门医院、2. 中医脑病研究院,北京 101121)
缺血性卒中(ischemic stroke,IS)是指因脑部血液循环障碍,发生缺血、缺氧所导致的局限性脑组织的缺血性坏死或软化而出现相应的神经系统功能缺损。在世界范围内,中风是致死、致残的首要原因。缺血性脑卒中约占卒中总人数的80%。然而,目前治疗缺血性卒中的最有效手段是溶栓或机械取栓,但由于受众面小,且时间窗狭窄,故仅有少数的人从这些有限的有效干预中受益[1],挖掘和开发对缺血性卒中的有效治疗方式具有重要的临床和公共卫生价值。
缺血性卒中属于传统医学“中风”范畴,传统治法包括益气活血法、化痰祛瘀法等,近年来随着研究治法的深入,发展了清热化瘀、温阳通络等治法。在中医治疗中风病长期历史实践中,包括董老在内的众多中医名家皆有经验方传承,且临床效果甚佳,但因为中医药复方多成分、多靶点作用的特点,尚未阐明作用机制。本文通过网络药理学及分子对接技术,初步探索董老经验药对功劳叶、仙鹤草(Gonglaoye and Xianhecao herbal pair,GLY-XHC)治疗中风的作用机制,为进一步的实验证据和临床推广提供思路。鉴于功劳叶和枸骨叶在历史上存在名称混淆现象,从现代研究看枸骨叶提取成分与传统北方处方的功劳叶作用相符,故本文通过检索枸骨叶获取功劳叶药物成分[2]。
1 材料与方法
1.1 GLY-XHC化学成分的收集通过TCMSP数据库(http://tcmspw.com/tcmsp.php)数据库,分别以“枸骨叶”“仙鹤草”为关键词检索功劳叶、仙鹤草中的化合物成分。以药物动力学原理为基础,以口服生物利用度(Oral bioavailability,OB)≥30%及类药性(drug-likeness,DL)≥0.18为筛选条件,筛选出符合条件的成分作为活性成分。
1.2 GLY-XHC靶点筛选及“药物-化合物-靶点”网络构建查阅文献及检索TCMSP数据库,筛选功劳叶、仙鹤草活性成分及其相对应的靶点,借助Uniprot数据库(https://www.uniprot.org)对靶点的基因名称进行校正。将靶点蛋白导入Cytoscape3.7.1软件构筑“药物-化合物-靶点”网络并进行分析。
1.3 GLY-XHC治疗缺血性中风的潜在作用靶点预测分别在DrugBank(https://go.drugbank.com),GeneCards(https://www.genecards.org),DisGeNET(https://www.disgenet.org),Therapeutic Target Database(http://db.idrblab.net/ttd)和OMIM(https://omim.org)中以“ischemic stroke”为关键词进行检索,获取疾病相关基因,将其与“1.2”项下筛选得到的复方靶点相互映射,获得治疗IS疾病的潜在靶点。
1.4 蛋白互作网络构建与分析将“1.3”项下筛选得出GLY-XHC可能具有治疗IS作用的潜在作用靶点输入STRING 11.0数据库(https://string-db.org),规定种属为“Homo Sapiens”,得到蛋白互作关系并将数据保存为TSV格式文件。将所得文件导入到Cytoscape3.7.1软件中构建蛋白互作网络并分析条件筛选核心靶点。
1.5 靶点富集分析为深入了解上述筛选出的GLY-XHC治疗IS的潜在作用靶点基因的功能以及在信号通路中的作用,运用DAVID 数据库(https://david.ncifcrf.gov/home.jsp)进行GO及KEGG 通路富集分析,设置P<0.05,将物种定义为“Homo Sapiens”。按照其富集的靶点数目进行排序,选取KEGG通路前20个条目进行可视化。
1.6 分子对接为了进一步验证本研究的可靠性,从蛋白互作网络中获得核心靶点,进行分子对接。我们使用Autodock Vina分析每种蛋白质配体的结合特性[4],为了准确评估预测目标,蛋白结构在对接之前需要对蛋白结构进行预处理,因为蛋白结构解析的时候会存在结构缺失,原子的局部电性没有标出,没有明确水分子的位置,以及氢原子的位置信息。首先从RCSB Protein Data Bank(http://www.pdb.org)下载PPI 网络中前5的核心靶点蛋白结构,为了保证分子对接的可靠性,我们选择分辨率小于3.0 a的蛋白质晶体结构来建立分子对接模型。可以通过PyMOL筛选制备对接配体,包括水缺失和原始配体的提取。然后通过Autodock工具以PDBQT格式保存蛋白质和配体[3]。最后通过Dock计算,将预测的药效团特征与前5个目标化合物分子拟合。当Docking Score绝对值>4.25表示分子与靶点具有一定的结合能力,>5.0表示结合能力较强,>7.0表示结合能力很强[4]。
2 结果
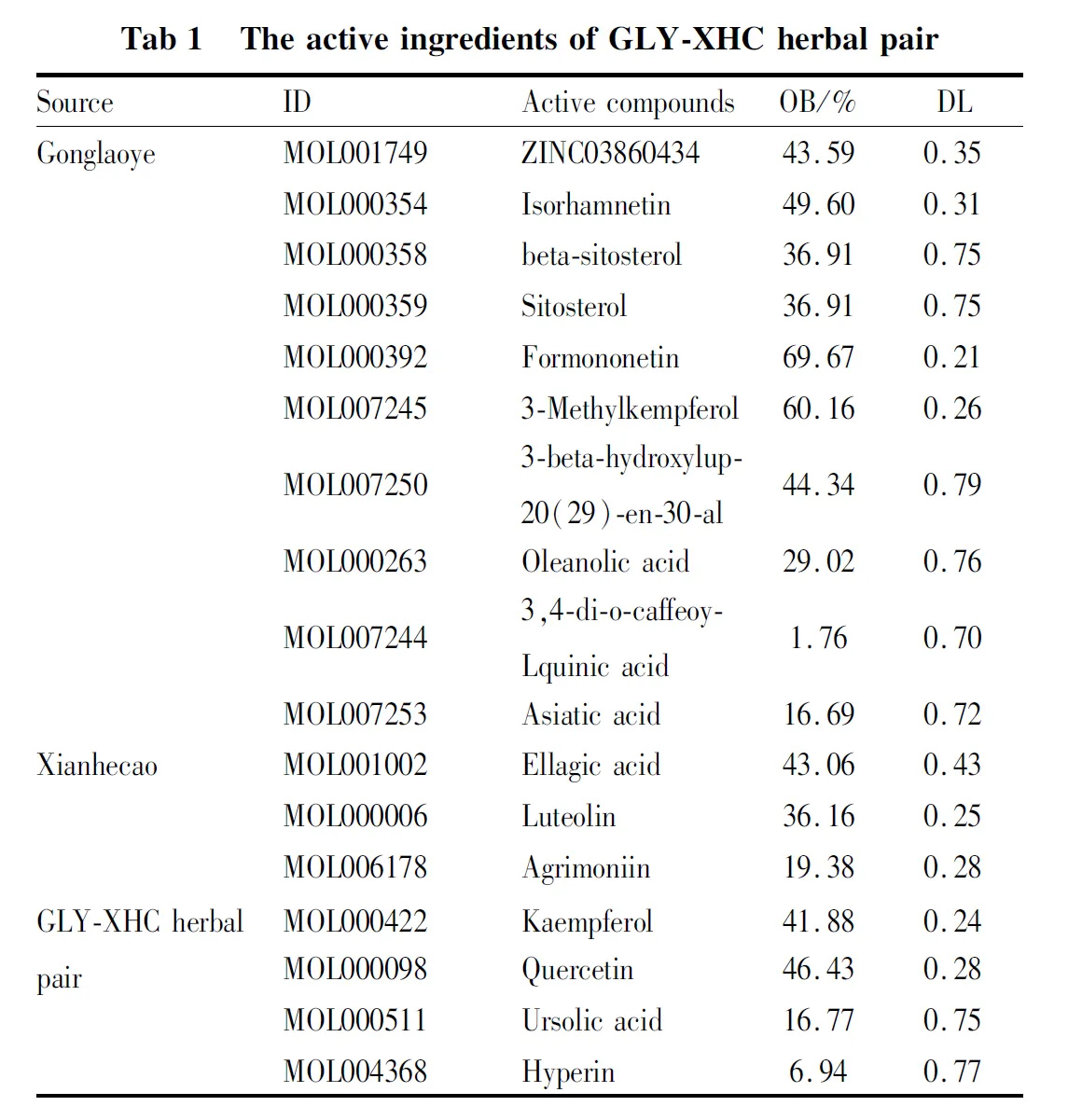
2.1 GLY-XHC中活性成分的筛选通过 TCMSP数据库得到GLY-XHC中化合物共97个,其中56个来自功劳叶,41个来自仙鹤草,根据OB≥30%同时DL≥0.18的标准,筛选得出GLY-XHC的活性化合物去重后共11个,再根据文献中报告了药对中含量较高,药理活性较强,虽然不满足OB及DL,也补充进药物主要成分,如熊果酸(ursolic acid)、绿原酸(3,4-di-o-caffeoylquinic acid)、金丝桃苷(Hyperin)等[5]。汇总后药物化合物成分共17个,见Tab 1。
2.2 “药物-化合物-靶点”网络分析分析网络中包含464个节点(其中药物节点2个,活性化合物节点去重后17个,以及445个靶点节点)及1 874条边。网络中黄色椭圆代表功劳叶和仙鹤草,红色三角形代表复方活性化合物,靶基因用紫色椭圆表示。在网络中,每条边表示节点与节点之间的互作关系。度值表示节点与其他节点的连接数目,运用“Network analyze”插件进行分析。筛选度值(degree)较为显著的节点,所得节点在网络中可能起到关键作用。活性化合物与靶点之间的多重对应关系体现了中药复方的复杂性,同时各成分与靶点之间相互作用可能是中药复方发挥整体性治疗的体现。基于以上理论,根据度值(degree)排名前5位的分别为槲皮素(quercetin)、山萘酚(kaempferol)、熊果酸、金丝桃苷、木犀草素,可与202、202、202、202、101个靶基因相互作用,其中前4位为药对共有的化合物,度值较高,可能在药对中起关键作用,是药对的核心化合物。在靶点中,根据degree排名前 5位的靶点,分别是CYP19A1、ALOX5、ESR2、TERT、MMP2,分别能与 18、16、16、15、14 个活性化合物相互作用。
2.3 GLY-XHC治疗缺血性中风核心靶点预测及筛选运用DrugBank、GeneCards、DisGeNET,TTD和OMIM数据库共筛选得到3 238个IS的潜在靶点,运用Venny 2. 1(http://bioinfogp.cnb.csic.es/tools/venny/index.html)在线工具绘制GLY-XHC活性成分靶点和IS靶点的韦恩图,并得到交集靶点共296个,即为预测GLY-XHC治疗IS的潜在靶点。
2.4 GLY-XHC治疗缺血性中风的核心靶点预测及分析将“2.3”项下筛选得到的296个潜在靶点输入STRING 11.0数据库中,得到蛋白互作网络。借助Cytoscape 3.7.1软件构建PPI网络,其中共包含296个节点,4 212条边。同样应用Network analyse插件进行分析,得出靶点度值(degree),根据度值降序排序,排名前5的靶点为AKT1、MAPK3、IL6、ALB、TNF,分别能与86、86、83、77、73个靶点相互作用,可能是GLY-XHC药对的核心靶点。
2.5 富集分析通过DAVID数据库分析得到2 500个GO富集条目(P<0.05),其中包括126类细胞组分(cell composition,CC)、161种细胞功能(molecular function,MF)和2 213个生物过程(biological processes,BP)。BP方面主要涉及对氧化合物的反应、对有机物质的反应、细胞对化学刺激的反应、对有机氮化合物的反应、细胞代谢的正调控、恒定作用、积极调节刺激反应、细胞通讯等过程。MF方面,离子结合、有机环化合物结合、信号传导器活性、信号受体活性等富集较为显著,见Fig 1。
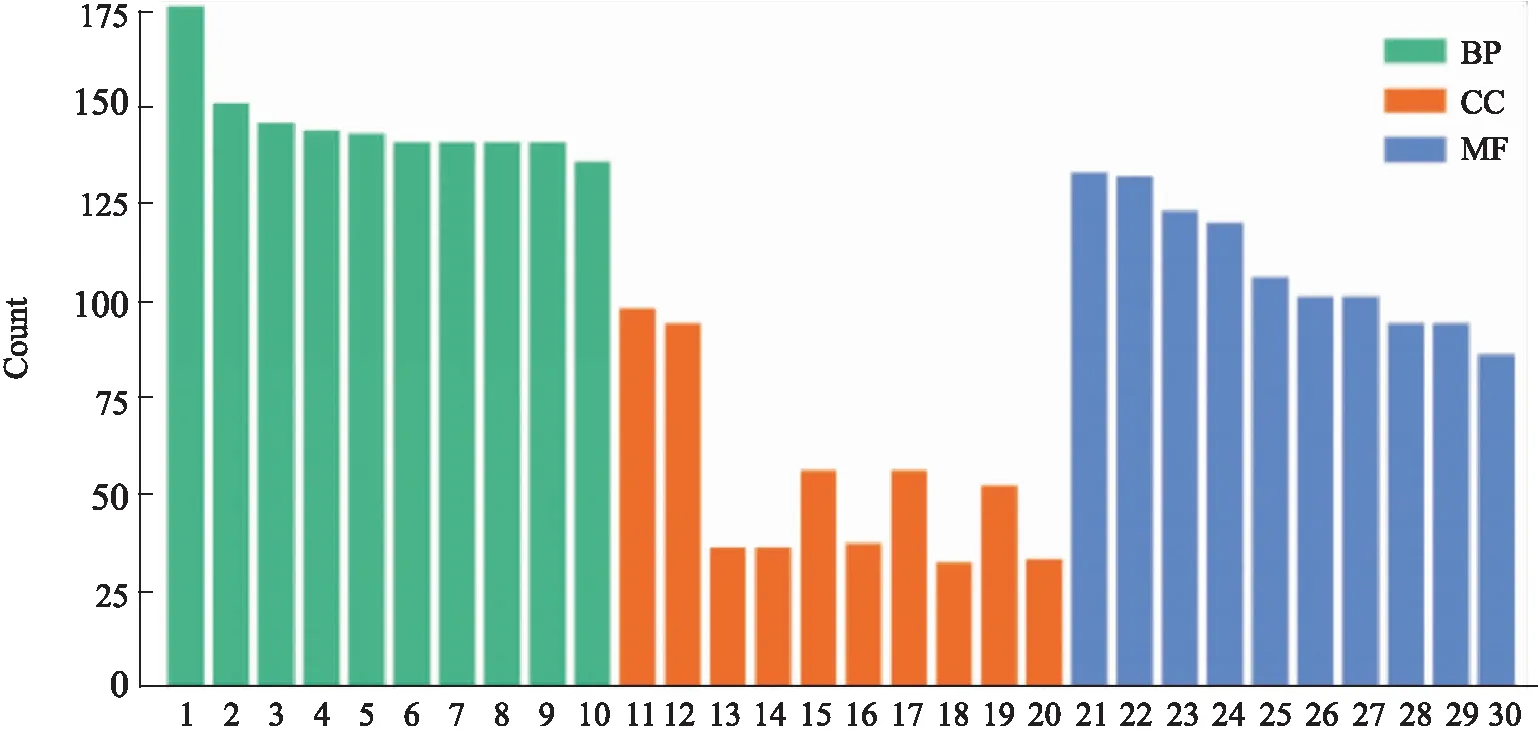
Fig 1 GO enrichment of GLY-XHC targets
通过 DAVID 数据库共筛选得到 KEGG 通路119条(P<0.05),主要涉及神经活性受体配体相互作用、PI3K-Akt信号通路、Rap1信号通路、cAMP信号通路、Ras信号通路、钙信号通路等。排名前20的通路利用气泡图进行可视化(Fig 2)。纵轴表示通路的名称,横轴表示富集值,气泡的大小表示富集在该通路上的基因数目。
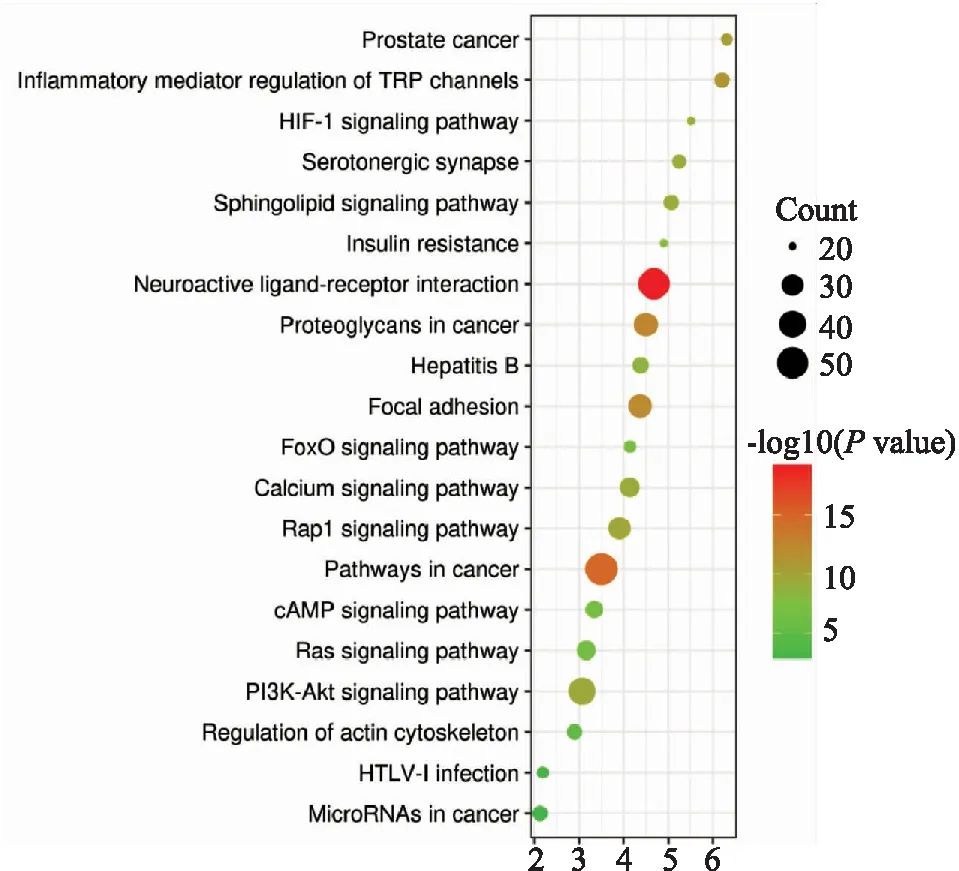
Fig 2 KEGG enrichment of proteins in core PPI network
2.6 分子对接在分子对接前,将核心靶点AKT1,MAPK3,IL6,ALB,TNF的蛋白结构从PDB数据库下载。分子对接结果显示GLY-XHC的核心化合物和潜在作用靶点的对接得分均≤-5.0 kcal·mol-1,由此可以表明GLY-XHC与预测的作用靶点有较强的结合活性。具体分子对接分数见Tab 2。配体与受体结合的构象稳定时能量越低,发生的作用可能性越大[3]。Fig 3-5以三维模式表示了各核心受体的活性位点中与小分子配体的结合模式,细节图显示小分子配体与受体H原子发生氢键作用,相应的残基通过标签标出,因此通过验证我们认为熊果酸、金丝桃苷等是GLY-XHC中重要的潜在活性化合物。
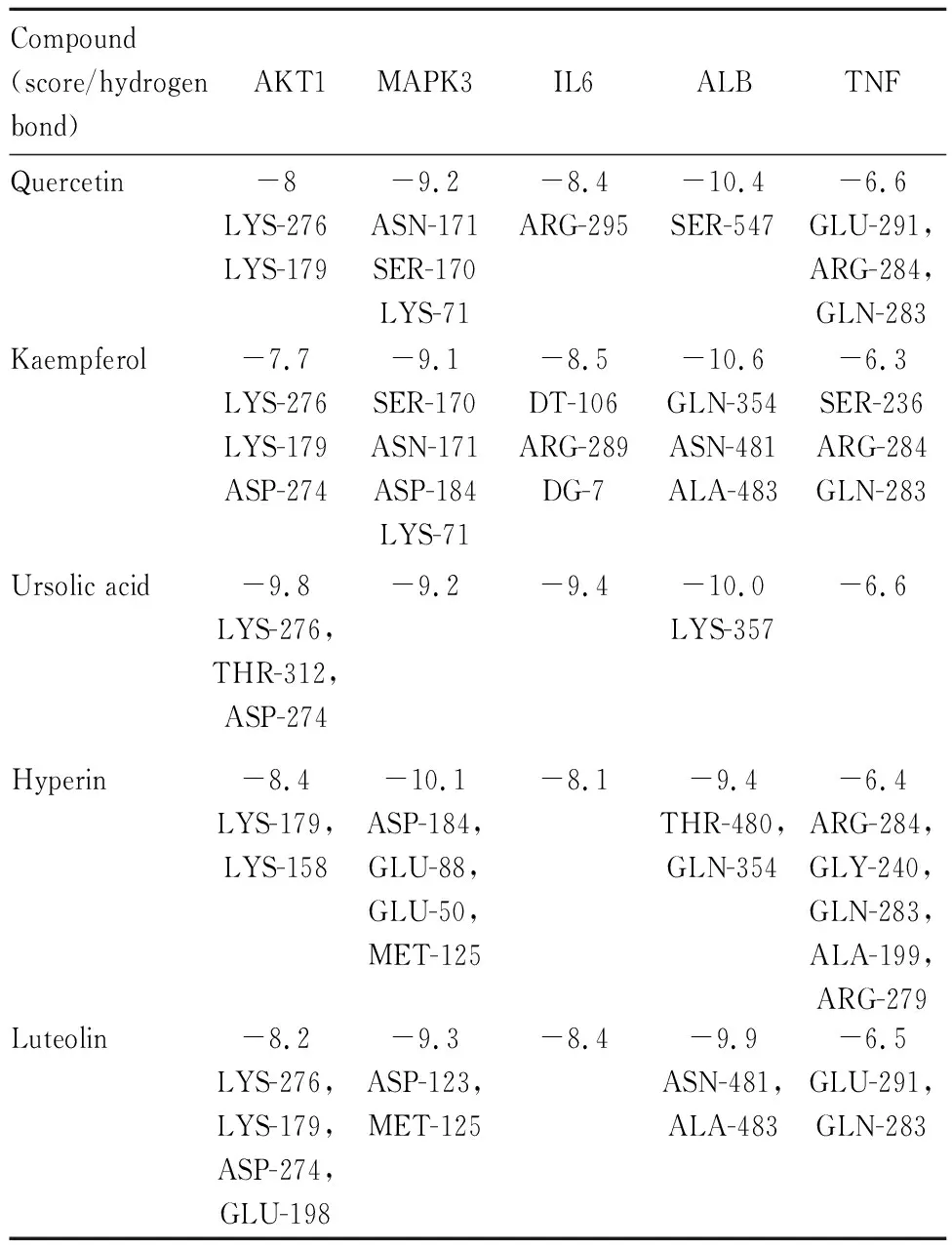
Tab 2 Five potential target protein interacting with five key molecules
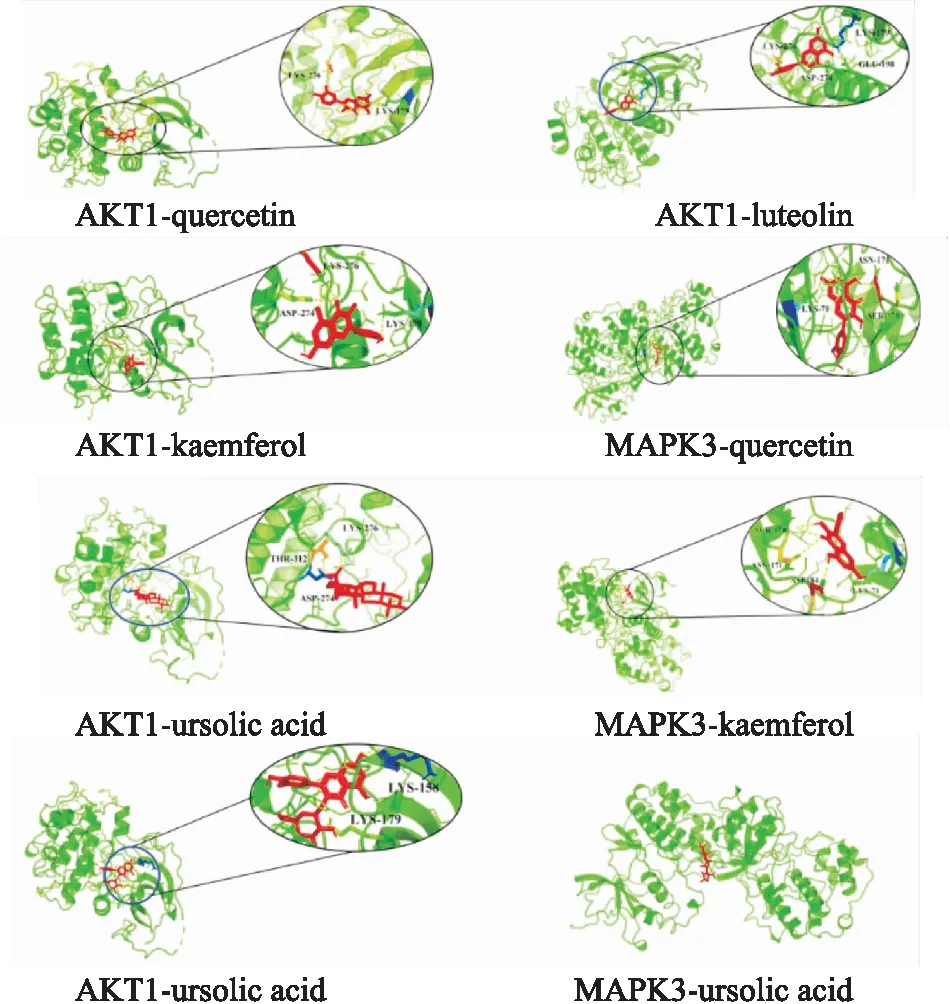
Fig 3 Receptor reacting with ligands
3 讨论
缺血性中风发病原因、病理过程及相关机制复杂多样,除静脉溶栓和机械取栓外只能以内科保守治疗为主,缺乏有证据的有效治疗措施,中药具有多成分多靶点的作用特点,可针对缺血性卒中发病的各个时点,不受时间窗局限,因此基于名家经验探讨中药治疗中风的机制具有重大意义。
传统医学认为中风是阴阳失调、气血逆乱,上犯于脑所引起的以突然昏仆,不省人事,半身不遂,口舌歪斜,为主要表现的一种病证,其理论源流从《内经》薄厥、风痱到《金匮要略》内虚邪中,发展到明清时期的肝阳化风,气血并逆,直冲犯脑所致。随着生活节奏的加快和工作压力的提升,中风的发病群体逐渐向中年人、青年人群偏移,其“内风正虚”应有别于传统的年老气血本虚。其病机一方面由于压力过大,烦劳过度使阳气升张,另一方面兼有生活节奏加快、休息不足造成的气血耗伤,从而阴阳失调,气血逆乱,发为中风。古云:“气有余便是火,气不足便是寒”,但是针对上述的中风好发证型,兼有气不足、虚火上浮,阳气升张的情况,若大量黄芪、人参补气虚,会发生舌躁目赤、胸肠满闷等状况。这就是补气药不适量导致的虚火上浮、虚不受补。若用少量参芪,疗效又不显著,因个体差异大,故最适剂量难以掌握。若以仙鹤草、功劳叶搭配补气则可虚火不生,弥补参芪补气之不足。
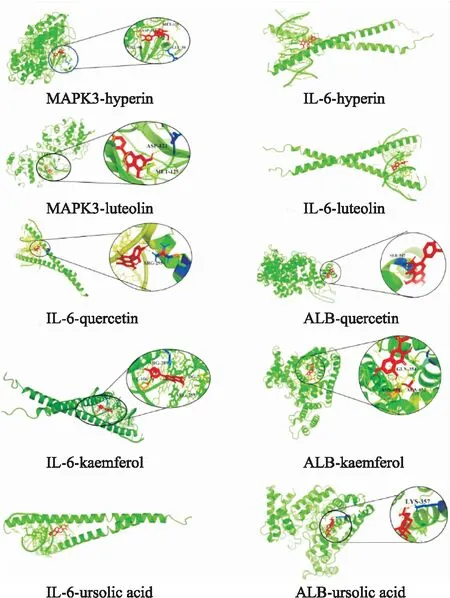
Fig 4 Receptor reacting with ligands
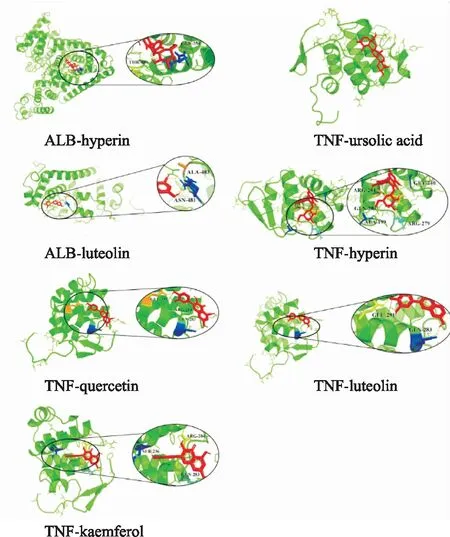
Fig 5 Receptor reacting with ligands
功劳叶、仙鹤草是中医内科学奠基人董建华教授的临证经验药对,在董老的学术传承过程中,被应用在脾胃病、老年病、中医急症等各个方面,且取得了良好的临床疗效。仙鹤草始载于《滇南本草》,苦凉之品,入肺、肝、脾,具有收敛止血、解毒补虚的功效,因其药性平和,兼有补虚固脱的作用。《百草镜》言其可“下气活血,理百病”。古今医家取其收敛止血之功治疗吐血、疟疾寒热等症,但对其补气功效则多忽略。江浙一带农村称本品为“脱力草”,有补虚强壮之功,可用治劳力过度所致的脱力劳伤,症见神疲乏力、面色萎黄者,常配红枣煮食,调补气血、治脱力劳伤,效果很好。现代药理研究表明,仙鹤草提取物在抗炎、抗氧化领域具有确切的药理作用,抗炎机制除了丝裂原活化蛋白激酶 (MAPK)/p38信号通路外,还可能涉及到iNOS和COX2蛋白表达水平的下调,以及MAPK/JNK的失活[6]。仙鹤草能够抑制TNF-α、IL-6、IL-1等促炎因子的表达,通过调节TRIF依赖的Syk-PLCγ/AKT信号通路发挥抗炎作用。仙鹤草内酯和去甲基仙鹤草内酯通过清除自由基的活性,激活Nrf2通路,抑制p38磷酸化,激活ERK、JNK、MAPK蛋白磷酸化,提高SOD抗氧化酶活性,有效地减轻了H2O2诱导的细胞损伤。功劳叶又称枸骨叶,性凉味苦,入肝肾,清热养阴,益肾平肝,用于肺痨咯血,骨蒸潮热,头晕目眩。《本经逢源》中记载功劳叶与红枣熬蜜膏可治劳伤失血萎蒻。现代药理研究表明,枸骨叶具有降血脂、抗心肌缺血、抗氧化、抗菌、免疫抑制等作用,将仙鹤草与功劳叶配伍,用于气虚患者,绝无虚火上浮之弊。有虚火者亦能清退。
为了进一步研究与探讨功劳叶、仙鹤草药对治疗缺血性中风的药效基础及潜在的生物学机制,本文利用网络药理学平台技术,通过筛选功劳叶、仙鹤草17个化合物,筛选药效靶点,获得296个疾病与药物交集靶点,构建蛋白互作网络,基因靶点富集分析及通路预测等手段,得到5个相关重要成分,分别是槲皮素、山萘酚、熊果酸、金丝桃苷、木犀草素。其中槲皮素、山奈酚、熊果酸、金丝桃苷可与202个靶点蛋白发生作用,可见其是GLY-XHC治疗缺血性中风关键成分。槲皮素具有神经保护、抗氧化、抗炎的作用,广泛应用于脑及脊髓损伤的动物模型中,有研究表明槲皮素可以通过保护神经元及线粒体功能来减轻脑卒中后带来的继发性损害[7]。槲皮素神经保护功能已得到广泛应用,但槲皮素的药理机制研究仍在深入,其临床使用价值还在不断进行探索。而山奈酚具有抗氧化活性,调节巨噬细胞,保护细胞损伤。近年来研究标明熊果酸具有多种神经保护作用,已经在缺血性脑血管病中显示出治疗前景,主要通过激活Nrf2-ARE通路,减少脂质过氧化物的堆积,保护大脑免受局灶性脑缺血后的氧化损伤;抑制MAPK信号通路的激活,减轻脑缺血/再灌注损伤;抑制Ca2+内流改善缺血区血流状况。金丝桃苷也被报告了对脑缺血、缺氧具有保护作用,主要通过抑制NO释放、Ca2+超载减少神经细胞缺氧损伤。
根据功劳叶、仙鹤草药对治疗缺血性中风的蛋白互作网络结果分析得出296个靶点,通过分析发现AKT1、MAPK3、IL6、ALB、TNF等靶点可能是治疗缺血性中风的关键靶点。其中AKT是一种激酶,在调节细胞增殖、生长和存活过程中发挥重要作用,Akt包含3种结构相似的同型异构体,分别为Akt1,Akt2和Akt3。Akt1在控制细胞增殖、存活和凋亡中发挥至关重要作用,能被多种上游细胞因子(如血管内皮生长因子等)激活,进而对缺血性损伤后的神经元发挥保护作用。Akt1基因缺失会诱导血管内皮细胞功能障碍,细胞血管平滑肌迁移和存活改变,促进动脉粥样硬化[8]。MAPK3(丝裂原活化蛋白激酶,又称JNK),属于MAPK和JNK家族成员,激活的JNK信号通路对细胞分化、凋亡、应激反应、炎症反应、缺血再灌注损伤等生理病理过程起着至关重要的调节作用[9]。白细胞介素-6(interleukin6,IL-6)是一种集多种生物学效应如机体防御、免疫反应和造血反应等于一身的细胞因子,缺血半暗带中神经元损伤程度与IL-6表达水平高度相关[10]。人血白蛋白(ALB)也被证明在缺血/再灌注的治疗中有作用,有研究表明,大剂量ALB可显著减少大鼠模型缺血再灌注导致的脑梗死体积以及减轻脑水肿[11]。肿瘤坏死因子(TNF)属于发生缺血早期产生的炎性因子,可激活白细胞黏附到脑缺血区微血管内皮细胞上,引起内皮细胞皱缩、破裂和坏死,破坏血脑屏障,并可在细胞因子作用下进入缺血区导致严重的炎症反应,从而加重脑组织损伤,也有研究表明TNF与IS后梗死体积相关[12]。本文筛选得到的核心靶点和文献报道的脑缺血重要靶标基本一致。
通过GLY-XHC治疗缺血性中风的靶点GO富集分析得出,对氧化合物的反应、对有机物质的反应、细胞对化学刺激的反应、对有机氮化合物的反应、细胞代谢的正调控、恒定作用、积极调节刺激反应、细胞通讯等过程。KEGG富集通路分析得出,功劳叶、仙鹤草药对治疗缺血性中风的潜在靶点主要涉及神经活性受体配体相互作用、PI3K-Akt信号通路、Rap1信号通路、钙信号通路等。钙信号通路是导致神经元缺氧损伤的重要因素,脑缺血能导致胞膜及胞内钙通道激活,改变了神经元中的Ca2+信号传导,进而影响它们对缺血的反应,诱导细胞内钙离子水平升高,是缺血后神经细胞内复杂信号通路激活的重要介质[13]。Rap1信号通路在血小板整合素激活及血小板生成过程中发挥重要作用[14]。其中,PI3K-Akt信号通路通过分析发现其应用广泛,与多条调节通路有关。在脑中风早期,神经细胞以坏死为主,其后以凋亡为主,在大鼠局灶性脑缺血模型中发现了严重的神经凋亡现象,PI3K-Akt 信号通路与脑缺血发生后细胞的凋亡有密切关系,多种神经营养因子、缺血后处理及中药通过激活 PI3K/Akt信号通路抑制细胞凋亡来实现神经的营养及保护作用[15]。由此可见,GLY-XHC药对主要通过PI3K-AKt通路以及与脑缺血相关的多个通路影响脑缺血后的病理变化。
分子对接结果显示,功劳叶、仙鹤草药对的核心有效化合物槲皮素、山奈酚、金丝桃苷、熊果酸和木犀草素(luteolin)与核心靶蛋白AKT1、IL-6、ALB、TNF、MAPK3的结合能均远小于-5 kJ·mol-1,由此可见这些核心化合物与受体蛋白的结合活性较高,进一步验证了网络药理学所得出的结果。
综上所述,本文基于董老经验药对,通过网络药理学方法对功劳叶、仙鹤草用于缺血性中风治疗的作用机制进行了分析讨论,在初步筛选出的作用靶点基础上再结合分子对接分析进行验证。结果显示,GLY-XHC药对中金丝桃苷和熊果酸等成分可能通过PI3K/AKT等信号通路,作用于AKT1、IL-6、ALB、TNF、MAPK3等靶点,发挥神经保护、减轻再灌注损伤、抑制细胞凋亡、抗炎等作用。并从中医整体观出发,揭示中药多成分、多靶点的协同治疗作用,对后期进一步确定关键活性成分、新药研发具有一定的指导意义。但本研究仍有一定的局限性,由于数据库的数据及相关文献有限,基于本文所预测得出功劳叶-仙鹤草治疗靶点所展示的相关通路,后续将重点开展GLY-XHC治疗脑缺血的相关实验实证工作,以期为IS治疗药物的研发提供方向及依据。