AMPK抑制剂增加阿司匹林对肝癌的抑制作用
孙昊璐,吴一万,卞和格,金 娟
(安徽医科大学基础医学院药理学教研室,安徽 合肥 230032)
阿司匹林是一种被广泛使用的非甾体抗炎药,已有100多年的历史。研究发现,阿司匹林可以预防多种癌症,其中包括肝细胞癌(hepatocellular carcinoma,HCC)。此外,阿司匹林还可以降低癌症发病率和死亡率[1-2]。大量的证据证实阿司匹林对多种癌症均有预防作用[3]。然而,HCC细胞对阿司匹林的应答可能会导致阿司匹林抵抗性的产生,目前针对此领域仍然缺乏足够的认识。
自噬是细胞通过双膜细胞器自食的过程,自噬参与了应激条件下的细胞稳态,包括能量限制、营养缺乏、缺氧和细胞应激[4]。越来越多的证据表明,自噬在HCC疾病中具有关键作用[5]。既往有研究表明自噬具有抑制肿瘤生长的功能。与此同时,另一些研究人员认为,HCC细胞依赖自噬生存。尽管自噬与细胞类型和环境应激有关,其作用是抗癌还是促癌仍存在争议[6-7]。
阿司匹林通过抑制环氧化酶(COX)、前列腺素和其他炎症介质的产生,从根本上抑制癌症[8]。有研究表明,除了COX,阿司匹林还可能靶向其他蛋白,如腺苷单磷酸活化蛋白激酶((adenosine monophosphate activated protein kinase,AMPK),在代谢应激中调节能量稳态和代谢应激,从而促进细胞生存[9-10]。AMPK信号被认为是阿司匹林诱导细胞产生自噬的关键因素[11]。AMPK和哺乳动物雷帕霉素靶蛋白(mTOR)参与了自噬的起始阶段。在营养缺乏的情况下,激活的AMPK通过抑制mTORC1,触发自噬起始[7, 12]。部分研究表明,阿司匹林可能是通过诱导自噬抑制肿瘤血管生成的作用[13-14]。相反,也有研究发现AMPK介导的mTORC2和髓细胞白血病-1(myeloid leukemia-1,MCL-1)的上调可能会损害阿司匹林的抗癌作用[9]。这些发现提示,自噬可以激活并参与阿司匹林对HCC疾病的治疗作用。然而,阿司匹林诱导的自噬作用是促进肝癌细胞存活还是抑制肝癌细胞生长仍存在较大的争议。本研究旨在探讨阿司匹林治疗HCC的可能机制,以及评估阿司匹林单独或联合AMPK抑制剂治疗肝癌的疗效。
1 材料与方法
1.1 主要试剂肝癌细胞株HepG2购买于中国科学院(上海)细胞株库。阿司匹林(货号:A2093)、Compound C(货号:866405-64-3)、CCK-8(货号:96992)以及二乙基亚硝胺(DEN) (货号:NO756-10ML)均购自美国Sigma。使用的抗体为:抗AMPK(货号:ab3759)、抗mTOR(货号:ab2732)、抗Beclin-1(货号:ab62557)、抗LC-3(货号:ab62721)、抗TFEB(货号:ab270604)均购自美国Abcam。
1.2 细胞培养HepG2细胞保存于含有10%胎牛血清(FBS)、100 kU·L-1青霉素和100 g·L-1硫酸链霉素的DMEM中,在37℃、5%CO2、95%空气湿度的培养箱中进行培养。
1.3 二乙基亚硝胺(DEN)诱导的大鼠肝癌模型成年雄性SD大鼠,6周龄,购自安徽医科大学动物中心。大鼠饲养于安徽医科大学基础医学院动物房,室温(28±2)℃,湿度45%-60%。整个实验过程中,所有大鼠常规饲养。模型组大鼠于8周龄时,进行腹腔DEN注射。DEN注射条件为:50 mg·kg-1DEN,每周1次,连续注射18周。DEN注射12周后开始进行阿司匹林治疗,将大鼠随机分为4组,每组5只,腹腔灌注生理盐水(对照组)、DEN组(模型组)、阿司匹林5、50 mg·kg-1。所有的动物都可以自由获得水和饲料。所有实验经安徽医科大学实验动物委员会批准。
1.4 组织病理学检查实验结束后,按照动物伦理准则,将所有动物进行麻醉后牺牲。所有组织样本均取自肝左叶。采用含40%福尔马林的固定液固定组织,石蜡包埋后进行组织切片,组织切片厚度为5-6 μm,HE染色。
1.5 Western blot肝组织收集后,用RIPA裂解缓冲液肝组织进行总蛋白的提取。用Lowry蛋白法测定蛋白浓度。用抗AMPK、LC3、mTOR和β-actin的小鼠或人的抗体和相应的辣根过氧化物酶(HRP)结合的山羊抗兔抗体(1 ∶10 000)进行免疫印迹检测分析。采用增强化学发光系统进行显影。
1.6 平板克隆形成试验HepG2细胞置于的6孔板中培养,培养密度为1×104个/孔。培养24 h后给予阿司匹林治疗。将培养细胞分为4组:对照组、阿司匹林2.5、5、10 mmol·L-1。刺激48 h后,弃掉药品培养液更换正常培养液,所有细胞正常培养20 d,PBS仔细清洗3遍,每孔加5 mL甲醇,固定15 min,弃去固定液,每孔加入Giemsa染色液2 mL,孵育20 min,纯水洗净,晾干,拍照。使用Image-Pro Plus软件计算克隆的数量。
1.7 细胞凋亡检测将细胞(5×104个/孔)接种于12孔板中培养过夜,加不同浓度的阿司匹林24 h。弃掉培养液,PBS清洗2次。每孔加入膜联蛋白V结合液400 μL,膜联蛋白V/FITC染色液5 μL,碘化丙啶染色10 μL。混合后置于室温,避光反应15 min,荧光显微镜下观察细胞凋亡率。
1.8 细胞增殖测定CCK-8法:取指数生长期的HepG2细胞,以8×104个/孔的密度种在96孔板上孵育过夜。然后,在用药品刺激细胞之前,细胞用无血清培养基饥饿培养24 h。阿司匹林处理细胞24 h或48 h后,按照10 ∶1加入CCK-8试剂,加入细胞,37 ℃、5% CO2培养箱孵育2 h。450 nm测量OD值。细胞相对活力测定公式如下:细胞相对活力/%=(实验样品OD值-空白对照组OD值)/(对照OD值-空白对照组OD值)×100%。

2 结果
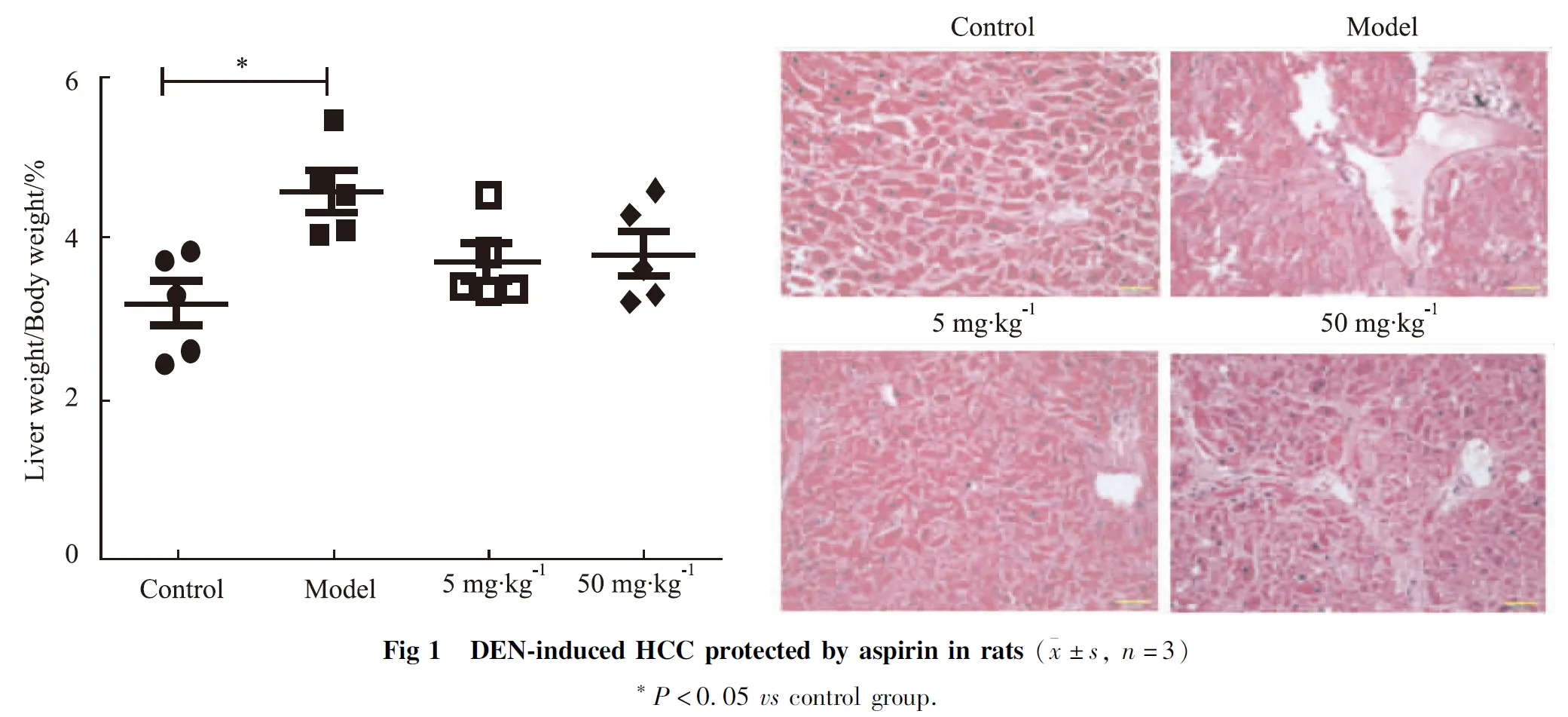
2.1 阿司匹林抑制DEN诱导的HCC为验证阿司匹林对DEN诱导的肝癌的保护作用,将SD大鼠腹腔注射DEN 12周后,给予SD雄性大鼠阿司匹林5、50 mg·kg-1·d-1进行灌胃,连续8周。DEN给药20周后,DEN组小鼠肝脏/体质量比值较正常组明显增加。不同浓度的阿司匹林组间大鼠的肝/体质量比与正常组相比,没有明显差异(Fig 1A)。收集肝脏组织后分别检测DEN组和阿司匹林治疗组大鼠的病理切片(Fig 1B)。正常对照大鼠肝脏切片显示肝脏组织学正常,肝细胞呈放射状排列,围绕中央静脉。经DEN处理的大鼠肝脏切片显示肝小叶已丧失其特征性外观,肝细胞坏死、变形、形态异常、结缔组织增生。阿司匹林治疗组的大鼠肝切片显示,肝细胞正常排列并且有一定的恢复。
2.2 阿司匹林对DEN诱导的大鼠肝癌中自噬的影响因为激活AMPK会导致自噬,所以我们设计了自噬相关实验进行检验。此外, LC3-Ⅱ是自噬标记物。将AMPK和LC3蛋白与β-actin蛋白条带强度表达相比较,分析其蛋白表达水平。如Fig 2所示,在5和50 mg·kg-1阿司匹林处理下,AMPK蛋白表达增加。与模型组比较,阿司匹林组LC3-Ⅱ/Ⅰ的蛋白比值较高。

2.3 阿司匹林对HepG2细胞增殖的影响为了验证阿司匹林对肝癌细胞增殖的影响,本实验分别用不同浓度的阿司匹林处理HepG2细胞,然后进行CCK-8分析。阿司匹林以时间及剂量依赖的方式抑制HepG2细胞的增殖(Fig 3A)。为进一步验证阿司匹林对肝癌细胞增殖的抑制作用,采用能反映癌细胞增殖和侵袭的平板克隆形成实验[15]。结果显示,阿司匹林明显抑制HepG2细胞的克隆形成(Fig 3B)。

Fig 3 Effect of aspirin on cell growth and clone formation of HCC cells n=3)*P<0.05, **P<0.01 vs control group.
2.4 阿司匹林诱导HepG2细胞自噬Western blot检测HepG2细胞中Beclin-1蛋白的表达。结果显示,2.5、5 mmol·L-1阿司匹林均明显刺激HepG2细胞中Beclin-1的表达,Fig 4。转录因子EB(TFEB)通过驱动自噬和溶酶体基因的表达来协调这一过程。因此,我们检测了TFEB在阿司匹林治疗后的表达。本研究中,2.5和5 mmol·L-1阿司匹林促进TFEB表达增加,与Beclin-1表达结果相一致(Fig 4)。

Fig 4 Autophagy in HepG2 induced by aspirin n=3) **P<0.01 vs control group.
2.5 阿司匹林对HepG2细胞AMPK相关自噬的影响最近有研究表明,阿司匹林通过直接激活AMPK和抑制mTOR信号通路来靶向调节细胞内能量代谢和稳态[11]。因此,我们研究了AMPK和mTOR信号在阿司匹林治疗的HCC细胞生长中的作用。结果显示,阿司匹林上调HepG2细胞中AMPK,降低了mTOR的表达(Fig 5)。综上所述,这些数据表明阿司匹林可激活AMPK信号并抑制mTOR而诱导自噬产生。

Fig 5 Effect of aspirin on AMPK and mTOR expression in HepG2 cells by Western blot n=3)
2.6 阿司匹林联合AMPK抑制剂协同抑制HCC细胞增殖和克隆形成阿司匹林诱导HCC细胞自噬激活,此过程可能与阿司匹林抵抗有关,我们推测AMPK抑制剂Compound C可能通过抑制自噬增强阿司匹林抗HCC作用。为了确定抑制自噬是否能增强阿司匹林抗HCC作用,我们采用阿司匹林联合Compound C进行检验。Compound C作为AMPK抑制剂在已发表的论文有较多使用,根据既往研究,我们选择了两种剂量(5、10 μmol·L-1)进行测试。通过检测Compound C对HepG2细胞的毒性作用。结果表明,5 μmol·L-1Compound C对HCC细胞的毒性作用较小,因此我们将此浓度作为下一步实验的给药浓度(Fig 6A)。与单独用药相比,阿司匹林联合5 μmol·L-1Compound C治疗HepG2细胞,HepG2细胞的存活数量明显减少(Fig 6B)。此外,阿司匹林与Compound C联用对HCC细胞克隆形成的抑制作用更加明显(Fig 6C,D)。

Fig 6 Cell growth and clone formationsynergistically inhibited by co-treatment of aspirin and AMPK inhibitor Compound C (CC) n=3)
2.7 阿司匹林与Compound C联合对HepG2细胞凋亡的影响接下来,我们观察了阿司匹林与Compound C联合对HepG2细胞凋亡的影响。研究发现,在阿司匹林浓度低至2.5mmol·L-1时,联合治疗也可明显增加肝癌细胞凋亡(Fig 7A-D)。凋亡蛋白caspase-3的表达也证明了这个结果(Fig 7E-F)。这些数据表明阿司匹林和AMPK抑制剂联合治疗HCC比单独使用阿司匹林疗效更好。

Fig 7 Apoptosis induced by aspirin and Compound C on HCC cells n=3)*P<0.05, **P<0.01 vs control group.
3 讨论
长期小剂量服用阿司匹林可以明显降低癌症发病率,特别是胃肠道肿瘤[16]。一项超过26年的随访研究报告指出,长期规律服用小剂量阿司匹林与患HCC呈剂量依赖性降低,服用阿司匹林5年以上其疗效明显增加[17]。在本项研究中,我们发现阿司匹林可诱导HepG2细胞产生AMPK相关的自噬,从而对抗其对肝癌细胞的生长起到保护作用。采用阿司匹林联合AMPK抑制剂可协同抑制HCC细胞增殖和单细胞克隆形成。
本研究采用DEN诱导的大鼠肝癌模型。我们发现,DEN组大鼠肝脏/体质量比明显升高,而在阿司匹林组中大鼠的肝/体质量比没有明显差异(Fig 1A)。同时,阿司匹林治疗组LC3-Ⅱ/Ⅰ比值升高,AMPK表达增加。这些数据表明,阿司匹林可诱导肝癌细胞自噬的产生。
自噬的主要调节蛋白是AMPK和mTOR,它促进细胞器和蛋白质的循环和/或降解,以维持细胞内稳态[18]。自噬在肝癌发生发展过程中如何积极调节细胞存活或诱导细胞凋亡仍有争议。有报道指出,自噬促进肝癌细胞死亡[14],相反,另一些研究显示,自噬可以维持肝癌细胞的存活[6, 9]。因此,自噬激活对肝癌细胞增殖和存活的影响可能与环境有关。前期研究表明,AMPK信号通路可调节阿司匹林的作用[9]。阿司匹林通过AMPK激活、mTORC1抑制和自噬诱导,抑制PIK3CA突变型乳腺癌细胞的活力和生长。在本研究中,我们发现阿司匹林诱导的自噬通过AMPK-mTOR信号通路促进HCC细胞存活。AMPK是细胞生存所必需的,其表达降低会降低前列腺癌细胞活力。因此,AMPK的激活对细胞增殖和存活的影响可能与环境有关。我们证明,在阿司匹林治疗中,AMPK的激活可能通过上调自噬促进肝癌细胞增殖、克隆和存活。AMPK抑制剂Compound C明显增强阿司匹林对细胞凋亡、细胞增殖和细胞克隆形成的抑制作用。这些结果表明AMPK/mTOR信号通路诱导的自噬削弱阿司匹林对肝癌细胞的抑制作用。
综上,阿司匹林可通过激活AMPK诱导肝癌细胞自噬,而自噬的发生削弱了其抗癌作用。与单药相比,阿司匹林联合AMPK抑制剂可明显降低肿瘤增殖和细胞克隆形成,并诱导细胞凋亡。阿司匹林联合AMPK抑制剂可能是肝癌的有效治疗方法。本研究为肝癌的临床治疗提供了新的思路。