产油皮状丝孢酵母突变株的转录组分析
许鹏飞, 吕育财,2, 任立伟,2,ZHANG Yaoping, 龚大春,2
(1.三峡大学 生物与制药学院 中国轻工业功能酵母重点实验室,湖北 宜昌 443002; 2.三峡大学 湖北省生物酵素工程技术研究中心,湖北 宜昌 443002; 3. DOE-Great Lakes Bioenergy Research Center (GLBRC) University of Wisconsin-Madison, Madison WI 53706,USA)
皮状丝孢酵母(Trichosporoncutaneum)是一种可以利用葡萄糖、木糖等碳源在胞内积累油脂的产油微生物[1-2],积累的油脂主要成分为甘油三酯(TAG),其成分与棕榈油、菜油相似,为C16和C18脂肪酸,可以作为生物柴油的原料[3]。由于微生物油脂产量不高,使得菌种选育成为微生物油脂研究的热点。刘宪夫[4]利用乙基甲烷磺酸(EMS)诱变小球藻,使油脂产量提高了9.03%;郝冉等[5]利用紫外照射和氮离子注入技术处理深黄被孢霉,使γ-亚麻酸产量提高了60.27%。与传统的紫外和化学诱变技术相比,常压室温等离子体(ARTP)作为一种新型的诱变手段被广泛应用于菌种选育[6-8],刘冬等[9]通过ARTP诱变红酵母,油脂产量由1.22 g/L提高到3.96 g/L;Cao等[10]利用ARTP诱变小球藻,诱变菌株的油脂产量提高了16.85%。以上诱变方法都是非理性的研究,要想对产油微生物进行定向的育种还需了解产油途径中关键基因及代谢途径。
转录组测序是一种可以了解特定细胞体内RNA总和的技术,可以用来研究基因的转录情况和代谢调控规律,利用转录组分析可以探索突变菌株的基因差异表达情况及产油过程中起关键作用的酶[11-12]。
本研究以皮状丝孢酵母为研究对象,利用ARTP对其进行诱变处理,筛选得到油脂高产菌株,再利用转录组测序技术研究高产菌株和原始菌株的转录组表达情况,筛选油脂积累的差异表达基因和差异表达酶,以期深入了解微生物油脂积累的基因表达和代谢调控,为进一步的菌株分子改造提供理论基础。
1 材料与方法
1.1 菌株
本研究所用皮状丝孢酵母Trichosporoncuraneum2.571(WT),中国普通微生物菌种保藏管理中心;突变株A1由ARTP诱变筛选获得[13],保存于中国典型微生物保藏中心,保藏号为CCTCC M 2018318。
1.2 ARTP诱变
取对数生长期的皮状丝孢酵母(WT),先经ARTP诱变处理,然后涂布到芝麻酚抗性平板上培养,挑选生长旺盛的菌落进行孔板培养,再利用尼罗红荧光染色,选取高荧光强度的菌株,进行摇瓶发酵。
1.3 发酵培养过程相关指标的检测
将两菌株分别接种到摇瓶中培养,每天取样检测残糖、生物量和油脂产量。
残糖的含量:利用二硝基水杨酸(DNS)法[13]检测培养基中的残糖。
生物量的测定:取发酵液于烘干称质量的离心管中,8 000 r/min离心5 min,弃上清液后加适量去离子水重悬,离心去上清液后放入100 ℃烘箱中,烘干至恒质量,计算生物量。
油脂产量的测定:将烘干的菌体1 g加入8 mL 8 moL/L的盐酸,摇匀后室温静置1 h,再沸水浴10 min,冷却后再沸水浴5 min。待温度下降后,加入氯仿和甲醇溶液进行多次萃取,将收集到的氯仿层蒸发除去氯仿,得到微生物油脂,再计算油脂的产量。
1.4 转录组测序及分析
1.4.1 样品准备
将WT和A1菌株划线到YPD平板培养基上培养2 d,挑取单菌落接种到种子液培养18 h后进行发酵培养,培养至第9 天时取样,用于转录组测序。
1.4.2 总RNA提取和检测
利用Total RNA Extractor (Trizol)试剂盒提取总RNA、Qubit2.0检测RNA浓度、琼脂糖凝胶检测RNA完整性以及基因组污染情况。
1.4.3 cDNA文库构建和测序
使用VAHTSTMmRNA-seq V2 Library Prep Kit for Illumina©试剂盒进行文库构建,采用Illumina HiseqTM进行高通量测序,得到的原始图像数据文件经CASAVA碱基识别分析转化为原始测序序列。文库构建及转录组测序工作均委托上海生工公司完成。
1.4.4 基因功能注释、分类
通过NCBI的核酸序列数据库(NT)、非冗余蛋白序列数据库(NR)、基因直系同源关系注释系统(KOG)、注释的蛋白质序列数据库(Swiss-Prot)、保守结构域数据库(CDD)、基因本体论(GO)、京都基因和基因组百科全书(KEGG)来注释样品的基因[14]。
1.4.5 差异表达基因分析
先采用TMM对read count数据进行标准化处理,之后用DEGseq进行差异分析[15]。为了得到显著差异的基因,将筛选条件设为:q值<0.05 且差异倍数(|log2FoldChange|)>2,来比较诱变菌株和原始菌株间的差异表达基因。对得到的差异表达的基因功能进行GO富集和KEGG代谢通路富集,并挑选与脂肪酸积累相关的候选基因。
1.4.6 差异表达基因RT-PCR验证
挑选与油脂合成相关的上调基因,使用 Premier 5.0软件设计合适引物,利用UNIQ-10 柱式 Trizol 总RNA抽提试剂盒提取酵母总RNA,进行反转录。再通过StepOne Plus型荧光定量PCR仪扩增相应基因。以actin为内参基因,计算相对表达量。
2 结果与分析
2.1 诱变结果
ARTP诱变仪通过高纯He产生活性粒子来作用于微生物,使微生物的基因和细胞膜发生改变,从而影响微生物的代谢过程。通过ARTP诱变处理皮状丝孢酵母并通过高通量筛选,从诱变库中筛选得到一株较原始菌株有较大提高的诱变菌株A1,结果如图1所示。由图1可知:与原始菌株相比,菌株A1的生物量、油脂产量分别提高了41.7%、103.1%,油脂含量从39.3%提高到56.5%,诱变效果显著。可见ARTP产生的活性粒子,能有效作用于酵母细胞基因,从而筛选出高产的突变菌株。
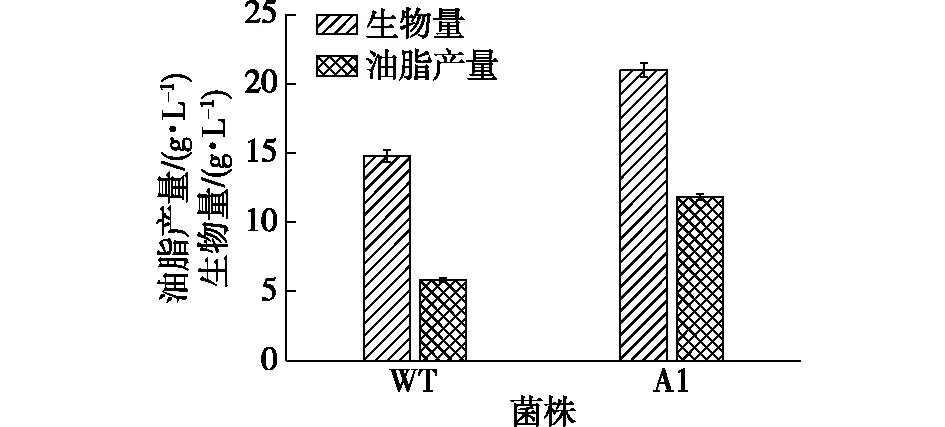
图1 原始菌株(WT)与突变菌株(A1)油脂产量对比
2.2 发酵培养
两菌株的摇瓶发酵结果如图2所示。由图2可知:当底物葡萄糖为70 g/L时,菌株WT对葡萄糖的利用率远不如菌株A1,发酵72 h后菌株WT对葡萄糖的利用速率变得缓慢,而菌株A1一直处于快速消耗葡萄糖的状态,直至葡萄糖耗尽。由于可以摄取更多的底物,所以菌株A1的生物量和油脂产量均比菌株WT的有了很大提高。
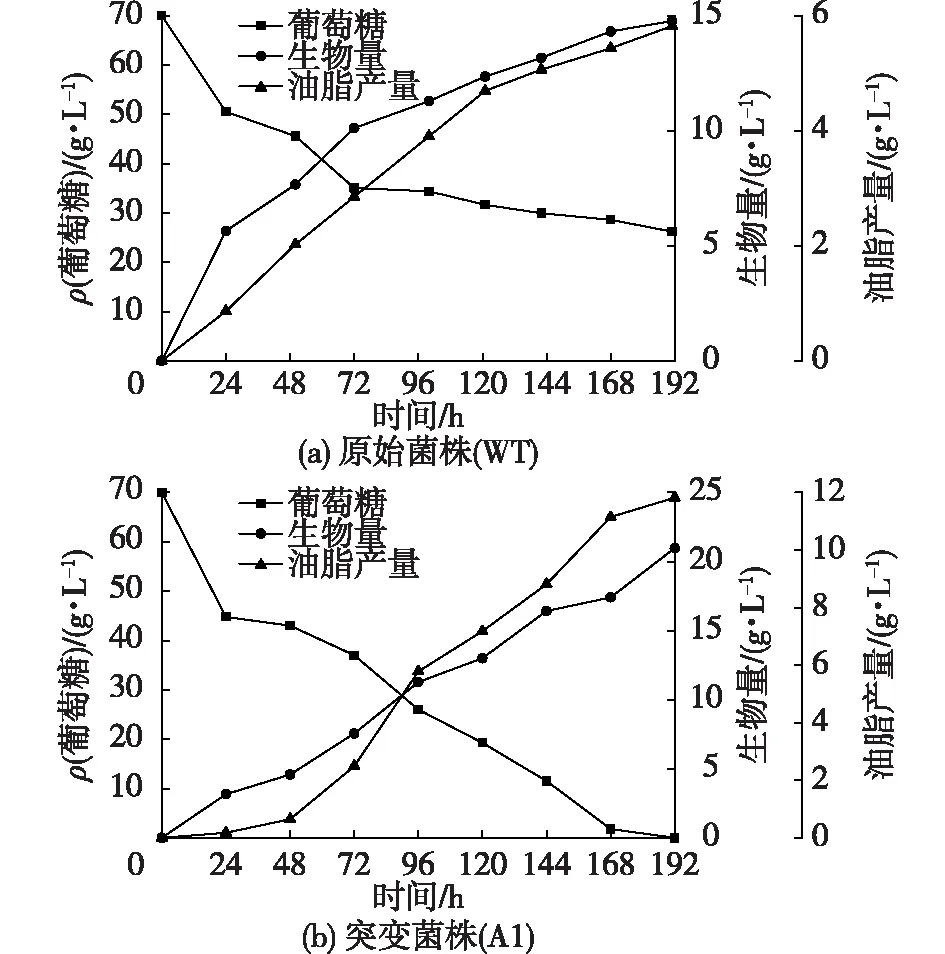
图2 原始菌株(WT)与诱变菌株(A1)摇瓶发酵曲线
2.3 测序结果和质量评估
对原始菌和诱变菌进行Illumina测序,然后将得到的原始数据进行过滤,除去含有带接头的和低质量的序列,结果见表1。由表1可知:最终原始菌和诱变菌的总读数分别为4 402万和4 807万,就总读数而言,诱变菌株比原始菌多出了400万的读取数量;两株菌的Q30百分比分别为95.76%和95.59%;GC含量分别为62.01%和62.98%。由此可见,测序质量较高,能满足相应要求。

表1 WT和A1基因测序数据
2.4 基因功能注释
将转录本总共得到的基因与9个数据库进行比对,有79.13 %的基因至少被一个数据库所注释。在NR数据库中,大多数注释序列与Trichosporonoleaginosus和Yarrowialipolytica相近,相似序列分别有8 700、3 526个(图3)。可见,经过诱变之后菌株的部分基因发生了改变,使其能够大量积累胞内油脂。

图3 同源物种分类
2.5 差异基因分析
2.5.1 差异基因筛选
对转录组进行比较,初步将定义差异倍数为2倍以上并且q值≤0.005的基因,筛选为显著差异表达基因,结果如表2所示。由表2可知:菌株A1与WT相比,两个样品出现差异表达基因共1 185个,其中,上调表达 767个、下调418个,上调的基因数明显高于下调基因数。变化为2<差异倍数<4的基因为694个,占58.57 %,差异倍数变化为4~6的基因占17.13 %,差异倍数变化为6~8和16~18的基因都占8%以上。
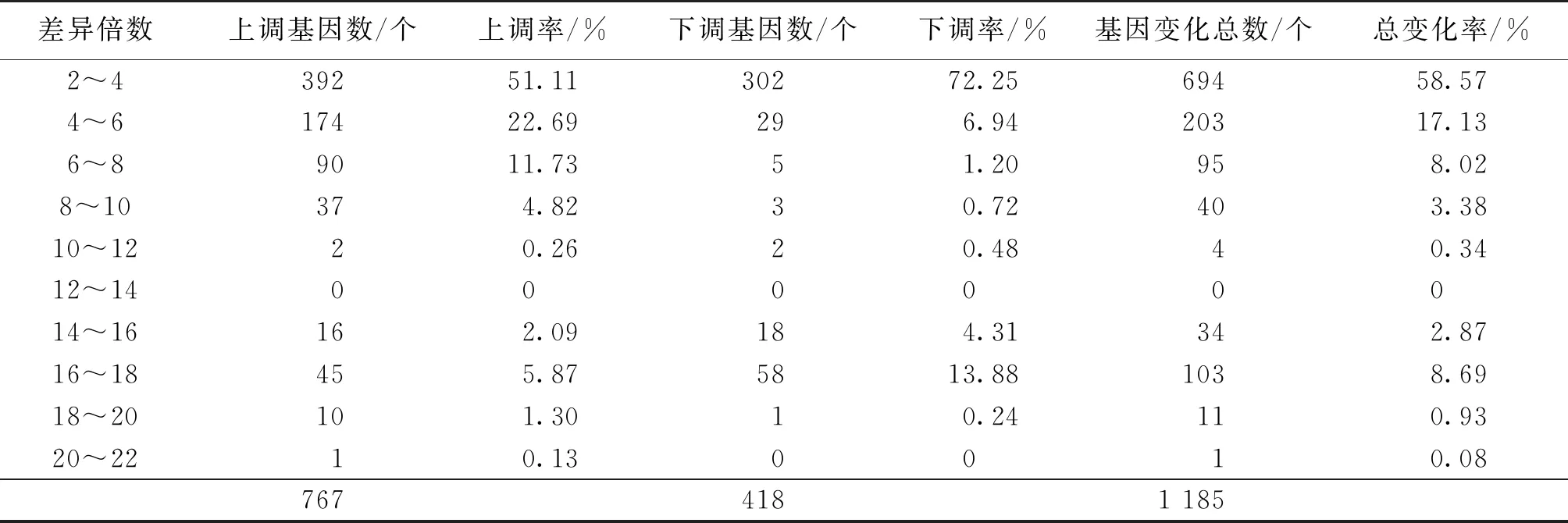
表2 显著性差异基因表达上下调数量
2.5.2 差异基因GO富集分析
对两个样品的显著差异基因进行GO富集分析,可以把差异基因分类到分子功能、细胞组分、生物过程3个方面。本次研究通过对差异表达基因进行GO分析,得到了差异基因GO富集图,结果见图4。
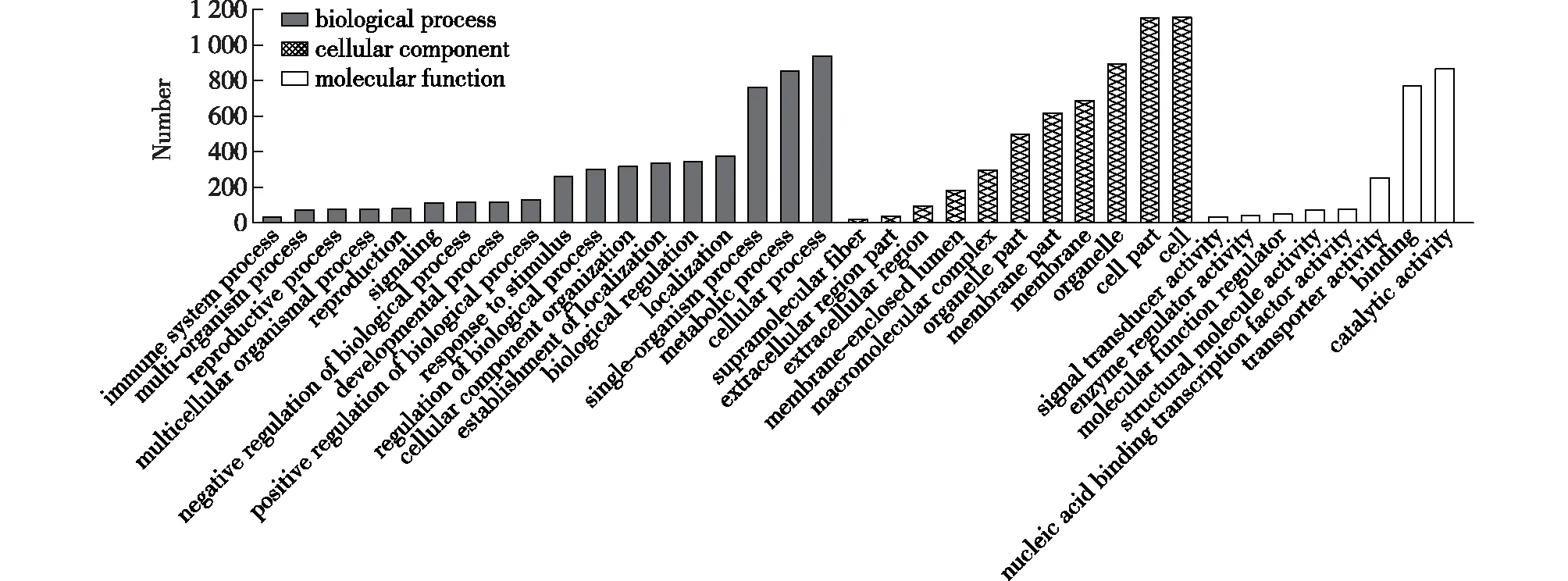
图4 差异表达基因的GO功能富集图
由图4可知:在挑选的富集最显著的37个GO term中,在生物学过程分类时细胞过程(cellular process)显著性基因数目最多,高达938个,其次为代谢过程(metabolic process)和单组织过程(single-organism process);在细胞组分中细胞(cell)、细胞部分(cell part)的差异基因数达到1 150个,其次为细胞器(organelle)和膜部分(membrane part);在分子功能中主要差异基因富集在催化活性(catalytic activity)和结合分子(binding)两个类别中。从GO富集情况可以看出诱变菌株A1的细胞部分与原始菌株有较大差异,从而使菌体的生长和细胞膜的通透性发生变化,进而影响菌体的催化活性,最后使菌体的代谢过程出现差异,使诱变菌株A1能更多地积累油脂。
2.5.3 差异基因KEEG富集分析
对差异基因进行KEEG富集分析可以更系统地了解差异基因产物的代谢途径和差异基因产物的功能。图5为差异基因的代谢通路富集情况,纵轴表示的是各通路(pathway)的信息,横轴(rich factor)表示该通路中的差异基因数与注释到该通路中的总基因数之比。q值的大小用点的颜色来表示,q值越小则颜色越接近红色,每个功能下包含的差异基因的多少用点的大小来表示。当rich factor值越大,q值颜色越接近红色,表示富集越明显。
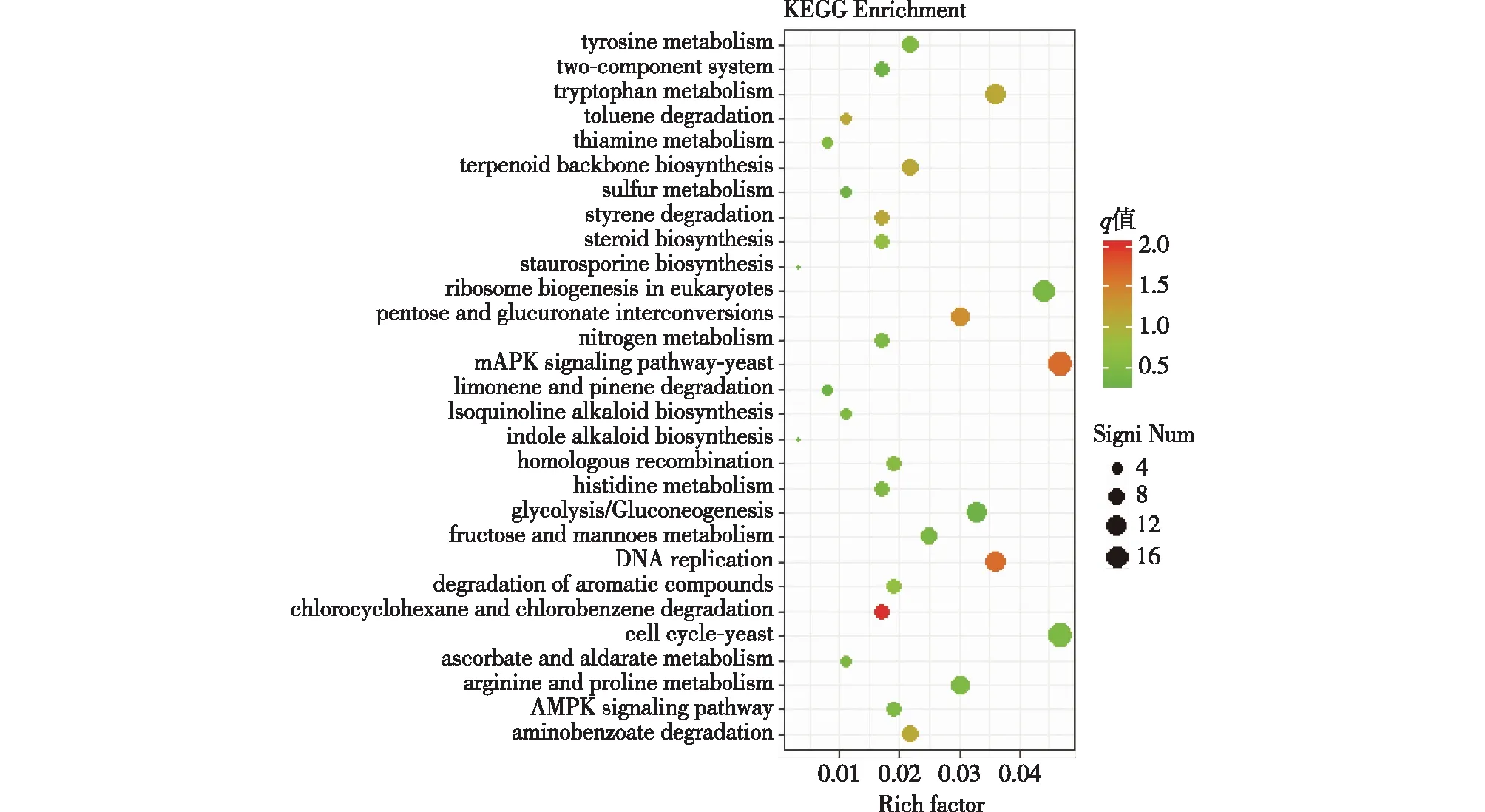
图5 差异表达基因KEGG代谢通路富集
由图5可知:两个样品的差异基因KEGG代谢通路中显著富集的通路有酵母细胞周期(cell cycle-yeast)、酵母MAPK信号通路(MAPK signaling pathway-yeast)、基因复制(DNA replication)、真核生物中的核糖体生物发生(ribosome biogenesis in eukaryotes)、色氨酸代谢(tryptophan metabolism)、戊糖和葡萄糖醛酸的相互转化(pentose and glucuronate interconversions)、糖酵解/糖异生(glycolysis/gluconeogenesis)等。
在代谢途径中,寻找与脂肪酸合成相关的上调差异基因,可为后期的分子育种和定点改造提供基础。从差异表达的基因中选取了3个基因,结果如表3所示。

表3 显著上调基因的功能和代谢通路
由表3可知:这些基因涉及三羧酸循环、糖酵解、甘油磷脂代谢、类固醇生物合成等;其中,在三羧酸循环中柠檬酸合成酶(CIS)相关基因过表达,CIS加强了乙酰-CoA和草酰乙酸的缩合反应[16],使产物柠檬酸的生成量增加[17],柠檬酸通过穿梭作用可以到达细胞质中,作为脂肪酸合成的原料。胡利华等[18]将CIS的基因导入籼稻中,籼稻可以耐受低磷土壤并分泌大量柠檬酸。童晋[19]研究油菜中的CIS对脂肪酸合成的影响时发现,在植物的脂肪酸合成过程中,CIS是重要的调控酶,该酶表达量的上升会造成脂肪酸合成量的增加,这与本研究的结果相一致。
在糖酵解途径中,3-磷酸甘油醛脱氢酶可以催化3-磷酸甘油醛氧化(脱氢)和磷酸化,生成1,3-二磷酸甘油酸,是糖代谢的中心环节,对糖代谢起着重要的作用[20-21],因为产生的1,3-二磷酸甘油酸是糖酵解途径中第一个产生ATP分子的底物,产生的ATP可以为后续反应提供能量,Vigeolas等[22]在油菜中表达了酵母菌中3-磷酸甘油醛脱氢酶的基因,甘油-3-磷酸脱氢酶活性提高1倍,最终的脂肪含量增加40%。甘油磷酸二酯磷酸二酯酶(GDPD)是磷脂代谢中的关键酶,可将甘油磷酸二酯水解为3-磷酸甘油和一些肌醇、胆碱等营养物质[23-24]。这将有利于酵母的生长和发育。
2.5.4 差异表达基因的逆转录PCR(RT-PCR)验证
对上述的3个相关基因进行RT-PCR验证,差异基因和内参基因的引物设计及序列如表4所示。RT-PCR的结果如图6所示。由图6可知:由于TRINITY_DN8489_c0_g1基因的差异性较小,经RT-PCR验证时出现较小差异,其他2个表达差异较大的基因,与反转录测序结果(表4)中基因的变化趋势基本一致。
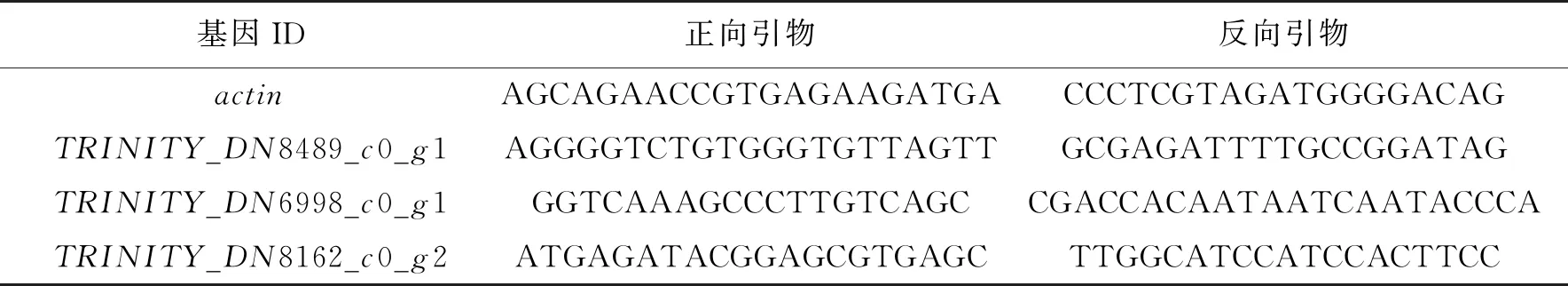
表4 RT-PCR验证基因及其引物
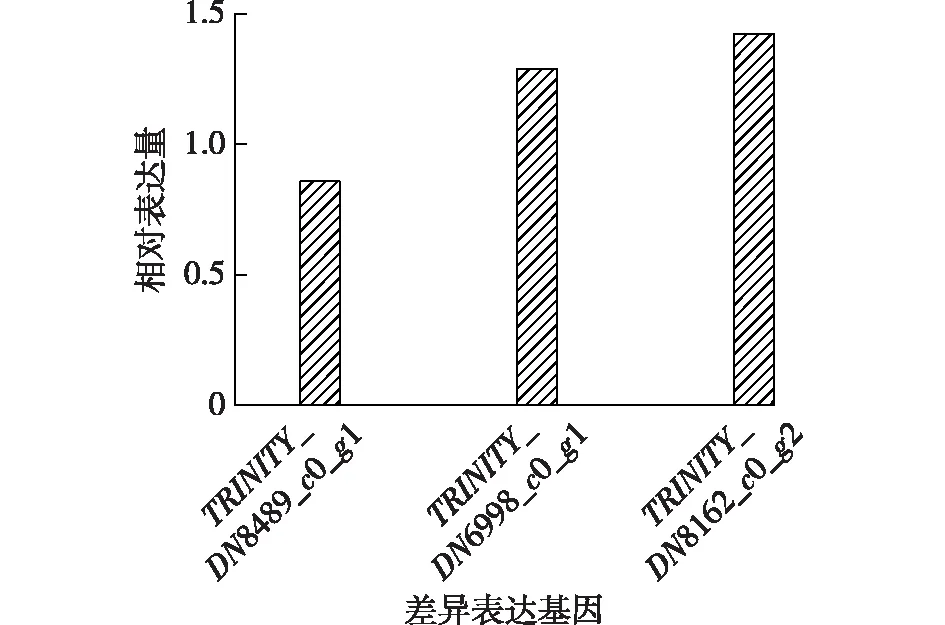
图6 差异表达基因的RT-PCR 验证结果
3 结论
经ARTP诱变处理的突变菌,在生物量、油脂产量分别提高了41.7%、103.1%,油脂含量达到了56.5%,通过对高产菌株进行转录组测序,能进一步帮助我们了解菌株的基因表达差异及代谢差异。
对菌株WT与A1进行转录组测序过滤后,筛选差异倍数为2倍以上并且q值≤0.001的基因为显著差异表达基因,菌株A1与WT相比,两个样品出现差异表达基因共1 185个,其中,上调表达 767个、下调418个,上调的基因数明显高于下调基因数。对差异基因进行GO富集分析,发现差异基因主要富集在细胞过程、代谢过程、细胞部分、催化活性;对差异基因进行KEGG富集分析,发现差异基因主要富集在酵母细胞周期、基因复制、戊糖和葡萄糖醛酸的相互转化、糖酵解/糖异生等。在代谢途径中选取了3个与脂肪酸合成相关的上调基因及对应的酶,RT-PCR验证发现这些酶参与微生物的能量循环和甘油磷脂代谢,可为脂肪酸的合成提供足够的底物(柠檬酸、草酰乙酸)和能量以及营养物质,这将有助于油脂酵母积累更多的油脂。以上发现可为后续的油脂酵母分子育种和定点改造提供理论基础。

