猕猴桃雌雄株分子标记的收集、评价与应用
张 坤,江欣瑶,王 琰,唐万佳,刘 瑶,梁 东,夏 惠*
(1.四川农业大学园艺学院,成都 611130;2.四川华胜农业股份有限公司,成都 618200)
猕猴桃属猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia Lindl.),属下有 66个种,118个变种及变型,是多年生落叶木质藤本果树,原产于中国,种群资源丰富,分布广泛,是我国主要栽培的优势种质[1]。猕猴桃属植物是雌雄异株[2],雌花虽是两性器官的完全花,但雄蕊败育不产生有活力的花粉,不被用做授粉树;雄花则由雌蕊败育而成,故不形成胚珠[3],且后代常出现雄性多于雌性的现象[4-6]。猕猴桃雌雄株早期在形态差异细小,常规手段不能识别,只能在开花后才可识别,而猕猴桃植株一般从播种至开花结果约需4年以上,大大延迟育种时间,且猕猴桃群落中雄株数量大于雌株[7]。但在生产中猕猴桃雌雄植株的合理搭配可提高产量,因此早期鉴定栽培苗的雌雄,可以为后续研究及育种节省大量的时间、人力和物力[8]。
近年来,已有多种分子标记技术被开发利用于猕猴桃种质资源以及生物学性状的鉴定[9]。DNA分子标记是不同生物基因组中某种特异性差异DNA序列的直观反映[10],它不受时空影响且在生物发育的不同阶段,因此可以应用于猕猴桃的早期性别鉴定。这些年,猕猴桃雌雄株鉴别的分子标记也在国内外相继开发。C.Harvey等[11]用BSA混合分离分析法对12株中华猕猴桃杂交群体混合组进行鉴定,发现2个与雌雄相关的性别标记,即雄性标记SmY1和雌性标记SmX。G.Gill等[12]进而将RAPD的SmX转化为更加稳定的特异引物SCARs,提高了鉴别准确率。姚春潮等[13]开发的2个雄性RAPD标记S1032850和S79750,并在美味猕猴桃、中华猕猴桃雌雄个体中进行验证,前者的鉴定准确率高于后者。柯辉鹏等[14]选取的4对引物分别对12株猕猴桃雌雄样品进行AFLP标记扩增,结果显示同一品种的雌雄个体间扩增出差异条带,表明在DNA水平上不同性别的多态性差异。李旭等[15]以软枣猕猴桃为材料进行SRAP分子标记,结果表明me2-em1、me6-em6、me7-em5和me7-em7这4对引物在软枣猕猴桃雌雄株间的扩增结果表现出多态性,有效的对其雌雄株进行分类。张琼等[16]以F1代(山梨猕猴桃与中华猕猴桃种间杂交)为材料,通过构建RAD-seq基因遗传图谱获得基因组多态性分析标记(SNPs),进而开发出A001、A002和A003这3个雌雄鉴定的SSR标记,能够有效鉴定猕猴桃雌雄。张璐生等[17]以中华猕猴桃为材料,通过对雄性和雌性群体的RAPD分析,筛选出4个与性别基因连锁的RAPD标记。通过进一步PCR扩增结果表明,引物OPA-9在雄性植株上都扩增出特异性条带(R4),而在雌性个体中仅有1株出现此带。通过前人在猕猴桃植株上对分子标记技术的运用,为本研究提供了可靠的参考。
虽然国内外开发的猕猴桃雌雄株分子标记众多。然而至今,国内外依旧未有对众多性别鉴定相关分子标记收集、利用及评价研究报道,且在国内猕猴桃育种实践应用还较少。究其原因是对众多雌雄株分子标记的适用范围,可操作性知之甚少。本研究旨在通过收集已开发的猕猴桃雌雄分子标记,并对比其适用性和可靠性,筛选出最适用于鉴别猕猴桃雌雄的分子标记,为猕猴桃早期选育工作节约时间。
1 材料和方法
1.1 植物材料
41株已知性别的猕猴桃雌雄株材料(表1)于2020年6月采自四川华胜农业股份有限公司九龙基地资源圃,选择无病害、5年生以上植株,取其一年生枝上的幼嫩叶片,及本实验室繁殖10株当年生实生苗。采摘后立即经液氮速冻后带回,放入-80℃超低温冰箱中保存待用。
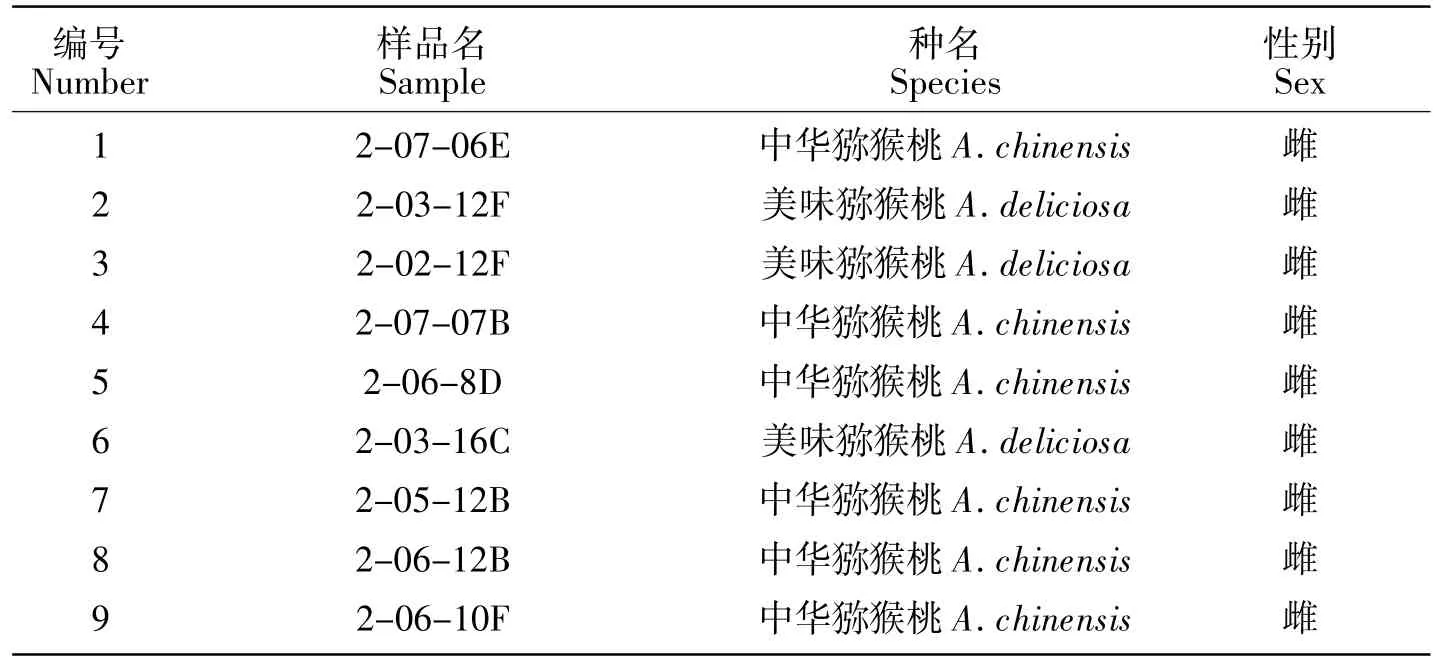
表1 本研究中使用的猕猴桃雌雄株材料Table 1 Male and female kiwifruit samples used in this study

(续表1)
1.2 猕猴桃性别分子标记收集
经前人研究,共收集到猕猴桃性别相关分子标记5个,信息见表2,其中SCAR标记2个,SNP标记2个,RAPD标记1个,预计产物大小在304~950 bp。
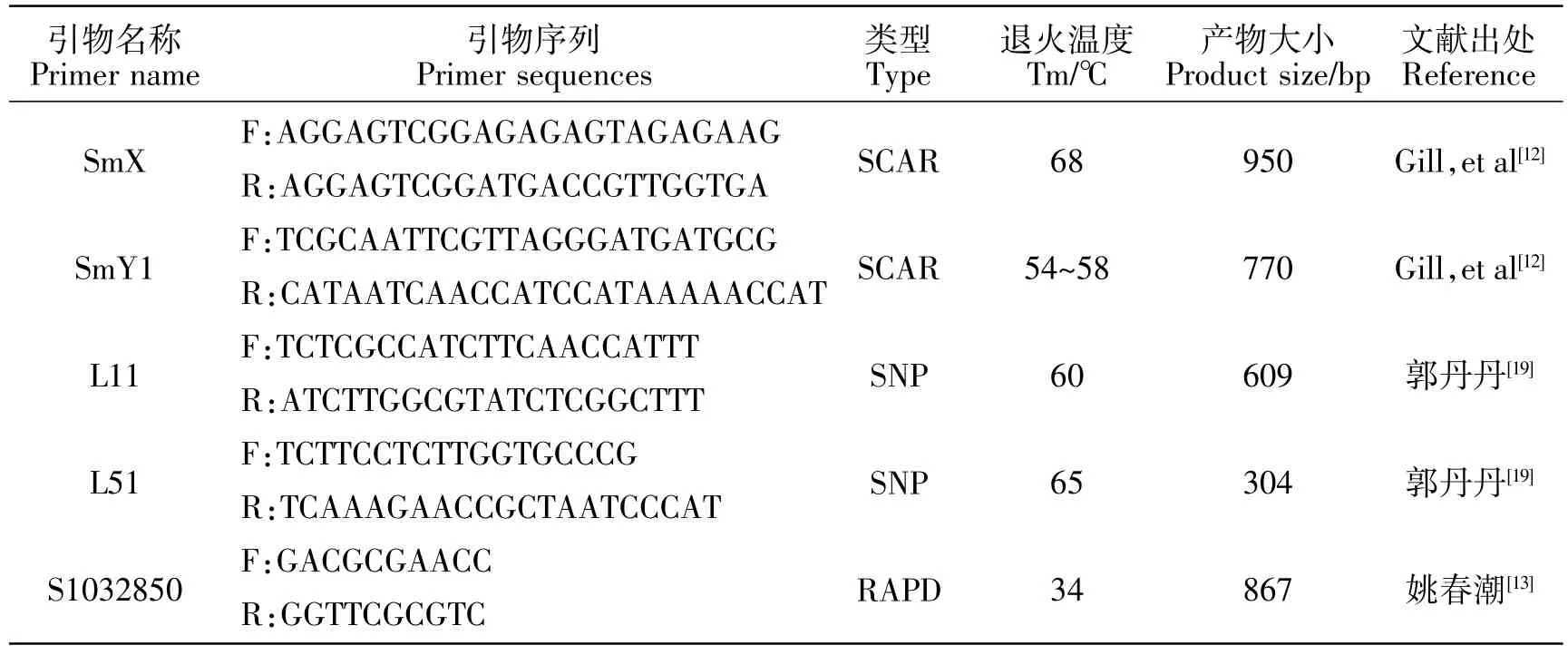
表2 收集的猕猴桃雌雄标记信息Table 2 Collected male and female marker information of Actinidia
1.3 DNA提取
通过改良的CTAB方法提取猕猴桃雌雄植物的基因组DNA[18],并在1.0%琼脂凝胶电泳检测DNA的完整性。用紫外分光光度计测定其在260和280 nm波长处的OD值,以检测其纯度和浓度,并将其稀释成浓度为20~30 ng/μL的工作液,保存于-80℃超低温冰箱备用。
1.4 PCR扩增体系
使用20 uL反应体系,正、反向引物各400 nmol/L,10 μL X Taq Master Mix(北京康为世纪生物科技有限公司),20 ng DNA模板。
参考G.Gill等[12]SCAR标记扩增的方法,参考郭丹丹等[19]SNP标记扩增的方法,参考姚春潮等[13]RAPD标记扩增的方法,并均略加改动。SCAR/SNPPCR和RAPD-PCR扩增程序见表3。PCR扩增产物采用1.5%琼脂糖凝胶电泳、1×TAE缓冲液、电泳的电压为100 V/40 min中检测,以每个标记所对应的产物中条带清晰、长度大致合适为检测标准。

表3 SCAR/SNP-PCR和RAPD-PCR的扩增程序Table 3 Amplification procedures of SCAR/SNP-PCR and RAPD-PCR
1.5 猕猴桃雄性基因特异标记片段序列分析
选取扩增效果好、条带单一的SmY1特异性回收产物,并送到成都擎科梓熙生物技术有限公司进行双向测序。测序结果在NCBI中BLAST(http://www.ncbi.nlm.nih.gov/BLAST)在线进行同源搜索,使用DNAstar软件中MegAlign进行序列比对验证[20]。
1.6 数据处理与分析
统计电泳图谱中清晰条带,保留稳定可见的弱带,忽略不稳定的条带,计算雌、雄性别的特异性条带数,样品间同一位点上的迁移条带记为“+”,无则记为“-”。每个猕猴桃雌雄植株的鉴定准确率计算方法为:鉴定正确的样品数/样品总数×100%=鉴定准确率。
2 结果与分析
2.1 DNA的提取
提取41份已知猕猴桃性别及10株实生苗基因组DNA,部分DNA提取质量如下所示(图1),泳道无拖尾,表明DNA完整,且浓度都在20 ng/μL以上,可用于PCR模板。
图1 部分样品DNA电泳图Figure 1 DNA electrophoresis of some samples
2.2 SmY1和SmX标记扩增体系的建立及通用性验证
分别对SmY1和SmX标记在12份猕猴桃雌雄样品进行的体系优化试验,结果表明猕猴桃雌雄样品中SmY1和SmX标记扩增的最适退火温度分别为58.2℃和61℃。SmX标记和SmY1标记在部分猕猴桃基因组DNA中的扩增结果表明(图2),在6份雌性样品中,编号为2号和6号试材能扩增出特异性条带;在6份雄性样品中,22号、24号和25号试材扩增出特异性材料,且与预期标记条带位置一致。所以SmX标记多态性表现差,没有性别特异性,而与前人研究表明SmX是雌性特异标记[11],仅出现在雌性样品中的结果不一致。因此SmX标记不能广泛应用于猕猴桃性别鉴定。SmY1扩增结果显示,6份雌性样品未能扩增出雄性标记SmY1条带;而在6份雄性样品全部扩增出特异性条带,且与预期标记条带位置一致,鉴别准确率为100%,与前人报道SmY1为雄性特异标记结果一致[11]。可用于猕猴桃性别鉴定,但仍需要继续扩大样本验证。
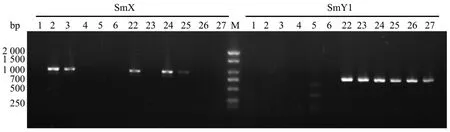
图2 部分样品SmX和SmY1标记扩增图谱Figure 2 Amplification maps of SmX and SmY1 in some samples
2.3 L11和L51标记扩增体系的建立及通用性验证
分别对L11和L51标记在12份猕猴桃样品进行体系优化试验及验证。结果表明L11标记在12份试材都未扩增特异性,而L51标记仅在22号品种扩增出特异性条带(图3),与前人研究结果不一致[19]。因此L11和L51标记都无法广泛用于雌雄株鉴定。

图3 部分样品L11和L51标记扩增图谱Figure 3 Amplification map of L11 and L51 in some samples
2.4 S1032850标记扩增体系的建立及通用性验证
通过在S1032850标记中的验证表明(图4),4份雌性植株均未能够扩增出目的条带;4份雄性样品中,虽扩增出多态性条带,但与目标条带大小不一致。这也与原报道中S1032850为雄性特异标记结果不符[13],但本研究中其它特异性条带微弱,后期可以通过调整体系等进行优化。也进而表明该标记不能广泛应用于雌雄鉴定。
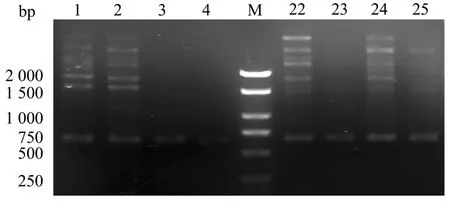
图4 部分样品S1032850标记扩增图谱Figure 4 Amplification map of S1032850 in some samples
2.5 SmY1特异扩增序列比对
使用NCBI数据库对SmY1回收产物的测序结果进行Blast比对分析,其结果表明扩增序列与登录号为AY336259.1的序列相似性最高,而AY336259.1是与性别相关的RAPD标记片段。为了进一步验证,将两条序列分进行比对分析(图5),结果显示序列的相似性为82.39%,因此,SmY1标记可广泛地应用于猕猴桃雌雄性别鉴定。

图5 SmY1标记产物序列与相似序列比对结果Figure 5 SmY1 labeled product sequence and similar sequence alignment results
2.6 SmY1标记在剩余样本的进一步验证
对剩余的猕猴桃样品进行SmY1标记(图6),PCR扩增结果表明21份雌性样品在SmY1标记中均未扩增出雄性特异性条带;而在20份雄性样品中,17份材料扩增出SmY1标记条带,且与预期产物大小一致。
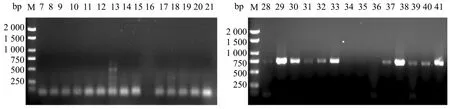
图6 SmY1标记在部分猕猴桃的扩增图谱Figure 6 Amplification map of SmY1 label in some kiwifruit
由表4可知,SmY1标记对21个雌性样品的鉴定准确率为100%,而在对20个雄性个体检测中,仅有3个样品未出现特异条带,雄性鉴定结果准确率为85%。
2.7 应用SmY1标记对实生幼苗鉴定
将SmY1标记应用到实生幼苗的鉴定,鉴定结果见表5,结果表明在10份实生苗样品中,能够扩增出特异性条带的材料仅有3份,进而表明SmY1标记在实生幼苗中能扩增出稳定的条带,可应用于实生苗的鉴定,但其鉴定结果还须下一步进行田间调查来验证该标记鉴定的准确性。
3 讨论与结论
近年来,分子标记技术被广泛应用于种质资源分析,也被应用于植物的早期性别鉴定,有利于开展植物性别鉴定工作。特别是在传统方法应用于性别鉴定受到一定限制时,研究者往往会运用生物技术等分子方法来鉴定植物雌雄性别。R.W.Michelmore等[21]根据混合分组分析法(BSA)的基因标记定位,与分子标记技术相结合,获得与雌雄异株植物性别相关的连锁标记;姚春潮等[13]将RAPD标记S1032850在中华和美味猕猴桃原变种雄株中进行验证,其可鉴定部分中华系雄株个体。但在本研究中,存在由于条带微弱;鉴定效果不明显的现象,这可能是由于该标记为转化成稳定的SCAR标记的原因。L.G.Fraser等[22]在将雄性性别标记SmY1定位在了染色体性别决定区域[23],通过对SmY1特异性条带的扩增回收比对,SmY1对性别具有特异性,表明其是雄性连锁标记。郭丹丹[19]利用SmX、SmY1对软枣猕猴桃的验证,表明SmX未表现出雌雄特异性,虽SmY1在软枣猕猴桃中能够扩增出多态性条带,但未表现出雌雄特异性。但在本研究中发现SmY1标记对中华猕猴桃鉴定准确率高,更具鉴定可靠性,而SmY1对其他种的鉴定准确率仍不稳定,还需大量样本验证。此外,还对郭丹丹[19]经全基因组重测序筛选得到2个性别特异序列标记,即L11和L51,但本研究中华猕猴桃和美味猕猴桃都未扩增出特异性条带,与原研究在中华猕猴桃通用性好结果相反。这可能是由于该性别标记是经SNP变异位点[24]筛选而成,而常规琼脂糖电泳可能无法扩增出特异性条带,还需改进PCR扩增体系以及扩大软枣猕猴桃种质进行验证。SmY1能在实生幼苗扩增出特异性条带,后期可结合田间调查以验证鉴定的准确率,以此将该标记应用于猕猴桃实生幼苗的鉴定。
本研究通过对 SmX、SmY1、S1032850、P11和P51的初步筛选对比发现:SmX和S1032850标记所扩增的条带未表现雌雄特异性,准确率很低,后期可以通过调整体系、筛选最适退火温度等进行优化;L11、L51未扩增出条带,无法用于雌雄株鉴定;而利用SmY1对41份已知性别的猕猴桃材料的通用性进行了检验。结果表明SmY1表现出良好的性别特异性,雄性植株性别鉴定准确率85%,雌性为100%,可在生产实践中应用于中华猕猴桃雌雄的早期鉴定,减少人力、物力和选育成本的开支,也对后续性别标记的开发提供参考依据。

