川西高山针叶林土壤酶活性对凋落物去除的响应
焦泽彬,陈子豪,刘 谣,谭 波,李 晗,游成铭,王丽霞,刘思凝,徐振锋,张 丽
(长江上游林业生态工程四川省重点实验室/长江上游森林资源保育与生态安全国家林业和草原局重点实验室/高山森林生态系统定位研究站/四川农业大学生态林业研究所,成都 611130))
土壤酶主要由微生物和植物产生,可以有效促进有机质的分解,在土壤碳、氮、磷等元素循环中发挥重要作用[1]。土壤微生物通过胞外酶将养分由有机态转变为无机态,改变土壤的养分有效性[2]。目前研究通常将各相关土壤酶之间的比值与养分元素相联系,以此来评价微生物的相对养分限制,继而提出酶化学计量理论。R.L.Sinsabaugh等[3]研究发现,在全球尺度上,土壤C、N、P酶化学计量比总体上呈1∶1∶1的关系,该理论揭示了土壤微生物养分需求与土壤养分有效性之间生物地球化学平衡模式,并作为检测及评价微生物代谢及生态系统养分限制的有效工具而成为目前研究热点之一。土壤酶活性及其计量比不仅受到土壤水热条件和pH等环境因子的影响[4],同时还与凋落物的降解及其对土壤的养分归还直接相关[5]。森林凋落物是土壤有机质的主要来源,可有效维护土壤生态功能的发挥[6]。大量研究证实,自然或人为驱动控制凋落物输入与分解变化能深刻影响森林生态系统地下生态功能[7]。如付淑月等[8]指出黄土丘陵区地上凋落物去除使得土壤有机碳含量显著增加,但也有研究表明添加凋落物后土壤有机碳没有发生变化[9]。此外,王俊龙等[10]通过研究表明,凋落物对于不同土壤酶活性有着不同的促进或抑制作用;P.S.Kourtev等[6]也指出凋落物的组成和性质是影响酶活性的主要因素。但由于不同区域不同的地理条件,土壤酶活性及其计量比对凋落物的响应结果也不同,主要受到生态系统、微生物组成和土壤养分等生物及非生物因素的影响[9]。因而,研究高山地区森林生态系统凋落物与土壤酶活性及其计量比之间的相关关系,对于探究森林物质循环过程有重要的指示作用。
川西高山森林位于长江上游和青藏高原东缘,特殊的地理位置使得其在水源涵养、调节气候和生物多样性保育等方面具有十分重要的作用和地位[11]。同时,由于受长期的低温和频繁的地质灾害影响,该区森林土壤具有土层浅薄和凋落物分解缓慢的特点[12],因而其相应生态过程也受到普遍的关注。目前已有的研究更加注重氮沉降[13]、凋落物产量[14]和凋落物养分归还[15]等,而关于该地区凋落物对土壤酶活性以及养分限制的影响机制尚不清楚。因此,本文以川西高山四川红杉-岷江冷杉针叶林为对象,通过凋落物去除控制实验,研究了森林土壤C、N、P分解相关酶活性及其化学计量比对凋落物去除的响应,以期为了解该地区森林土壤生态过程及相应经营管理提供一定的理论依据。
1 材料和方法
1.1 研究区概况
研究区域位于四川省阿坝藏族羌族自治州理县毕棚沟四川农业大学高山森林生态系统定位研究站(102.88°E~102.95°E,31.23°N~31.32°N,海拔2 458~4 619 m),该区域地处中亚热带季风气候向大陆性高原气候过渡地区,由于其独特的高原地形,气候冬寒夏凉,常年干燥。年降水量约850 mm,降水主要集中在5—8月,气温变化剧烈,年均气温为2~4℃,最高气温在7月(23℃),最低气温在1月(-18℃)。由于冬季气温较低,每年11月至次年4月为降雪期,12月下旬至次年3月为雪被完全覆盖期,4月开始气温回暖,雪被开始融化。该区域以四川红杉(Larix mastersiana)、岷江冷杉(Abies faxoniana)和川西云杉(Picea likiangensis)为主要建群种,林下灌木主要有康定柳(Salix paraplesia)、高山杜鹃(Rhododendron lapponicun)和沙棘(Hioopphae rhamnoides)等[16]。
1.2 样地设置
在研究区域内选取四川红杉-岷江冷杉原始林(海拔3 589 m)作为研究样地开展相关实验。2018年9月,在该样地内选取坡度、坡位及坡向等相似的10 m×10 m的样方3个。在每个样方内安装60个内径20 cm、高15cm的PVC环,相邻PVC环间距0.50 m,嵌入土壤深度为10 cm。其中30个PVC环用可透水透气但避免凋落物输入的圆形尼龙遮盖网(网孔为2 mm)遮盖,用以去除凋落物;另外30个PVC环未做遮盖处理,作为凋落物自然输入。
分别于凋落物去除1 a(2019年9月下旬)和2 a(2020年9月下旬)进行土样采集。每次采集样方内凋落物自然输入及去除凋落物的完整PVC环各3个,共计18个(3样方×3重复×2处理),用4℃ 冰盒保存并立即运回实验室。剔除土壤中的石块、动植物残体、根系及凋落物等后过2 mm筛,并将土样分为两部分,其中一部分进行风干用于土壤理化性质的测定,另一部分保存鲜样并用于测定土壤含水量及土壤酶活性。
1.3 土壤指标测定
采用埋设纽扣式温度计(DS1921G)记录土壤温度,频率为每3 h记录一次;土壤pH用去CO2的蒸馏水(土水比为1∶2.5)浸提10 g风干土样后,用pH仪(PHS-25CW)直接测定;称取10 g新鲜土样在105℃下烘至恒重测定土壤含水量(SWC);土壤全碳(TC)采用高温外热重铬酸钾氧化法、全氮(TN)采用凯氏定氮法、全磷(TP)含量的测定采用钼锑钪比色法;铵态氮(NH4+-N)采用靛酚蓝比色法,硝态氮(NO3--N)采用双波长法进行测定(表1)[17],参照陈子豪等的酶标版法测定与土壤C、N、P分解相关的7 种酶活性[18-19]。
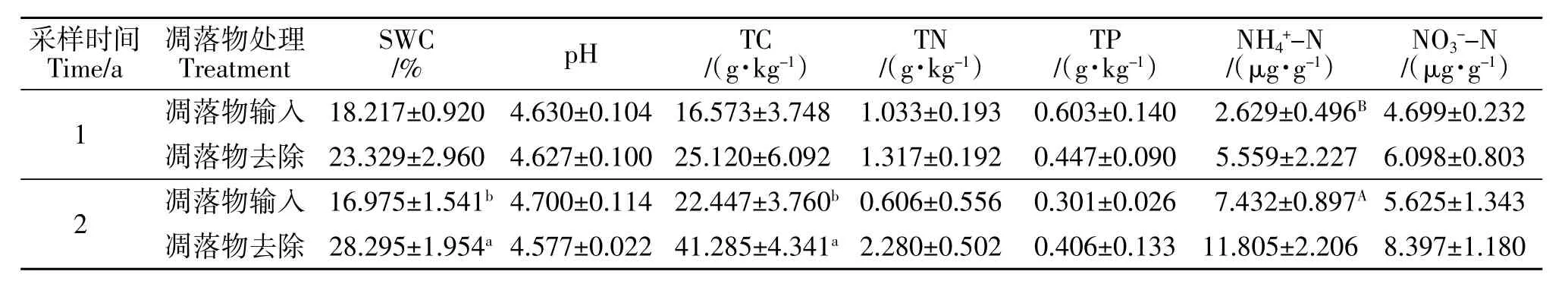
表1 土壤理化因子对凋落物去除的响应Table 1 Response of soil physical and chemical factors to litter removal
1.4 数据处理与统计分析
运用 SPSS 20.0(IBM SPSS Statistics,Chicago,IL,USA)软件进行统计分析。利用独立样本t检验(Independent-samples t test)分析相同时期不同凋落物处理及相同凋落物处理不同时期土壤酶活性的差异,显著性水平设为P=0.05;利用双因素(Twoway ANOVA)方差分析检验凋落物去除、采样时间及二者交互作用对土壤酶活性及化学计量比的影响;采用Pearson相关分析土壤酶活性及化学计量比与土壤理化性质之间的关系;并使用Origin Pro 2018(OriginLab,Northampton,MA,USA)软件进行绘图。
酶化学计量表示如下[20]:
(1)C ∶NEEA=lnBG/ln(LAP+NAG)
(2)C∶PEEA=lnBG/lnAP
(3)N ∶PEEA=ln(LAP+NAG)/lnAP
(4)Vector L={[lnBG/ln(NAG+LAP)]2+(lnBG/lnAP)2}1/2
(5)Vector A=Degrees{ATAN2[lnBG/lnAP,lnBG/ln(NAG+LAP)]}
其中 C ∶NEEA,C ∶PEEA,N ∶PEEA分别表示土壤酶化学计量碳氮比、碳磷比以及氮磷比,VectorL越长表示微生物相对养分碳限制越大,VectorA<45°表示微生物相对氮限制的程度,VectorA>45°表示微生物相对磷限制的程度[3]。
2 结果与分析
2.1 土壤酶活性对凋落物去除的响应
凋落物去除仅在采样第一年显著降低了多酚氧化酶的活性(降低了36.90%),而在采样第二年显著增加了纤维二糖水解酶和亮氨酸氨基肽酶的活性(图1)。采样时间显著影响了土壤酶活性(图1,表2)。在凋落物自然输入处理中,与采样第一年相比,采样第二年的酸性磷酸酶、纤维二糖水解酶和多酚氧化酶活性显著降低(分别降低了89.60%、82.52%和 81.48%),而 β-葡萄糖苷酶和过氧化物酶活性则显著升高。在凋落物去除处理下,与采样第一年相比,凋落物去除两年时酸性磷酸酶活性显著降低(降低了88.91%),而纤维二糖水解酶活性显著提高。总的来说,该区域内针叶林凋落物去除对不同土壤酶活性的影响具有差异。
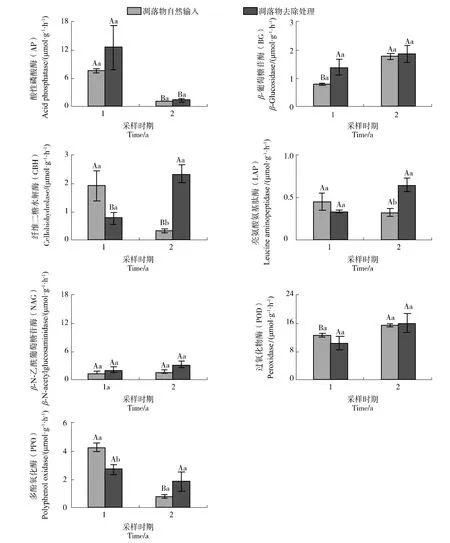
图1 土壤酶活性对凋落物去除的响应Figure 1 Response of soil enzyme activity to litter removal
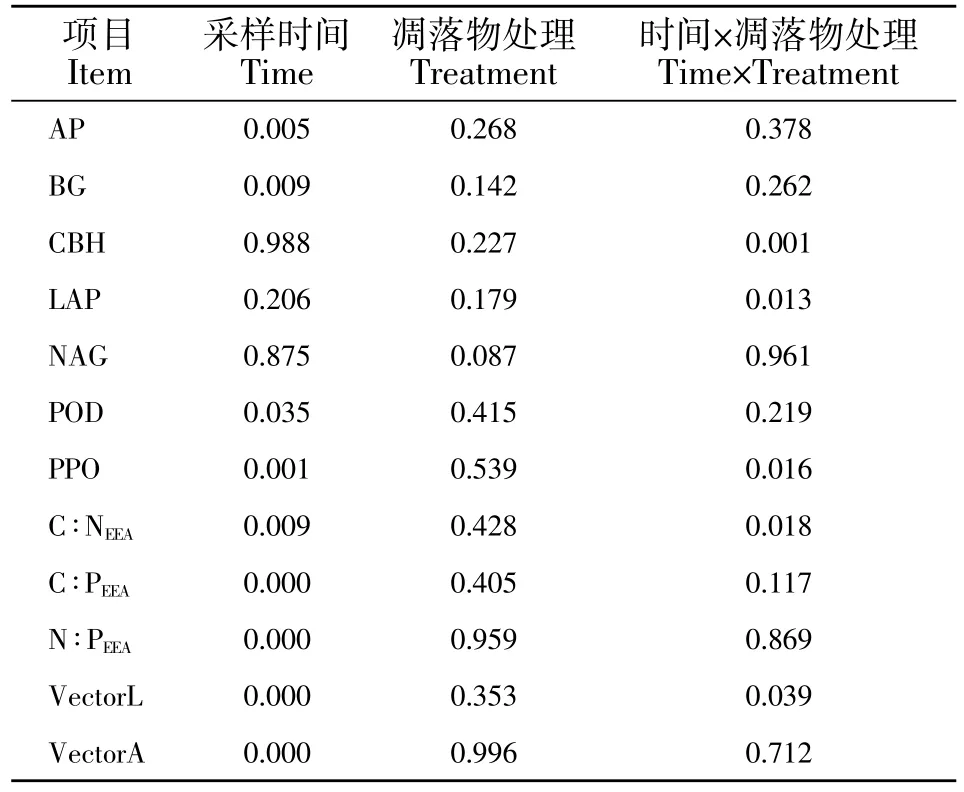
表2 采样时间和凋落物处理及其交互作用对土壤酶活性及其计量比的双因素方差分析Table 2 Two-way ANOVA of Time,Litter and their interaction on soil enzyme activity and its stoichiometric ratio
2.2 土壤酶化学计量比对凋落物去除的响应
凋落物去除对土壤酶化学计量比的影响较小(图2,表2),仅在采样第一年显著增加了C∶PEEA。而采样时间对土壤酶化学计量比的影响较大(图2,表2),其中,在凋落物自然输入处理中,采样第二年土壤 C∶NEEA、C∶PEEA和 N∶PEEA均显著提高;而在凋落物去除处理中,采样第二年N∶PEEA也显著提高。同时,本研究中C∶NEEA及1 a时期的C∶PEEA低于全
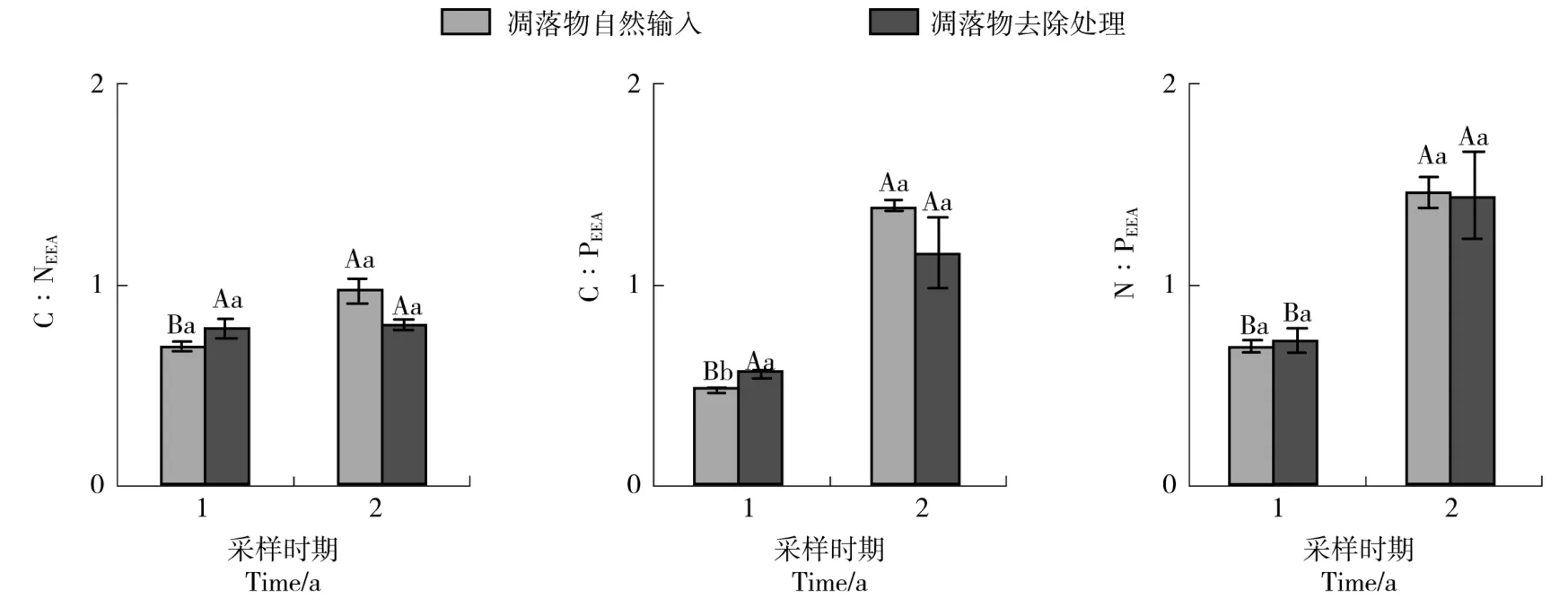
图2 土壤酶化学计量比对凋落物去除的响应Figure 2 Response of soil enzyme stoichiometry to litter removal
球平均值(1.41、0.62),N∶PEEA及 2 a时期的 C∶PEEA均高于全球平均值(0.44、0.62),表明该地区N转化酶活性相对较高,C、P转化酶活性相对较低。
微生物相对养分限制对凋落物去除的响应较小,仅在采样第一年显著增加了微生物相对养分碳限制(图3,表2)。采样时间对土壤微生物相对养分限制有显著影响,与采样一年时期相比,采样第二年微生物相对养分C、N限制增加,而减少了微生物相对养分P限制。

图3 微生物相对养分限制对凋落物去除的响应Figure 3 Response of microbial relative nutrient limitation to removal
2.3 土壤酶活性及其计量比的影响因素
相关性及逐步回归分析结果显示,β-葡萄糖苷酶活性与土壤含水量、土壤C含量以及土壤铵态氮含量呈显著正相关,其中铵态氮含量对β-葡萄糖苷酶活性变异的解释量为79.6%(表3、表4)。亮氨酸氨基肽酶活性与土壤含水量、土壤N含量、土壤铵态氮以及硝态氮含量呈显著正相关,其中土壤含水量对亮氨酸氨基肽酶活性变异的解释量为 42%(表3、表4)。β-N-乙酰葡萄糖苷酶活性与土壤含水量、土壤C、N含量呈显著正相关关系,其中土壤C含量对β-N-乙酰葡萄糖苷酶活性变异的解释量为 67.3%(表3、表4)。C∶NEEA与 C∶N 呈显著正相关关系;C ∶PEEA、N ∶PEEA分别与土壤 C ∶P以及土壤铵态氮含量呈显著正相关关系;而VectorA则与土壤C∶P以及土壤铵态氮含量呈显著负相关(表3)。
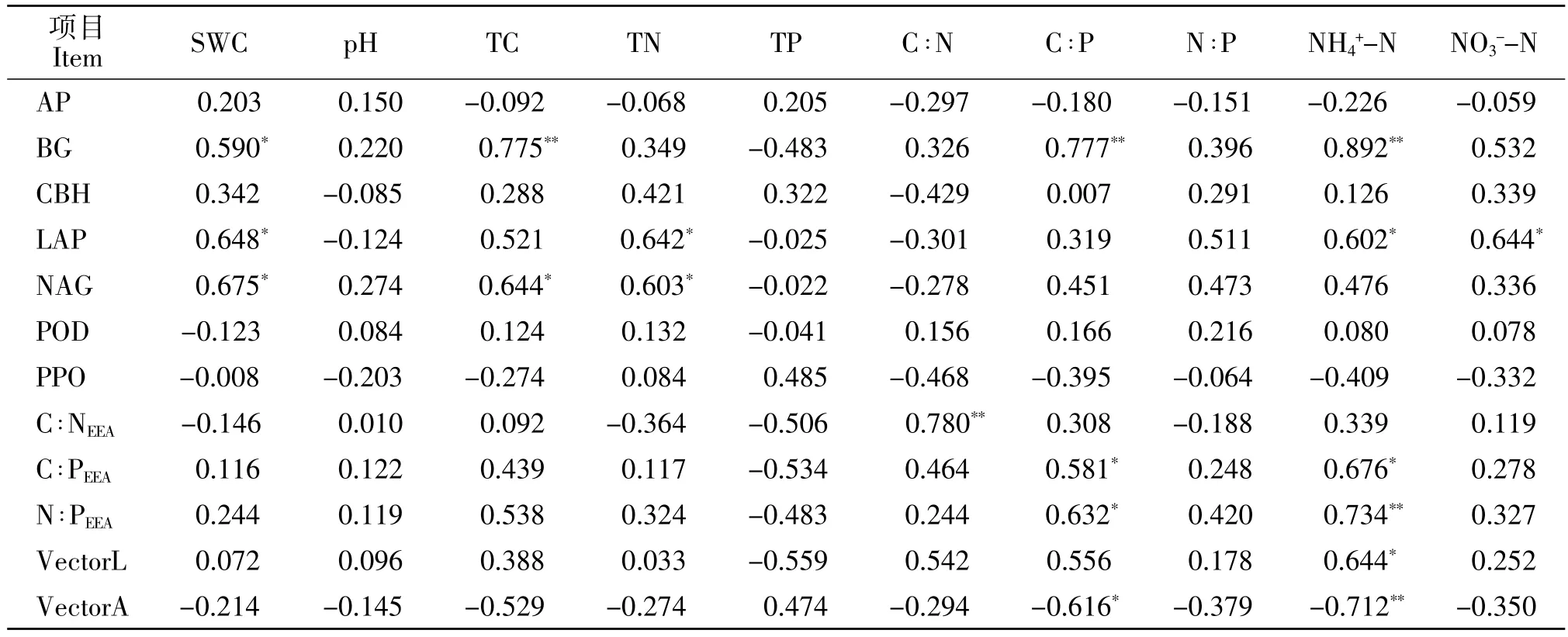
表3 土壤酶活性及其化学计量比与土壤理化因子的相关关系Table 3 Correlation between soil enzyme and its stoichiometric ratio and soil physical and chemical factors
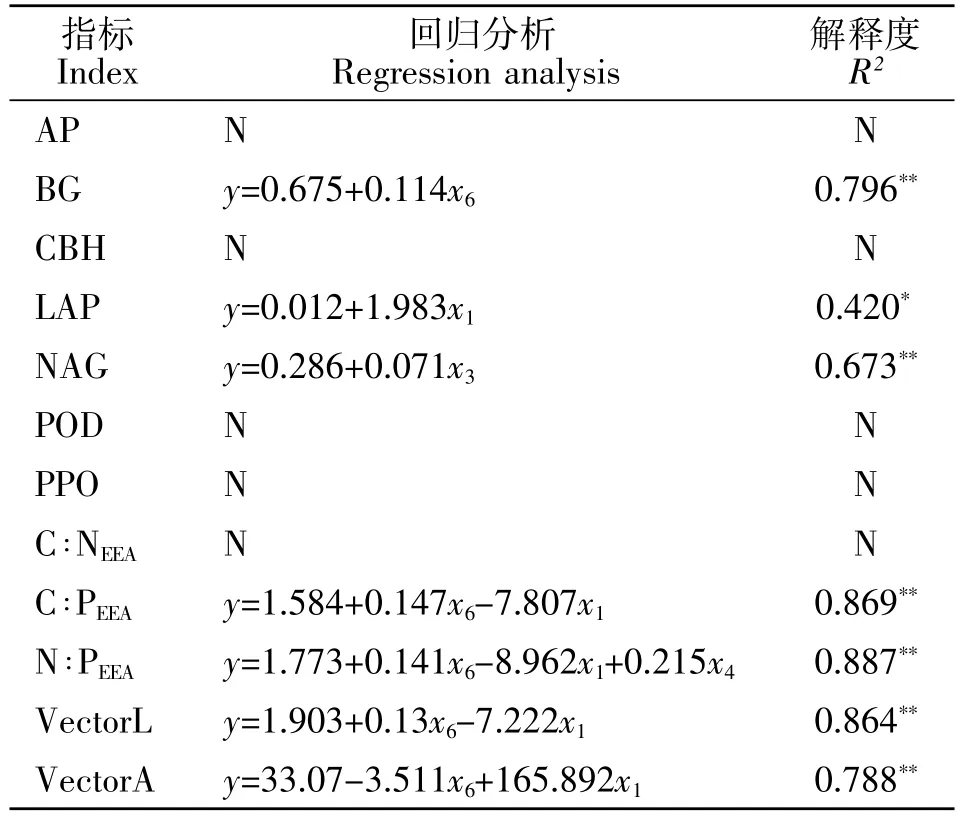
表4 土壤酶活性及其计量比、土壤理化因子的回归分析Table 4 Regression analysis of soil enzyme activity and its measurement ratio,soil physical and chemical factors
3 讨论与结论
3.1 土壤酶活性对凋落物去除的响应
作为与土壤C、N分解相关的土壤酶,纤维二糖水解酶与亮氨酸氨基肽酶对凋落物去除及去除时间的交互作用产生显著响应,且二者均在凋落物处理两年时期表现出凋落物去除显著大于凋落物自然输入处理,表明该区域C、N分解相关酶活性对凋落物去除的响应较为迟缓。四川红杉-岷江冷杉为该地区较为典型的针叶林,凋落叶的C/N较大,分解较慢,经过一段时间的分解后,组织结构发生变化,难降解物质逐步转化为易降解物质[21],使得后期不同处理土壤的养分含量产生差异,因而酶活性在凋落物处理两年时期的差异较大。酸性磷酸酶作为与磷转化相关的土壤酶,能很好地反映土壤磷素的转化与需求。本研究中酸性磷酸酶受采样时间的显著影响,且在采样第二年显著降低。由于土壤酸性磷酸酶与有效磷呈负相关[22],说明该地区土壤有效磷含量可能逐渐增加。此外,凋落物去除一年时多酚氧化酶活性显著降低,且多酚氧化酶和过氧化物酶对凋落物去除时间的响应不同。土壤多酚氧化酶和过氧化物酶都属于氧化还原酶,二者与土壤腐殖化程度相关[23]。由于无新鲜凋落物的输入,腐殖质的合成受限,因而凋落物去除一年时多酚氧化酶活性显著降低。随着地下生态过程的进行,凋落物去除与自然输入之间腐殖质含量出现差异。同时,随着凋落物去除时间的增加,土壤微环境发生变化,土壤微生物生物量、区系组成以及代谢过程等发生改变,从而使得土壤微生物产生的土壤酶数量及活性发生变化[24],导致不同土壤酶对不同凋落物去除时期产生的响应不同。
3.2 土壤酶化学计量比对凋落物去除的响应
生态酶化学计量可以反映微生物相对养分的需求状况[25]。根据生态经济学最佳配置原则[26],微生物会把更多目标集中在所缺乏的资源上,而该地区的N转化酶活性较高,反映出该区域N元素缺乏。这与前人在川西高山森林生态系统研究结果一致[13,27]。一般情况下,凋落物的质和量会改变森林土壤的养分状况,微生物会通过调节土壤生态酶化学计量来调控对自身生长的养分利用[28]。根据前人研究,该地区9—10月为针叶林凋落物高峰期[14],由于无新鲜有机质的输入,导致凋落物去除一年后微生物相对养分碳限制差异显著。同时,微生物相对养分限制也表明在该区域生态系统发育过程中,P限制逐渐减小,有效磷含量逐渐增加,且该区域逐渐由磷限制向氮限制转变,促进了该生态系统的氮循环。
3.3 土壤酶及其化学计量比的影响因素
土壤酶作用的发挥通常受限于各种环境因子[29]。相关性分析显示土壤含水量、全C、全N及有效氮与土壤C、N分解酶活性显著相关(表3)。有研究表明,降水的增加会导致β-N-乙酰葡萄糖苷酶等酶活性增加[30]。同时,微生物对于有机质的利用具有一定的选择性,更倾向于利用易分解的有机质,导致土壤碳氮含量变化成为影响土壤酶活性的重要因素[31]。此外,土壤铵态氮含量与土壤酶化学计量比的相关性较高,土壤铵态氮含量可被认为是该地区针叶林中影响土壤养分限制的主要因子。
综上所述,川西高山地区C、N、P分解相关土壤酶活性对于凋落物去除的响应不显著,但会受到凋落物去除时间及二者交互作用的综合影响,土壤C、N分解相关酶活性对凋落物的影响较为迟缓。土壤含水量及C、N含量是影响土壤C、N分解酶随不同时期及凋落物处理产生差异的主要因素。生态酶化学计量指出川西高山针叶林处于微生物代谢相对P限制减小而N限制增加的区域。森林凋落物作为森林生态系统的重要组成部分,其分解是土壤有机质的重要输入源,并对土壤生态过程具有一定的调控作用,关于该区域凋落物去除实验还有待进行进一步长期研究。

