PEG修饰的紫草素纳米结构脂质载体的制备和体外评价
秦欢 ,张兵 ,马喆 ,张瀛 ,张钰坤 ,刘志东
(1.天津中医药大学组分中药国家重点实验室,天津 301617;2.天津中医药大学现代中药发现与制剂技术教育部工程研究中心,天津 301617;3.徐州工程学院食品与生物工程学院,徐州 221008)
乳腺癌已成为全球女性发病率最高的恶性肿瘤,严重影响了女性的身心健康[1-3]。临床治疗以手术为主,辅助以放化疗、内分泌治疗、靶向治疗等手段[4]。紫草素(SKN)及其衍生物有抗炎[5]、抗病毒[6]、抗免疫[7]等多种功效,通过降低 PI3K、Akt的表达及其磷酸化水平[8-9],抑制细胞活力,上调乳腺癌MCF-7细胞中凋亡相关蛋白半胱氨酸蛋白酶(Caspase)-3和Caspase-9的表达,破坏细胞的凋亡调节平衡,促进MCF-7细胞发生自噬[10-12],影响肿瘤血管异常增生等多种途径来共同发挥抗肿瘤作用[13]。由于SKN不溶于水,体内吸收存在巨大阻碍,限制了其进一步的开发利用。因此通过制剂学手段提高靶细胞/部位的药物摄取及聚集尤为重要。纳米结构脂质载体(NLC)因膜材中加入了不相容的液体脂质,使纳米粒可以以结晶缺陷型或无定型结构存在[14],增加了药物的包封率和载药率,存储更加稳定,可实现多途径给药,解决了难溶性药物的给药困境[15]。本研究依据NLC优势,制备了紫草素纳米脂质载体(SKN-NLC),能够显著提高SKN的溶解度,通过聚乙二醇(PEG)修饰来延长药物在体内的循环时间,从而提高SKN的生物利用度,更好地发挥抗肿瘤效果。SKN化学结构式见图1。
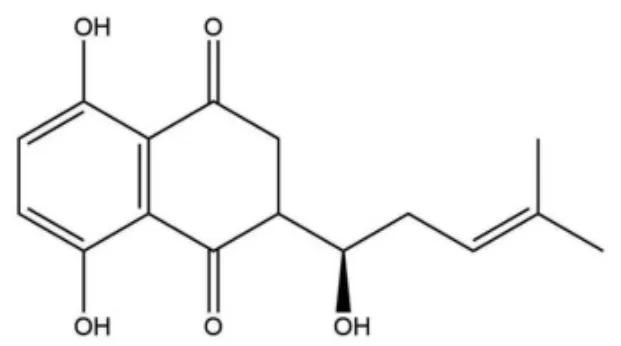
图1 SKN化学结构式
1 仪器与材料
1.1 仪器 岛津LC 20AT型高效液相色谱仪(岛津公司,日本);RET BS 25型磁力搅拌器(艾卡公司,德国);X射线衍射仪(布鲁克公司,德国);SorvallST 16R型台式通用冷冻离心机(赛默飞世尔科技公司,美国);Nano ZS型激光散射粒径分析仪(马尔文公司,英国);TECNAI 10透射电子显微镜(飞利浦公司,荷兰);DSC-204差示扫描量热仪(耐驰公司,德国);FORMA 3111 CO2恒温培养箱(赛默飞世尔科技公司,美国);生物安全柜(赛默飞世尔科技公司,美国);Spark型多功能酶标仪(帝肯公司,瑞士);GE In Cell Analyzer 2000高内涵细胞成像分析系统(通用电气医疗系统有限公司,中国);KQ-400KDE型超声波清洗仪(昆山市超声仪器有限公司,中国);FA 124型万分之一天平(天津亿诺科学技术有限公司,中国);XP205电子天平(梅特勒托利多公司,瑞士);Milli-Q超纯水系统(默克密理博公司,美国)。
1.2 药品与试剂 SKN对照品(成都普斯生物科技股份有限公司,批号:82854-37-3,含量>98%);人乳腺癌细胞MCF-7细胞(中国科学院细胞库);0.25%胰酶+0.02%乙二胺四乙酸(EDTA)(赛默飞世尔科技公司,批号:25200-056);双抗(10 000 U 青霉素+10 000 μg链霉素,赛默飞世尔科技公司,批号:15140-122);DMEM基础培养基(赛默飞世尔科技公司,批号:2044490);胎牛血清(上海逍鹏生物,批号:04-001-1ACS);香豆素-6(伊诺凯科技有限公司,批号:S2137139,含量>98%);Hoechst33342(赫希斯特公司,批号:B8040);CCK-8试剂盒(同仁化学研究所);黑色96孔板(德国葛来娜公司,批号:655090);96孔板(无锡耐思生物科技股份有限公司,批号:701001-1);细胞培养瓶(无锡耐思生物科技股份有限公司,批号:707003);辛酸癸酸三酰甘油(Miglyol812,北京凤礼精求商贸有限责任公司);大豆磷脂(上海艾伟拓医药科技有限公司,批号:SY-SI-180101);聚氧乙烯硬脂酸酯(西格玛公司,批号:MKBV6365V);山嵛酸甘油酯(嘉法狮公司,批号:108833);三氯甲烷(CHCl3,天津康科德科技有限公司,分析纯,批号:20181101);无水乙醇(天津市康科德科技有限公司,色谱纯);超滤离心管(规格50 kDa,默克密理博公司);乙腈(赛默飞世尔科技公司,色谱纯);甲酸(化成工业株式会社,分析纯);甲醇(赛默飞世尔科技公司,色谱纯);二甲基亚砜(DMSO,西格玛公司,批号:D2650);0.22μm注射器式微孔滤膜(Millex-GP,默克密理博公司);去离子水(自制)。
2 方法与结果
2.1 SKN-NLC的制备 采用乳化-固化法制备NLC,将处方量的山嵛酸甘油酯、液体脂质辛酸/癸酸三甘油酯溶于CHCl3中,卵磷脂溶于无水乙醇中,在74~75℃水浴中混合均匀构成油相;将处方量的聚氧乙烯硬脂酸酯溶于去离子水中构成水相,将油相注入水相中,磁力搅拌均匀至澄清,过0.22 μm有机滤膜后置于4℃条件下冷藏固化,即得NLC。同法可制得SKN-NLC和SKN-PEG-NLC。
2.2 含量测定方法
2.2.1 色谱条件色谱柱:Agilent ZorbaxSB-C18(安捷伦公司,美国,4.6 mm×50 mm,5 μm,批号:B11055,S.N.USFA003181);流动相:乙腈-0.2%甲酸水(75∶25);检测波长:516 nm;流速:1 mL/min;柱温:25 ℃;进样量:10 μL。
2.2.2 对照品溶液的制备 精密称定SKN对照品4.90mg,加甲醇定容至10mL,得到浓度为0.49mg/mL的对照品储备液。
2.2.3 标准曲线的制备 取对照品储备液,分别稀释出 245.00、122.50、61.25、30.63、15.31、7.66 μg/mL的溶液,每次进样10 μL,以浓度为横坐标,峰响应值为纵坐标,绘制标准曲线。得到线性回归方程为:Y=10 523X-8 748.9,r2=0.999 9(n=3),结果表明 SKN在7.66~245.00 μg/mL范围内线性关系良好。
2.2.4 专属性考察 分别取SKN对照品溶液、乙腈破乳后的Blank-NLC溶液、SKN-NLC溶液、SKNPEG-NLC溶液,每次进样10μL,记录色谱图。如图2所示,辅料和溶剂对药物测定没有干扰,表明该方法专属性良好。
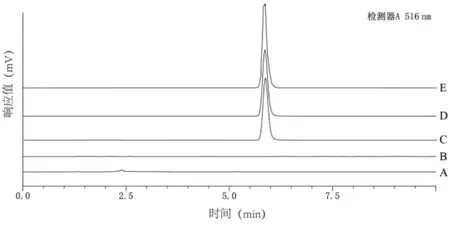
图2 SKN专属性考察结果
2.2.5 精密度实验 取“2.2.2”项中的对照品储备液,分别以甲醇稀释配制成低(30.63 μg/mL)、中(61.25 μg/mL)、高(122.50 μg/mL)3 个浓度的溶液,按照“2.2.1”项下的色谱条件,1 d内重复进样3次,计算日内精密度(n=3)。连续测定3 d,计算日间精密度。计算得日内RSD分别为0.48%、0.63%、0.90%;日间RSD分别为1.24%、0.76%、1.08%,表明日内、日间精密度较好。
2.2.6 稳定性实验 精密量取SKN-NLC,在0、12、24 h时分别吸取10 μL进样,按照“2.2.1”项下的色谱条件,测定峰面积,计算峰面积的RSD(n=6)。结果RSD为2.63%,表明样品在24 h内稳定性良好。
2.2.7 重复性实验 平行制备6份破乳的SKNNLC样品,按“2.2.1”项下色谱条件测定,测得SKN的平均含量为 28.53 μg/mL,RSD 为 1.03%(n=6),表明方法重复性良好。
2.2.8 包封率的测定 按“2.1”项下方法制备SKNNLC样品溶液,取0.3 mL样品加去离子水稀释至3 mL,取2 mL稀释后的溶液置于50 KDa超滤离心管内管中,5 000 r/min,离心半径9 cm,离心20 min,取外管中液体,按照“2.2.1”项下的色谱条件进行SKN含量测定,游离SKN含量记为W游离。从上述SKN-NLC样品溶液中取0.2 mL,加入1.8 mL乙腈超声破乳,5 000 r/min,离心半径9 cm,离心20 min。按照“2.2.1”项下的色谱条件进行SKN含量测定,处方中SKN总含量记为W总。按照下列公式计算包封率,包封率(%)=[(W总-W游离)÷W总]×100%。其中W游离为超滤离心管外管中药物量,W总为加入药物和脂质材料总量。测得SKN-NLC和SKN-PEG-NLC的包封率分别为95%和98%。
2.3 NLC的理化表征
2.3.1 粒径电位测定 取制备的SKN-NLC和SKN-PEG-NLC适量,用去离子水稀释至适宜浓度,室温下用激光粒径测定仪分别测定样品的粒径和Zeta电位。测定3次,取平均值。结果显示,SKNNLC 粒径为(17.69±2.32)nm,多分散指数(PDI)为(0.61±1.41);Zeta 电位为 [-(8.81±1.39)]mV。SKNPEG-NLC 粒径为(19.68±1.25)nm,PDI为(0.28±0.68);Zeta电位为[-(20.27±1.27)]mV。见开放科学(资源服务)标识码(OSID)。
2.3.2 制剂形态观察 取Blank-NLC、SKN-NLC、SKN-PEG-NLC溶液稀释至适宜浓度,滴加在覆盖铜网的碳膜上,使液滴在铜网上呈半球形液面,待自然干燥后,滴入2%磷钨酸溶液染色制片,复染3min,用滤纸沿铜网周围吸干染液,自然干燥后置于透射电子显微镜(TEM)下观察NLC形态并拍照。
各组制剂外观形态见OSID,较为澄清透明,质地均一,空白制剂有淡蓝色乳光。由图3可知,透射电镜下制剂溶液呈圆形小球状,分散均匀,形状规整,大小在20 nm左右。与纳米激光粒径仪测定的结果相吻合。
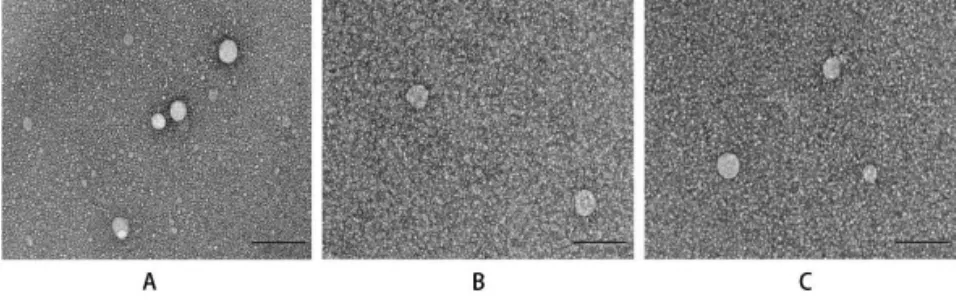
图3 NLC的透射电镜结果
2.4 差示扫描量热测定 精密称取SKN对照品、Blank-NLC冻干粉、SKN-NLC冻干粉、SKN-PEGNLC冻干粉、物理混合物各5mg,升温速率为10℃/min,扫描范围为30~300℃,氮气流速为30 mL/min,差示扫描量热曲线结果见图4。
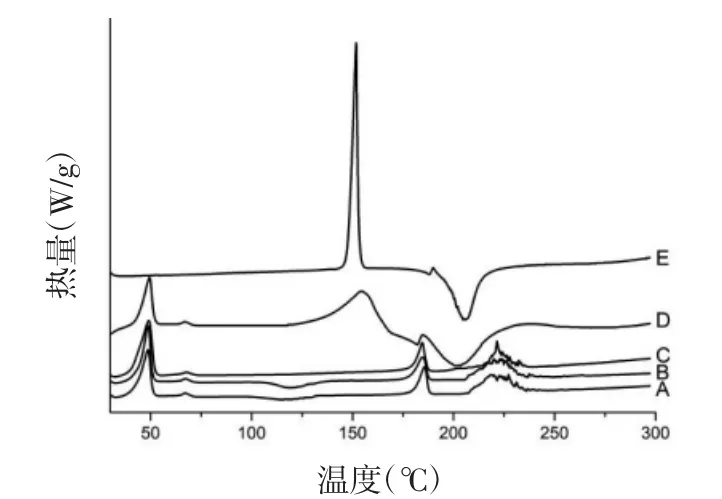
图4 NLC的差示扫描量热结果
结果显示,SKN和物理混合物在150℃下显示出SKN的放热特征峰。在200℃有1个明显吸热特征峰,而该峰在Blank-NLC、SKN-NLC和SKNPEG-NLC 中消失。Blank-NLC、SKN-NLC、SKNPEG-NLC和物理混合物在50、180和225℃下显示出3个明显的放热峰,而SKN中并未出现,表明SKN以非晶体形态包裹于NLC中。
2.5 X射线衍射研究 精密称取SKN对照品、Blank-NLC冻干粉、SKN-NLC冻干粉、SKN-PEGNLC冻干粉和物理混合物约50 mg,选用Cu靶/石墨单色器,设定检测条件:电压40 kV,电流200 mA,扫描范围 5°~80°,扫描速度 5°/min,采样时间 1 s,用X射线衍射仪进行测定,结果见图5。
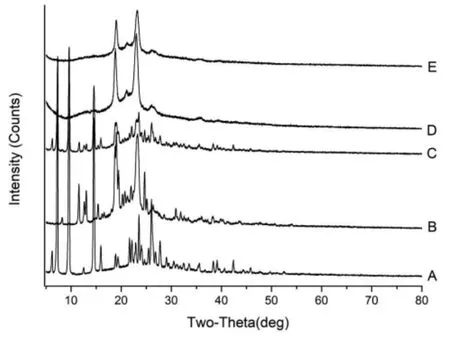
图5 NLC的X射线衍射结果
SKN 和物理混合物在 7.5°、10.0°、14.5°时表现出明显的SKN峰值,而在Blank-NLC、SKN-NLC和SKN-PEG-NLC中该峰值消失。Blank-NLC、SKNNLC、SKN-PEG-NLC 和物理混合物在 20°~25°范围内显示出NLC的特征峰。结果表明SKN以分子分散形式而不是游离形式存在于NLC中,这与差示扫描量热测定的结果一致。
2.6 体外细胞摄取研究
2.6.1 细胞培养 使用10%胎牛血清DMEM培养基,于37℃下外接5%CO2培养箱中培养MCF-7细胞,无菌培养与传代。
2.6.2 SKN的细胞毒性评价 以每孔8 000个细胞的密度将MCF-7细胞接种于96孔板中,培养箱中培养至80%细胞密度后,分别使用浓度为0、1、2、4、5、8、10、15、30μmol/L的SKN溶液处理,采用CCK-8法在450nm下测定细胞活性,计算细胞存活率。得SKN半数抑制浓度(IC50)为 11.05 μmol/L,且细胞的存活率随着SKN给药浓度的增大而降低,具有浓度依赖性。细胞存活率(%)=[(As-Ab)÷(Ac-Ab)]×100%(As为实验孔吸光度,Ab为空白孔吸光度,Ac为对照孔吸光度)。
2.6.3 载体抗肿瘤细胞增殖评价 按“2.6.2”项实验步骤,分别加入 100 μL 浓度为 4、11、15 μmol/L的SKN、SKN-NLC和SKN-PEG-NLC溶液,计算细胞存活率。采用SPSS 22.0进行统计分析,所有实验数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较时,若方差齐采用LSD法,若方差不齐采用Dunnett-t法,P<0.05表示差异有统计学意义。
SKN在4 μmol/L时各组对MCF-7细胞均无明显毒性,与对照组比较无统计学差异(P>0.05)。当浓度为11 μmol/L时,SKN-PEG-NLC溶液抗肿瘤效果与SKN溶液组及SKN-NLC溶液组比较,差异有统计学意义(P<0.01或P<0.001)。当浓度为15μmol/L时,SKN-PEG-NLC溶液抗肿瘤效果与SKN溶液组比较,差异有统计学意义(P<0.001)。见图6。
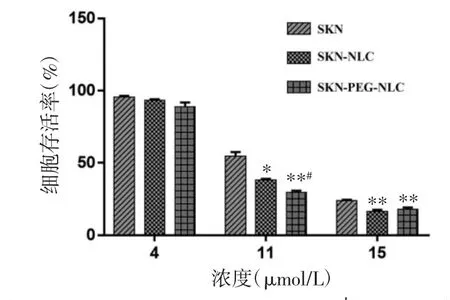
图6 NLC 的细胞毒性结果(±s,n=6)
2.6.4 NLC细胞摄取评价 按“2.6.2”项实验步骤培养MCF-7细胞,避光操作每孔加入1 μg/mL的Hoechst 33342溶液孵育30 min,用常温的磷酸缓冲盐溶液(PBS)清洗细胞2遍。加入稀释好的香豆素-6标记的各组制剂,共孵育4 h。将处理好的96孔板放入细胞高内涵成像仪中,设定染料的激发波长与发射波长进行测定。统计分析方法同“2.6.3”项。
荧光主要分布在细胞核周围,即SKN-NLC被MCF-7细胞摄取后主要存在于细胞质中。制剂组细胞荧光强度明显高于SKN溶液组,表明MCF-7细胞对SKN-NLC的摄取高于溶液组。此外,SKNPEG-NLC溶液的荧光强度高于SKN-NLC溶液组,推测PEG修饰后可增加MCF-7细胞对SKN-NLC的摄取。综上,通过将SKN包载于NLC中,表面进行PEG修饰后可增加MCF-7细胞对制剂的摄取。见图7。
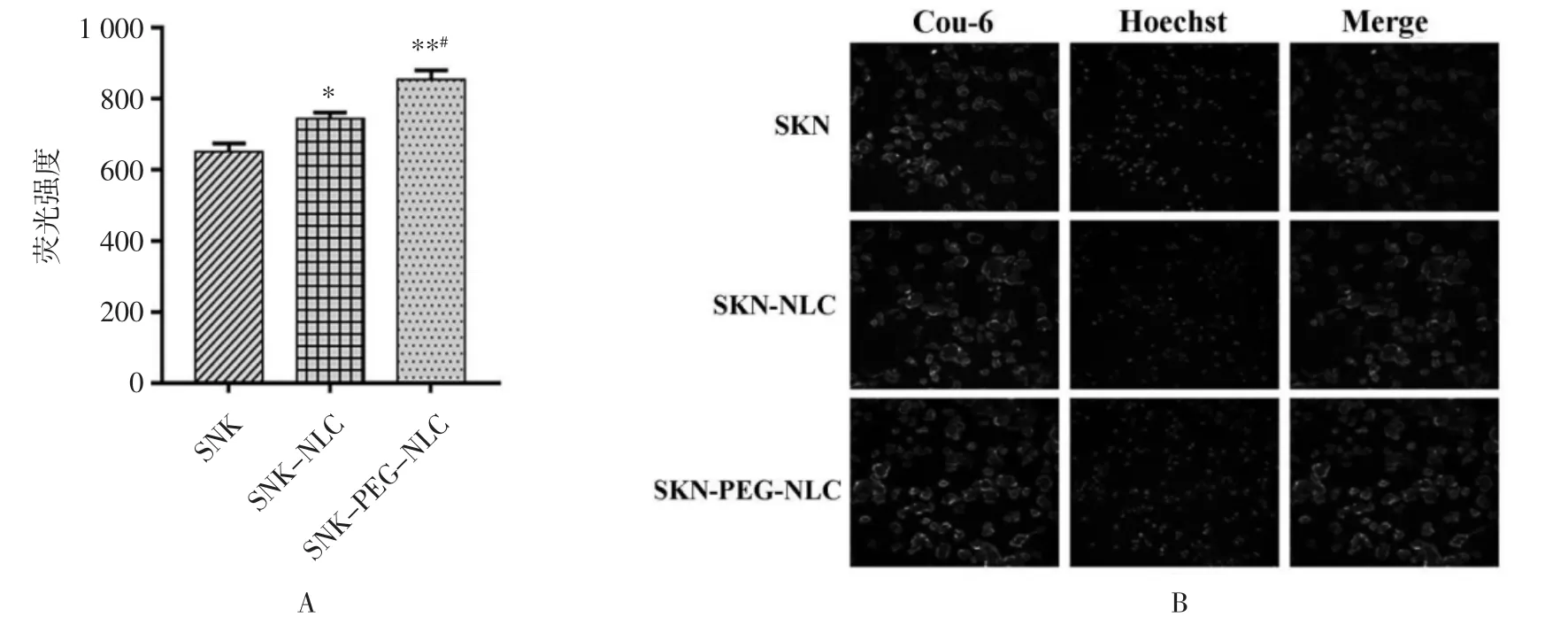
图7 高内涵荧光强度柱状图(A)和高内涵荧光强度(B)细胞摄取结果(±s,n=6)
3 讨论
本研究通过乳化蒸发-低温固化法制备了SKN-NLC,通过透射电镜和马尔文激光粒径分析仪可知,制剂外观圆整,粒径分布均匀,体系稳定。粒径分布和电位是纳米载体质量评价的一个非常重要的指标[16],本研究以实验室前期考察得到的最佳处方制备出的SKN-NLC粒径为17.69 nm,SKNPEG-NLC粒径为19.68 nm。相较于 SKN-NLC,SKN-PEG-NLC的PDI更小,体系更均一,包封率更高。这种空间稳定材料有望制备出更为理想的SKN-NLC制剂,为体内外SKN递送提供稳定保障[17]。本研究通过差示扫描量热仪对SKN、Blank-NLC、SKN-NLC、SKN-PEG-NLC及物理混合物的吸热峰进行表征研究和比较分析,证明了SKN在NLC中以无定形形式存在,X射线衍射实验也证明了上述结论。由细胞增殖抑制实验可知SKN-PEG-NLC的肿瘤抑制作用大于SKN-NLC和SKN溶液。本研究中选择脂溶性的香豆素-6作为荧光探针来替代SKN制备荧光标记的NLC,通过考察发现香豆素-6浓度为 0.05 μg/mL,Hoechst浓度为 1 μg/mL 时对MCF-7细胞无毒性作用,可以进行后续的细胞摄取实验。本实验综合以上研究结果,通过制备NLC提高了SKN的生物利用度,并初步证明了PEG化的SKN-NLC在体外抑制乳腺癌的优势作用,但SKN进入细胞后的抑瘤机制等仍需进一步研究。

