沉默STC2对人结肠癌SW480细胞肝转移裸鼠模型的影响及作用机制研究
李乾元 周秀扣 方征宇 潘志芸
结直肠癌(CRC)是全球常见的恶性肿瘤[1]。近年来,随着人们生活方式及饮食结构的变化,CRC的发病率呈持续升高趋势。目前临床上对CRC患者通常采用外科手术治疗,但研究显示有40%~50%的CRC患者在术后出现局部复发或远处转移,最终导致死亡[2-3]。CRC肝转移是影响患者预后的主要因素,然而肝转移的潜在机制尚未完全明确。因此,临床亟需探寻新的CRC远处转移的分子标志物和治疗策略。斯钙素2(STC2)是一种分泌型糖蛋白激素,其以自分泌或旁分泌的方式在多种组织和器官中表达并发挥生物学作用[4]。研究表明,CRC组织中STC2较正常组织显著升高,STC2高表达患者的总体生存期较短,并且STC2高表达与CRC患者的淋巴结转移、远处转移、晚期临床分期显著相关[5]。此外,上皮间质转化(EMT)与肿瘤远处转移有着密切联系,EMT的发生会加快CRC进展。Wnt/β-连环蛋白(β-catenin)信号通路可通过影响肿瘤细胞的增殖、分化及凋亡,参与CRC的发生、发展。本研究基于Wnt/β-catenin信号通路,探讨了沉默STC2对人结肠癌SW480细胞肝转移裸鼠模型的影响及作用机制,以期为临床寻找新的CRC远处转移的分子标志物和治疗策略提供思路。
1 材料与方法
1.1 材料
1.1.1 细胞株与动物 人结肠癌细胞株SW480购自美国典型培养物保藏中心(ATCC)。SPF级BALB/c雄性裸鼠共30只(6~8周龄,体质量16~20 g),购自上海市西普尔-必凯实验动物有限公司,于SPF级实验室中饲养,湿度、温度适宜。本研究动物实验获得医院动物伦理委员会批准,同时遵循中国动物护理和机构伦理指导方针。
1.1.2 主要试剂与仪器 (1)实验材料:H-E染色试剂盒购自上海信帆生物科技有限公司;蛋白提取试剂盒购自武汉纯度生物科技有限公司;BCA蛋白浓度测定试剂盒购自上海烜雅生物科技有限公司;反转录试剂盒购自美国赛默飞世尔科技有限公司;脂质体lipofectamine 2000试剂盒购自北京伊塔生物科技有限公司;一抗[STC2、波形蛋白(Vimentin)、基质金属蛋白酶-9(MMP-9)、T细胞因子4(TCF-4)、C-myc、细胞周期蛋白D1(Cyclin D1)、GAPDH]和二抗(羊抗鼠、羊抗兔)均购自美国Abcam公司;一抗[E-钙黏蛋白(E-cadherin)、β-catenin]购自美国CST公司;(2)实验仪器:1855195-OG型定量PCR仪购自美国Biorad公司;DYCZ-20E型电泳设备购自北京六一生物科技有限公司。
1.3 方法
1.3.1 细胞培养和传代 将SW480细胞置于含10%胎牛血清、青霉素/链霉素双抗RPMI-1640培养基中,并于37 ℃、5% CO2培养箱中贴壁培养。按1︰2.5的比例隔天传代。待培养基细胞密度达80%,用吸管抽吸培养基中旧培养液,用PBS冲洗一遍,加入少量乙二胺四乙酸(EDTA)与胰蛋白酶的混合液,轻轻旋转培养瓶,使液体能覆盖整个细胞面为宜。在显微镜下观察,当细胞间隙增大、细胞质回缩时吸出消化液,加入新的培养液,用移液管轻轻吹打培养基形成单细胞悬液。在显微镜下采用计数板计数后,取2.5 mL细胞悬液接种至新的培养基中,轻轻旋转培养瓶,使细胞在培养基中均匀分布,置于37 ℃、5% CO2培养箱中贴壁培养。
1.3.2 慢病毒载体介导的基因沉默 pLL3.7载体购自上海柯雷生物科技有限公司,设计针对STC2的RNA干扰序列shRNA,并构建pLL3.7-shSTC2质粒,根据脂质体lipofectamine 2000试剂盒说明书进行细胞转染,构建pLL3.7-shSTC2细胞,记为pLL3.7-shSTC2组。将以阴性病毒载体(pLL3.7-NC)转染的SW480细胞作为阴性对照,记为pLL3.7-NC组。将仅以转染试剂处理的SW480细胞作为空白对照,记为pLL3.7-Con组。
1.3.3 构建结肠癌肝转移动物模型 SPF级雄性BALB/c裸鼠共30只,随机分为pLL3.7-STC2组、pLL3.7-NC组和pLL3.7-Con组,每组各10只。3组分别于脾下缓慢注射2.5×107/mL的SW480细胞悬液,待注射部位肿胀、发白后拔针,并立即用棉球按压止血,保留脾脏建立结肠癌肝转移动物模型。常规饲养并定期观察裸鼠的精神活动状态、体质量变化,3周后颈椎脱臼处死裸鼠。各组裸鼠处死后剖腹,观察记录肝转移瘤数量、直径及肝脏质量,留取各组肝转移瘤组织以备后续实验使用。
1.3.4 H-E染色观察 取肝转移瘤组织块,用10%甲醛固定,常规脱水、透明、包埋、切片、脱蜡、水化,经H-E染色,中性树胶封片,在100倍显微镜下观察病理变化,实验重复3次。
1.3.5 RT-PCR法检测 取各组肝转移瘤组织,加入1 mL TRIzol试剂提取总RNA,采用紫外分光光度计检测其浓度,并用TaKaRa反转录试剂盒行反转录合成cDNA,反应模式:预变性95 ℃ 10 min,变性95 ℃ 10 s,退火60 ℃ 10 s,共40个循环。采用2-ΔΔCT法计算各基因相对表达量,以GAPDH为内参,引物序列见表1。

表1 引物序列
1.3.6 蛋白质印迹法检测 取组织及细胞,采用蛋白质提取试剂盒提取总蛋白,并根据BCA蛋白水平测定各种蛋白水平,取20 μL样品上样至SDS-PAGE凝胶泳道上进行电泳,并转移至PVDF膜上,封闭,加入一抗(STC2、Vimentin、MMP-9、TCF-4、C-myc、Cyclin D1、GAPDH、E-cadherin及β-catenin),4 ℃孵育过夜,用TBST漂洗3次(10 min/次)。加入二抗(羊抗兔IgG、羊抗鼠IgG),用TBST漂洗3次(10 min/次)。采用ECL化学发光法进行图像显影,以GAPDH为内参,应用ImageJ软件进行分析。
1.3.7 免疫组织化学法观察 取小鼠肝转移瘤组织,组织切片采用二甲苯乙醇水化,加热进行抗原修复,在室温下用H2O2孵育。组织切片加入β-catenin一抗于4 ℃孵育过夜,滴加AP标记羊抗鼠二抗于室温下孵育20 min。采用DAB显色,苏木精染液复染,脱水、透明、干燥、封片,在100倍显微镜下观察各组的β-catenin表达水平。
1.4 统计学方法
应用SPSS 20.0软件进行统计学分析,计量资料以均数±标准差表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 蛋白质印迹法检验建模效果
蛋白质印迹法(Western blotting)检测结果显示,pLL3.7-shSTC2组SW480细胞的STC2蛋白表达水平明显低于pLL3.7-NC组和pLL3.7-Con组,差异有统计学意义(P<0.05),见图1。

注:与pLL3.7-NC组比较,***P<0.001图1 3组SW480细胞的STC2蛋白表达水平比较 A STC2蛋白电泳图 B STC2蛋白表达柱状图
2.2 建模后各组的一般情况比较
建模后第1周,各组裸鼠的精神状态、摄食饮水正常,活动自如,腹部未见明显肿块。建模后第2周开始,pLL3.7-Con组和pLL3.7-NC组裸鼠的精神状态较差,摄食量减少,行动逐渐迟缓,部分裸鼠可见腹部膨隆;pLL3.7-shSTC2组中部分裸鼠出现精神状态欠佳、摄食量偏少、行动较缓慢、体质量下降现象。建模3周后,颈椎脱臼处死裸鼠,解剖取出肝脏。各组的肝脏体积变小,外形部分受损,质地脆硬;各组的部分肝组织被转移瘤替代,肝脏表面可见散在分布的灰白色针尖大小的微小转移灶,转移瘤主要位于肝叶边缘和肝叶脏面。与pLL3.7-shSTC2组相比,pLL3.7-NC组和pLL3.7-Con组的肝脏外形不规则程度、质地脆硬度、瘤体破溃等现象均更严重,见图2。
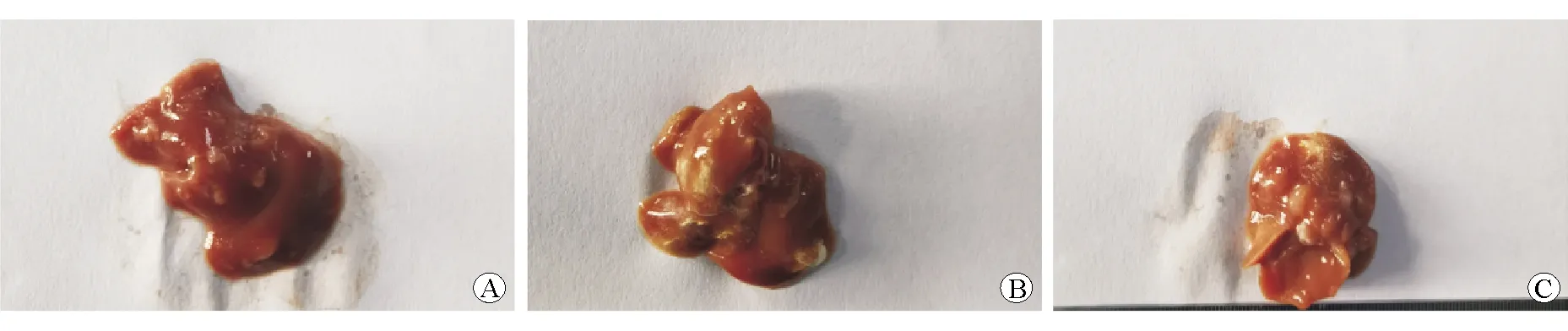
图2 建模3周后各组的肝脏标本比较 A pLL3.7-Con组 B pLL3.7-NC组 C pLL3.7-shSTC2组
pLL3.7-Con组、pLL3.7-NC组、pLL3.7-shSTC2组的肝转移瘤数量分别为(11.75±1.25)个、(12.15±1.38)个、(5.72±1.02)个,肝转移瘤直径分别为(2.22±0.21)mm、(2.24±0.20)mm、(1.51±0.18)mm,肝脏质量分别为(1.81±0.14)g、(1.85±0.15)g、(1.59±0.11)g。结果提示pLL3.7-shSTC2组的肝转移瘤数量、直径及肝脏质量均明显小于pLL3.7-Con组和pLL3.7-NC组。见图3。
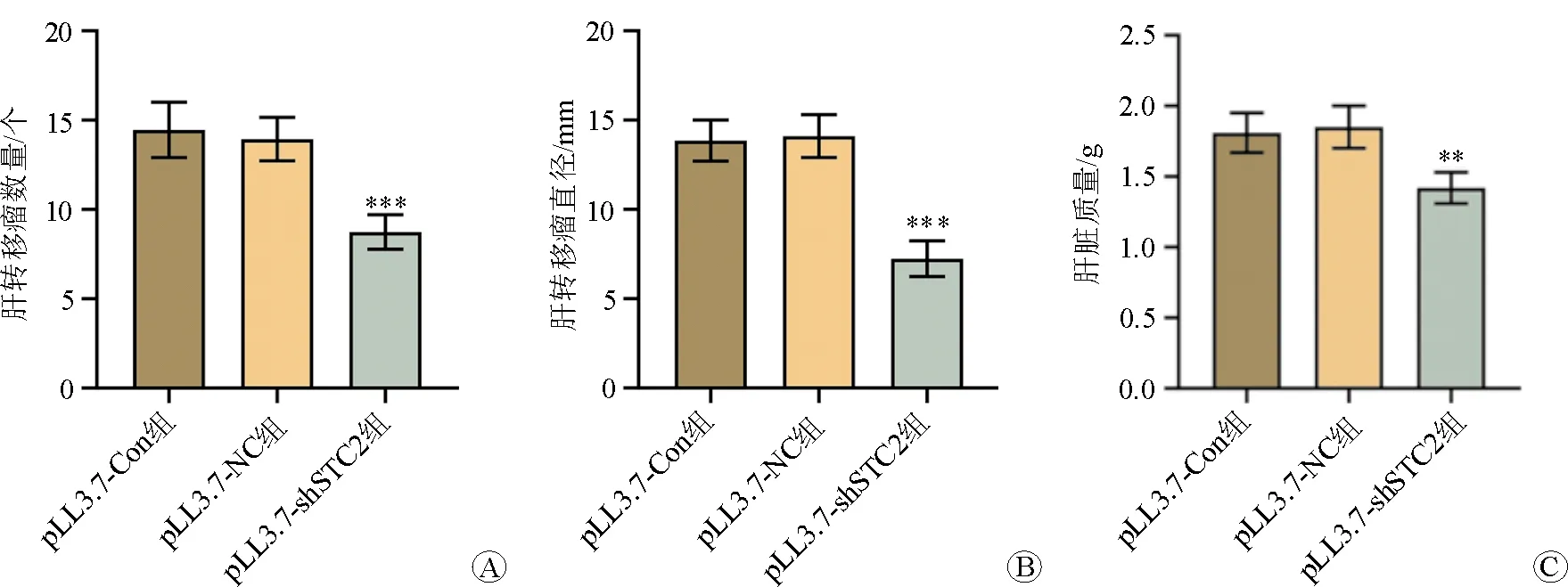
注:与pLL3.7-NC组比较,**P<0.01,***P<0.001图3 各组的肝转移瘤数量、直径及肝脏质量比较 A 肝转移瘤数量 B 肝转移瘤直径 C 肝脏质量
各组的肝组织H-E染色结果显示,pLL3.7-Con组和pLL3.7-NC组的肝小叶结构大部分被破坏,且肝转移瘤区可见大量肿瘤细胞聚集成团形成癌结节,肿瘤细胞异型性明显,肿瘤细胞呈梭形,细胞质较少,细胞核呈圆形,核分裂相增多。pLL3.7-shSTC2组的肝小叶结构被破坏,视野内见少许肿瘤细胞聚集成团或散在分布,肿瘤细胞异型性明显,细胞质较少,细胞核固缩,核分裂相增多。结果提示pLL3.7-shSTC2组的肝脏病理变化较pLL3.7-NC组和pLL3.7-Con组轻。见图4。
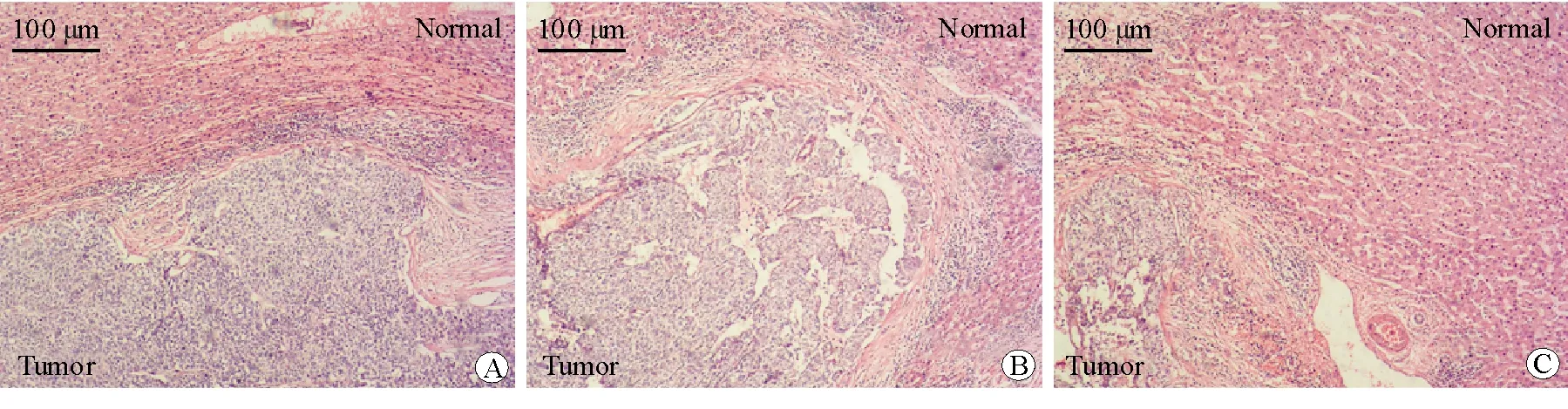
图4 各组裸鼠的肝组织病理图 H-E染色 ×100 A pLL3.7-Con组 B pLL3.7-NC组 C pLL3.7-shSTC2组
2.3 各组肝转移瘤组织中STC2、EMT及Wnt/β-catenin信号通路相关基因的蛋白表达水平比较
Western blotting法检测结果显示,与pLL3.7-Con组、pLL3.7-NC组相比,pLL3.7-shSTC2组肝转移瘤组织中STC2、Vimentin、MMP-9、β-catenin、TCF-4、C-myc及Cyclin D1的蛋白表达水平表达明显降低(P<0.05),E-cadherin蛋白表达水平明显升高(P<0.05)。见图5、表2。

注:与pLL3.7-NC组比较,***P<0.001图5 各组肝转移瘤组织中STC2、EMT及Wnt/β-catenin信号通路相关基因的蛋白表达水平比较 A STC2、E-cadherin、Vimentin、MMP-9蛋白电泳图 B STC2、E-cadherin、Vimentin、MMP-9蛋白表达柱状图 C β-catenin、TCF-4、C-myc、Cyclin D1蛋白电泳图 D β-catenin、TCF-4、C-myc及Cyclin D1蛋白表达柱状图

表2 各组肝转移瘤组织中STC2、EMT及Wnt/β-catenin信号通路相关基因的蛋白表达水平比较
本研究中,RT-PCR法检测结果显示,与pLL3.7-Con组、pLL3.7-NC组相比,pLL3.7-shSTC2组裸鼠的肝转移瘤组织中TCF-4、C-myc、CyclinD1的mRNA表达水平均明显降低(P均<0.05)。见图6、表3。
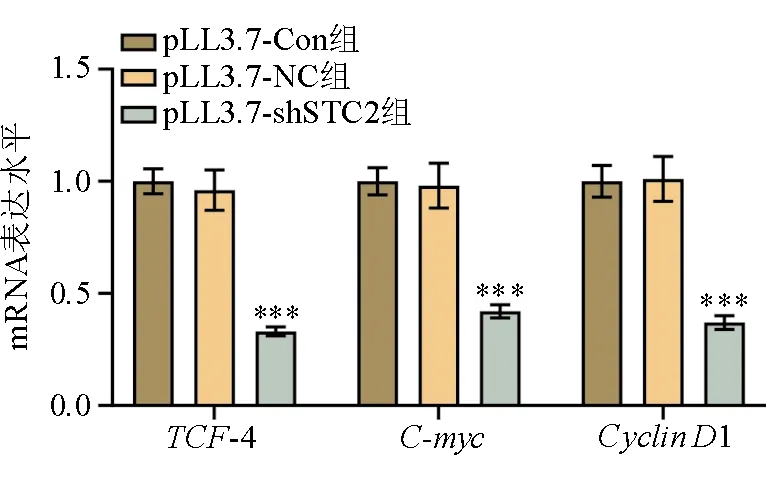
注:与pLL3.7-NC组比较,***P<0.001图6 各组TCF-4、C-myc、Cyclin D1的mRNA表达水平比较

表3 各组肝转移瘤组织中TCF-4、C-myc、Cyclin D1的mRNA表达水平比较
本研究中,免疫组织化学染色结果显示,与pLL3.7-Con组、pLL3.7-NC组相比,pLL3.7-shSTC2组裸鼠的肝转移瘤组织中β-catenin表达水平明显降低。见图7。

图7 各组的β-catenin表达比较 免疫组织化学染色 ×100 A pLL3.7-Con组 B pLL3.7-NC组 C pLL3.7-shSTC2组
3 讨论
在中国,CRC是常见的消化系统恶性肿瘤。研究报道,全球每年CRC新发病例约110万,死亡病例约50万[6-7]。近年来,随着中国人口老龄化及饮食结构中脂肪占比的升高等原因,CRC的发病率呈升高趋势。研究表明,肝转移是造成CRC患者死亡的主要原因,该过程中有多因素、多基因参与[8]。虽然CRC的发病机制研究取得了一定的进展,但CRC发生肝转移的具体机制迄今未完全明确。因此,探讨新的CRC肝转移标志物及治疗策略是目前亟待解决的重要问题。
STC2是一种糖蛋白激素,主要在鱼的肠道及腮中发挥抑制钙摄取的作用[9]。研究发现,STC2广泛存在于人体的十二指肠、肾小管和集合管等组织中,在细胞增殖、代谢等生理过程中发挥着一定的作用[10]。近年来,多项研究表明,STC2与恶性肿瘤的发生、发展密切相关[11-12]。为进一步探讨STC2对CRC肝转移的影响,本研究将pLL3.7-shSTC2质粒转染入SW480细胞,发现pLL3.7-shSTC2组SW480细胞的STC2蛋白表达水平明显低于pLL3.7-Con组和pLL3.7-NC组,提示成功构建沉默STC2的SW480细胞。本研究进一步构建了结肠癌细胞肝转移裸鼠模型,结果显示pLL3.7-shSTC2组裸鼠的一般情况较pLL3.7-Con组和pLL3.7-NC组好,肝转移瘤数量、直径及肝脏质量较小,肝组织病理变化较轻,提示沉默STC2对结肠癌细胞肝转移有抑制作用。
肿瘤远处转移与EMT的发生、肿瘤微环境的变化,以及细胞质基质的降解密切相关[13]。EMT是指上皮细胞在生理、病理因素作用下,通过一系列基因的表达转化为间质表型细胞的过程,在胚胎发育、器官形成和肿瘤细胞侵袭、远处转移等诸多生理、病理现象中发挥重要作用[14]。Vimentin、MMP-9及E-cadherin是EMT相关分子标志物,Vimentin、MMP-9表达水平上调,可通过重塑基质膜与细胞外基质,继而下调E-cadherin水平,改变上皮细胞的微环境,促使EMT发生,诱导肿瘤细胞发生远处转移。此外,上述过程与Wnt/β-catenin信号通路转导途径密切相关,在生长因子的刺激下,激活Wnt/β-catenin通路的级联反应,能增强肿瘤细胞的增殖和抗凋亡能力[15]。β-catenin是Wnt/β-catenin通路的核心元件,其在正常结肠细胞中可与E-cadherin及α-catenin结合形成复合体,发挥细胞间黏附作用,可防止细胞转移。而在肿瘤细胞中,Wnt处于失活状态,复合体被降解,导致β-catenin聚集于细胞质内,当细胞质内β-catenin达到一定水平后可激活细胞核内的TCF-4,导致通路下游靶基因C-myc、CyclinD1被激活,从而导致肿瘤细胞过度增殖及凋亡受阻[16]。
目前STC2是否通过调控Wnt/β-catenin信号通路促进结肠癌细胞肝转移仍有待研究。为进一步阐明沉默STC2在结肠癌细胞肝转移中的作用机制,本研究分析了结肠癌细胞肝转移裸鼠模型中STC2、EMT及Wnt/β-catenin信号通路相关基因的蛋白表达,结果发现,与pLL3.7-Con组、pLL3.7-NC组相比,pLL3.7-shSTC2组肝转移瘤组织中β-catenin、TCF-4、C-myc、Cyclin D1、Vimentin及MMP-9的蛋白表达均明显降低,E-cadherin蛋白表达明显升高,提示沉默STC2可能通过下调β-catenin表达,进而阻碍Wnt/β-catenin信号通路下游靶基因启动子激活,阻碍TCF-4激活,下调C-myc及Cyclin D1表达水平,阻碍EMT的发生,从而抑制CRC肝转移进程。
综上所述,沉默STC2可通过抑制Wnt/β-catenin信号通路减少结肠癌细胞的增殖和侵袭,以及EMT的发生,从而抑制肿瘤肝转移。本研究结果为临床探寻新的CRC远处转移的分子标志物和治疗策略提供了思路,本研究仅用SW480细胞进行了初步探讨,今后将采用多种结肠癌细胞株及开展临床研究进行验证。

