MYPT1在肝细胞癌组织中的表达及意义
张化涛 高丽萍 李秀君 杨 勇
肝细胞癌(HCC)是一种常见的恶性肿瘤,患者预后不良的发生率较高,严重威胁着人们的生命健康[1]。有研究报道,HCC是全球恶性肿瘤相关死亡的第3大原因[2]。2018年一项全球范围的调查结果显示,由HCC导致死亡的人数占恶性肿瘤总死亡人数的8.2%左右[3]。现有的预测HCC患者预后的指标存在敏感度较低或特异度较低等不足[4-6],因此,探寻敏感度和特异度均较高的生物标志物以准确预测HCC患者的预后情况具有重要意义。
研究表明,RhoA/ROCK信号转导通路可通过影响细胞骨架蛋白重构,或者调控细胞血管形成拟态的生成,参与HCC细胞的侵袭、转移过程[7-8]。RhoA/ROCK信号转导通路的主要信号分子包括RhoA、ROCK、肌球蛋白磷酸酶靶亚基1(MYPT1)和磷酸化MYPT1[9]。由此推测,检测HCC组织中MYPT1的表达水平对于预测HCC患者的预后情况具有一定参考价值。本文探究了MYPT1与HCC患者的临床病理特征及预后的关系,以期为HCC预后评估提供参考。
1 资料与方法
1.1 一般资料
选择2013年3月至2015年1月在胜利石油管理局临盘医院确诊的113例HCC患者作为研究对象,经手术切除或经皮穿刺获取患者的HCC组织和癌旁组织(距肿瘤病灶边缘>2 cm),于液氮罐中保存。参照《原发性肝癌规范化诊治专家共识》[10]诊断HCC。纳入标准:(1)接受肝脏活体组织病理检查;(2)确诊为HCC;(3)病理资料完整;(4)签署了知情同意书。排除标准:(1)合并其他恶性肿瘤;(2)合并自身免疫性疾病;(3)年龄>70岁;(4)预计生存期<3个月。113例HCC患者中,男性78例,女性35例,年龄47~70岁,平均年龄为(62.10±5.74)岁。本研究经医院医学伦理委员会批准(批件号:201300118)。
1.2 方法
1.2.1 临床数据收集 应用CT检查收集HCC患者的肿瘤数量、肿瘤直径及血管侵犯情况等;应用病理切片检查了解HCC病灶的分化程度;采用ELISA法检测乙型肝炎表面抗原(HBsAg)水平;采用放射免疫法检测甲胎蛋白(AFP)水平。根据HCC患者有无肝性脑病、腹水、总胆红素、白蛋白、凝血酶原时间判定Child-Pugh分级情况,各项分值为1~3分,总分为各项得分之和,5~6分为A级,7~9分为B级,≥10分为C级。
1.2.2 HCC组织中MYPT1水平检测 采用蛋白质印迹法检测HCC及癌旁组织中MYPT1的表达水平。实验步骤如下:首先,加入细胞裂解液裂解肝脏组织细胞,4 ℃下3 500 r/min离心15 min,离心半径为8 cm,采用BCA试剂盒(购自上海吉至生化科技有限公司)进行蛋白定量。然后,依次进行电泳、转膜、封闭,在4 ℃下孵育兔抗人MYPT1抗体(1∶500,购自武汉菲恩生物科技有限公司)过夜,次日室温下孵育二抗(1∶3 000,购自武汉菲恩生物科技有限公司)1 h。最后,应用ChemiDocTMXRS凝胶成像系统(购自美国Bio-Rad公司)成像,并用ImageJ软件分析实验结果。
1.2.3 随访 采用电话方式收集113例HCC患者的5年预后生存情况。于患者出院后1个月开始随访,每月随访1次,随访终点为2020年1月18日或者患者死亡,中位随访时间为47个月。
1.3 统计学方法
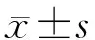
2 结果
2.1 MYPT1在HCC组织和癌旁组织中的表达水平
结果显示,MYPT1在HCC组织中的相对表达量为0.44±0.16,低于癌旁组织(1.06±0.16),两组差异有统计学意义(t=29.927,P<0.001),见图1。

注:T指HCC组织,N指癌旁组织图1 MYPT1表达的蛋白电泳图
2.2 MYPT1与HCC临床病理特征的关系
如表1所示,MYPT1与HCC患者的年龄、性别、肿瘤数量、分化程度和HBsAg无关(P均>0.05),而与肿瘤直径、Child-Pugh分级、AFP和血管侵犯有关(P均<0.05)。MYPT1在肿瘤直径≥5 cm、Child-Pugh分级为B级、AFP≥40 μg/L、存在血管侵犯的HCC患者肿瘤组织中的表达水平分别低于肿瘤直径<5 cm、Child-Pugh分级为A级、AFP<40 μg/L、无血管侵犯的患者,差异均有统计学意义(P均<0.05)。
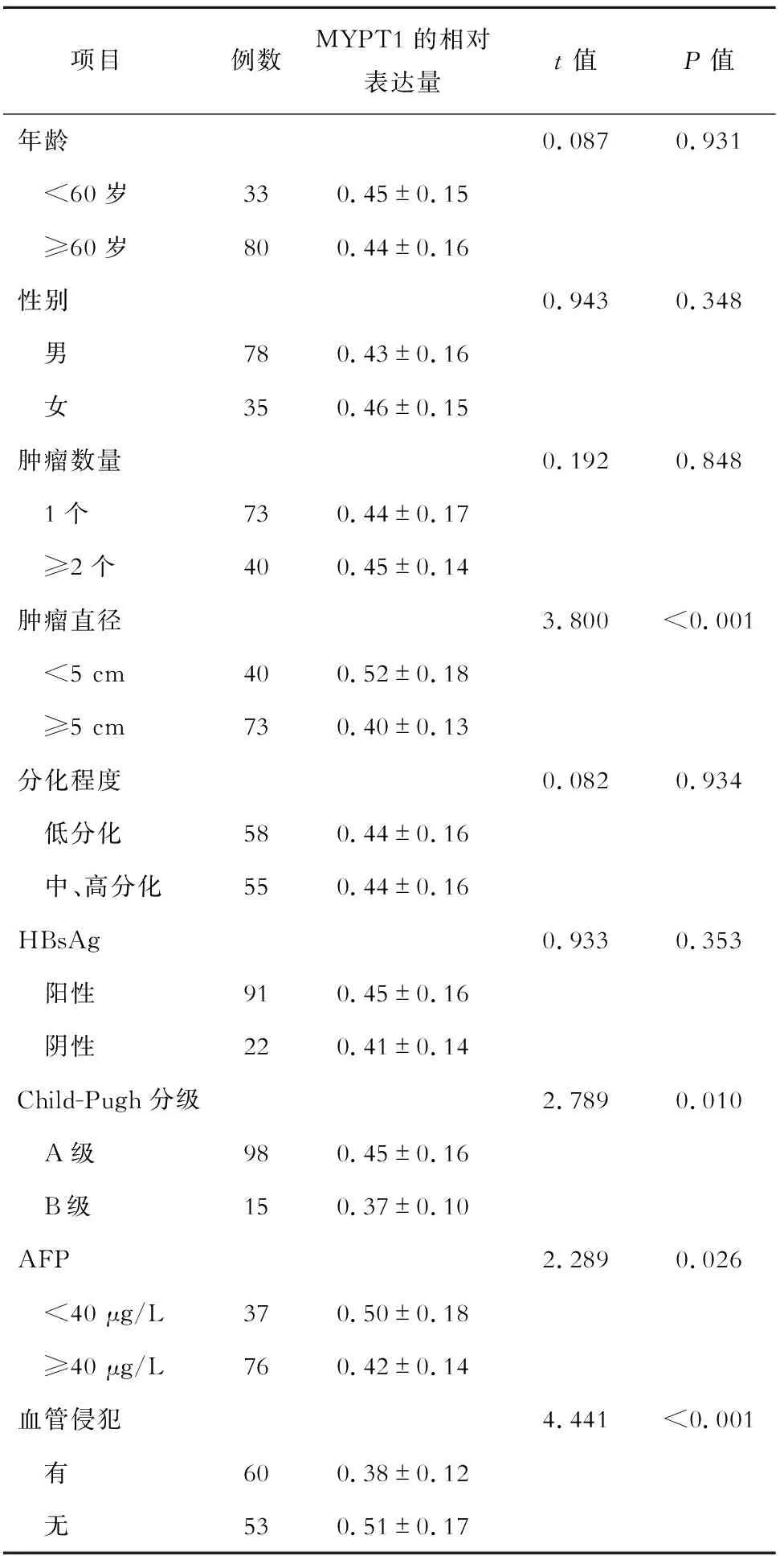
表1 MYPT1与HCC临床病理特征的关系
2.3 MYPT1预测HCC患者预后的效能
113例HCC患者1年、3年和5年的生存率分别为92.04%(104/113)、85.84%(97/113)和37.17%(42/113)。MYPT1预测HCC患者预后生存的ROC曲线下面积(AUC)为0.895(95%CI:0.824~0.945),最大约登指数为0.671,最佳截断值为0.39,敏感度为71.83%,特异度为95.24%,见图2。
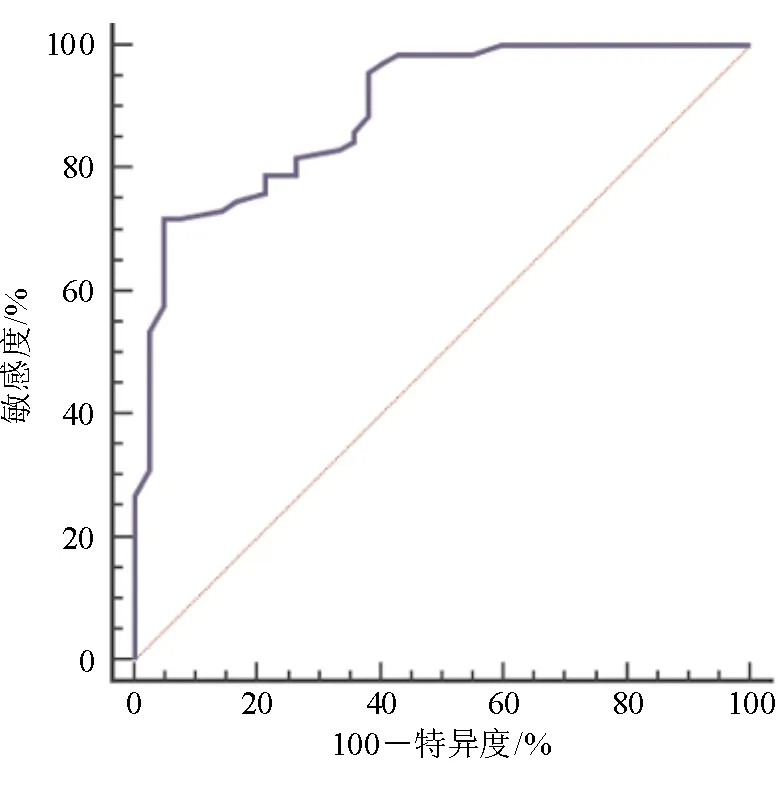
图2 MYPT1预测HCC患者预后生存的ROC曲线
2.4 MYPT1与HCC患者预后的关系
以MYPT1预测HCC患者预后的最佳截断值将113例HCC患者分为高表达组(MYPT1≥0.39,n=65)和低表达组(MYPT1<0.39,n=48)。高表达组的中位生存时间长于低表达组(60个月比39个月),两组差异有统计学意义(log-rankχ2=38.025,P<0.001),见图3。将HCC患者的预后生存情况作为因变量,将可能与HCC患者预后有关的因素,包括年龄、性别、肿瘤数量、肿瘤直径、分化程度、HBsAg、Child-Pugh分级、AFP、MYPT1和血管侵犯作为自变量纳入Cox单因素回归分析,结果显示肿瘤直径、Child-Pugh分级、MYPT1和血管侵犯与HCC患者预后有关(P<0.05)。将Cox单因素回归分析中可能与HCC患者预后有关的因素(P<0.1),包括性别、肿瘤直径、Child-Pugh分级、MYPT1及血管侵犯作为自变量,将HCC患者的预后生存情况作为因变量纳入Cox多因素回归分析,结果显示血管侵犯是HCC患者预后生存的独立危险因素(P<0.05),MYPT1是HCC患者预后生存的独立保护因素(P<0.05),见表2。
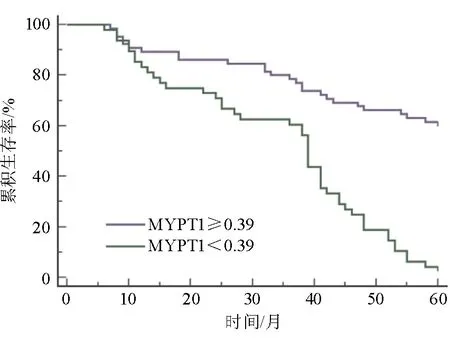
图3 MYPT1高表达组和低表达组的预后生存曲线
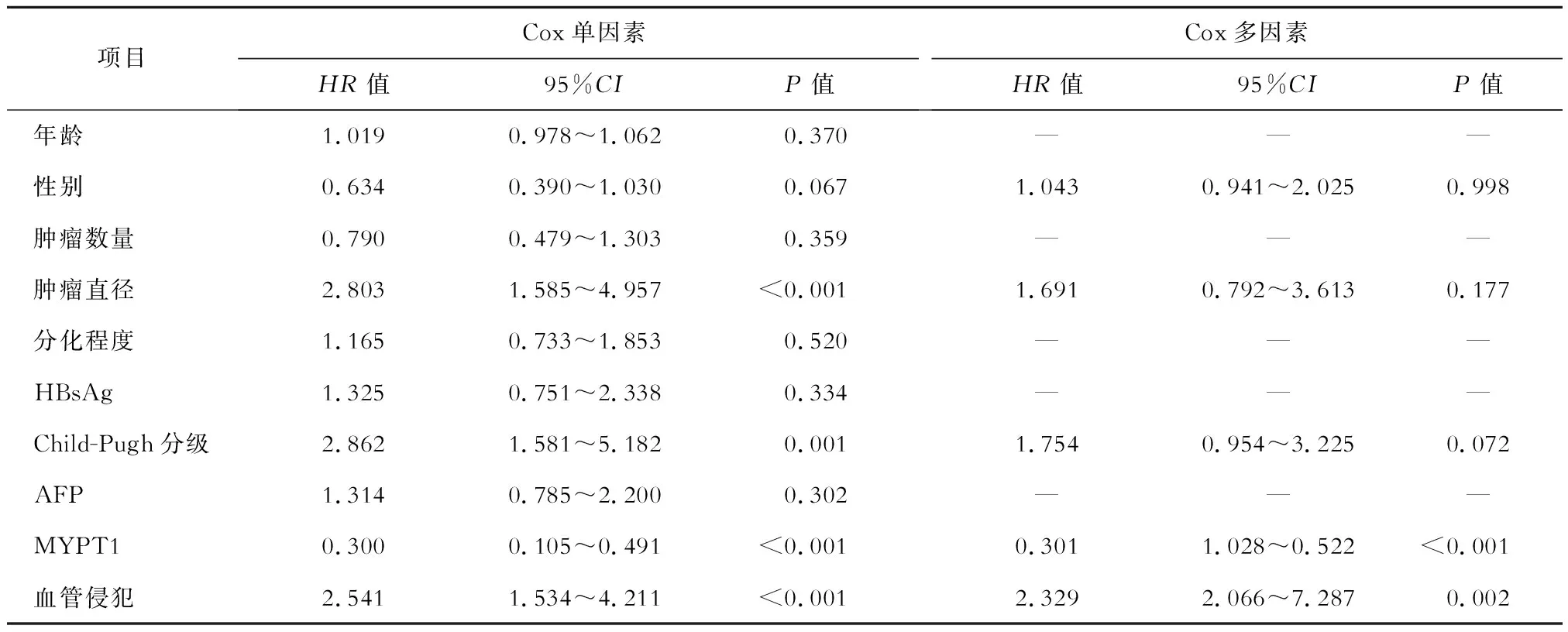
表2 影响HCC患者预后生存的单因素和多因素Cox比例风险回归分析
3 讨论
MYPT1基因可表达于机体的多种组织中,在平滑肌细胞中的表达水平较高[11-12]。MYPT1在肿瘤进展中发挥着重要作用,可调控细胞周期、侵袭和转移[13]。研究表明,MYPT1在胃癌和前列腺癌组织中的表达水平较低;过表达MYPT1可抑制胃癌细胞增殖和转移,而抑制MYPT1表达可促进人前列腺癌血管生成,并影响患者预后[14-15]。由此推测,检测HCC组织中MYPT1的表达水平可能有助于了解患者的预后情况。
本研究采用蛋白质印迹法检测HCC组织及癌旁组织中MYPT1的表达水平,结果显示MYPT1在HCC组织中的表达水平低于癌旁组织,这提示MYPT1可能参与了HCC的发病及进展过程。本研究结果显示,肿瘤直径≥5 cm、Child-Pugh分级为B级、AFP≥40 μg/L和存在血管侵犯的HCC患者肿瘤组织中MYPT1的表达水平较低,这提示MYPT1可能通过调节HCC患者肿瘤细胞的增殖、侵袭、转移及AFP水平,进而参与HCC的发病和进展,并影响HCC患者的预后生存情况。本研究构建了MYPT1预测HCC患者预后生存情况的ROC曲线,结果显示AUC、敏感度和特异度分别为0.895、71.83%和95.24%,这提示MYPT1预测HCC患者的预后生存情况具有较高效能,但敏感度较低。此外,本研究结果显示,MYPT1高表达组的中位生存时间长于低表达组,进一步表明MYPT1与HCC患者的预后生存关系密切,其表达水平越高提示HCC患者的预后生存期越长。杜培源等[16]研究指出,存在微血管侵犯的HCC患者发生预后不良的风险较高,其是HCC患者术后生存的独立危险因素。本研究采用单因素和多因素Cox比例风险回归模型分析影响HCC患者预后生存的相关因素,结果显示血管侵犯是HCC患者预后生存的独立危险因素,与上述研究结果相符。此外,本研究结果还显示MYPT1是HCC患者预后生存的独立保护因素。
综上所述,MYPT1在HCC组织中低表达,且MYPT1表达水平越低,提示HCC患者预后生存期越短。检测HCC组织中MYPT1的表达水平有助于预测患者的预后生存情况,为临床治疗提供参考。本课题组今后将进一步探究MYPT1参与HCC发病和进展的病理、生理机制。

