基线18F-FDG PET/CT最大标准摄取值与B细胞非霍奇金淋巴瘤临床疗效及预后的关系
郭晓川 张伟京 王 斌 王伟霞 黄乐富 曹宝平 仲凯励
(首都医科大学附属北京世纪坛医院淋巴肿瘤科,北京 100038)
我国一项多中心研究[1]显示,约66%的淋巴瘤患者为B细胞非霍奇金淋巴瘤,其中弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)和滤泡性淋巴瘤患者(follicular lymphoma, FL)分别占所有B细胞非霍奇金淋巴瘤的50.18%和8.3%。目前18氟-氟代脱氧葡萄糖-正电子发射计算机断层显像/电子计算机断层扫描(18F-flurodeoxyglucose positron emission tomography/computed tomography,18F-FDG PET/CT)是淋巴瘤治疗前分期的常用检查方法,已成为DLBCL及FL3级患者诊断和分期的Ⅰ级专家推荐。与过去以增强CT为分期检查相比,18F-FDG PET/CT改变了20%~40%患者的临床分期,从而使5%~15%的患者调整了治疗方案[2]。18F-FDG摄取程度与肿瘤的生物学行为密切相关,最大标准化摄取值(maximum standard uptake value, SUVmax)是衡量18F-FDG摄取的常用指标之一。研究[3]显示,非霍奇金淋巴瘤的高度侵袭性及瘤细胞的快速增殖与18F-FDG高摄取率有密切的联系。同时,18F-FDG PET/CT显像也已经被引入到淋巴瘤疗效的评价标准当中。18F-FDG SUVmax在临床应用中与疗效及预后的关系受到广泛关注。
本研究通过对近几年于首都医科大学附属北京世纪坛医院淋巴肿瘤科就诊的初治B细胞型非霍奇金淋巴瘤患者的PET/CT中SUVmax进行分析,评估基线SUVmax数值对治疗的疗效及预后的预测价值。
1 对象与方法
1.1 研究对象
收集2016年8月至2019年9月首都医科大学附属北京世纪坛医院收治且临床资料完整的初治非霍奇金淋巴瘤患者(B细胞型)47例作为研究对象。纳入标准:组织病理学确诊为非霍奇金淋巴瘤,弥漫大B细胞淋巴瘤及滤泡性淋巴瘤;初治时行PET/CT基线检查;接受至少4周期RCHOP(利妥昔单抗注射液、环磷酰胺、多柔比星、长春新碱、泼尼松龙片)或RCHOP样方案治疗;有疗效评估记录及长期随访记录。排除标准:基线检查时合并活动性感染;合并免疫抑制状态,如人类免疫缺陷病毒(human immunodeficiency virus,HIV)阳性;既往有恶性肿瘤病史;原发中枢神经系统淋巴瘤。
1.2 资料收集
收集资料的内容包括年龄、性别、Ann Arbor临床分期、ECOG评分、乳酸脱氢酶(lactic dehydrogenase,LDH)、β2微球蛋白、血红蛋白含量、骨髓受侵、结外受累器官、免疫组织化学指标、治疗中期疗效(2或4周期治疗后)等指标。
1.3 治疗方法和疗效评价
所有患者均接受RCHOP或RCHOP样方案治疗,至少4周期。44例患者接受RCHOP方案、1例患者接受REPOCH(利妥昔单抗注射液、环磷酰胺、多柔比星、长春新碱、依托泊苷、泼尼松龙片)方案、1例患者接受CHOPE方案(环磷酰胺、多柔比星、长春新碱、泼尼松龙片、依托泊苷)、1例患者接受利妥昔单抗注射液单药靶向治疗。治疗2或4周期后进行影像学检查评估中期疗效。疗效评价采用2014版Lugano会议修订的标准[4]:完全缓解(complete response, CR)、部分缓解(partial response, PR)、稳定(stable disease, SD)、进展(progressive disease, PD)。
1.4 随访及疗效评价
通过查询病历、向经治医生咨询及电话随访等方式对患者进行跟踪随访。所有病例均随访至2020年10月1日,中位随访时间22.8个月。记录无进展生存时间(progression-free survival, PFS)、总生存期(overall survival, OS)。所有患者签署了知情同意书。
1.5 显像方法
PET/CT设备为Discovery 710型(美国通用电气公司,FWHM4.2 mm),32D模式采集,采集时间2 min/床,共采集8~9个床位,Hanning滤波,截止频率0.4 cycle/pixel。患者检查前禁食至少6 h,静脉注射18F-FDG,显像剂购自中国原子能科学研究院,制备步骤可分为共沸蒸发、亲核取代、水解去保护、纯化处理及无菌过滤等步骤,放射化学纯度不低于90%,剂量为3.7~5.55 mBq/kg(0.1~0.15 mCi),后静卧休息1 h,排空膀胱,后以2.5 min/床位进行扫描,扫描范围从头顶至大腿上段1/3。CT扫描参数:管电压140 kV,管电流恒定,为140 mA。将PET和CT进行图像融合显示。
1.6 图像分析
由2名有经验的核医学科医生(1名住院医师、1名副主任医师)进行阅片,若出现分歧,需先排除技术问题,再进一步科内集体阅片后诊断。观察病变位置、大小、形态、密度等,采用感兴趣区(region of interest, ROI)技术,由计算机计算SUV。SUVmax记录的是每例患者病灶代谢的最高值。
1.7 统计学方法
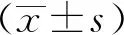
2 结果
2.1 临床基础特征间基线SUVmax水平比较
表1为不同临床因素间基线SUVmax水平比较结果。结果显示,一年内有进展的患者基线SUVmax水平高于无进展的患者,差异有统计学意义(P<0.05);而患者的年龄、性别等其他临床特征间基线SUVmax水平差异均无统计学意义(P>0.05)。
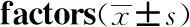
表1 SUVmax与临床因素相关性分析Tab.1 Correlation between SUVmax and clinical
2.2 临床病理特征间基线SUVmax水平比较
表2为基线SUVmax与病理指标相关性分析。其中,39例患者病理确诊为DLBCL、8例患者病理诊断为FL,DLBCL患者基线SUVmax高于FL患者,差异具有统计学意义。免疫组织化学指标:BCL-2、BCL-6、C-MYC、CD5等并未表现出与基线SUVmax的相关性。
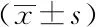
表2 SUVmax与病理指标相关性分析
2.3 基线SUVmax临界值的确定
所有患者中,9例患者1年内出现进展,截至随访结束,17例患者出现疾病进展。
以1年内患者病情是否进展分组,基线SUVmaxROC曲线及面积见图1,曲线下面积为0.716,95%CI为0.558~0.874,差异有统计学意义(P=0.045),从ROC曲线的界点得出18F-FDG PET/CT显像基线SUVmax最佳界点为14.4。
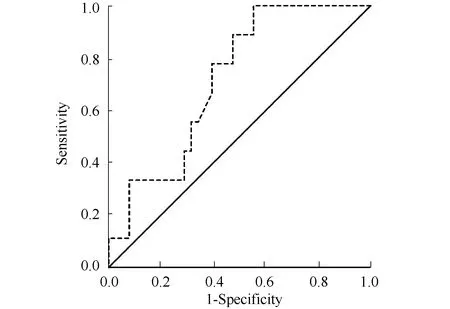
图1 以1年内是否进展为界限,对基线SUVmax进行ROC曲线分析Fig.1 ROC curve analysis in 1-year progression prediction according to baseline SUVmax in all patients SUVmax: maximum standard uptake value; ROC: receiver operating characteristic.
以随访结束时,即中位随访时间22.8个月患者有无疾病进展分组,基线SUVmaxROC曲线及面积见图2,曲线下面积为0.723,95%CI:0.572~0.873,差异有统计学意义(P=0.012),从ROC曲线的界点得出18F-FDG PET/CT显像基线SUVmax最佳界点为16.7。
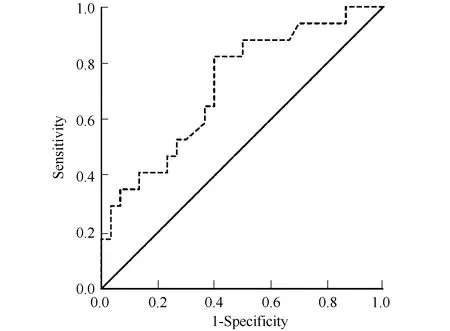
图2 以随访时间内是否进展为界限,对基线SUVmax进行ROC曲线分析Fig.2 ROC curve analysis in predicting PFS according to baseline SUVmax in all patients SUVmax: maximum standard uptake value; ROC: receiver operating characteristic; PFS: progression-free survival.
2.4 基线SUVmax与近期疗效、远期生存的关系
以基线SUVmax=14.4为界限值,SUVmax<14.4的患者22例,随访结束时,3例患者出现疾病进展。SUVmax≥14.4患者25例,其中14例患者出现疾病进展。SUVmax<14.4组患者的中位PFS为(35.6±2.1)个月,SUVmax≥14.4组的患者中位PFS为(18.0±2.4)个月,两组相比差异具有统计学意义(P=0.002),详见图3。
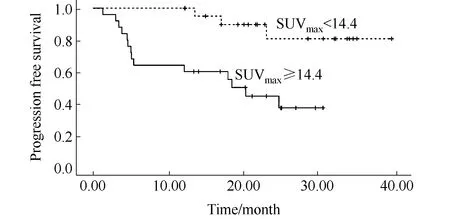
图3 SUVmax=14.4分层对PFS的影响Fig.3 Effect of SUVmax=14.4 on PFS SUVmax=14.4 was used for grouping. The dotted line represented the patients with SUVmax<14.4, while the real line represented the patients with SUVmax ≥ 14.4.The difference between two groups was statistically significant, P=0.002. PFS: progression-free survival; SUVmax: maximum standard uptake value.
随访结束时,两组中分别有1例、5例患者出现死亡,SUVmax<14.4组患者的中位OS为(46.0±2.6)个月,SUVmax≥14.4组的患者中位OS为(27.5±1.8)个月,两组相比差异有统计学意义(P=0.028),详见图4。
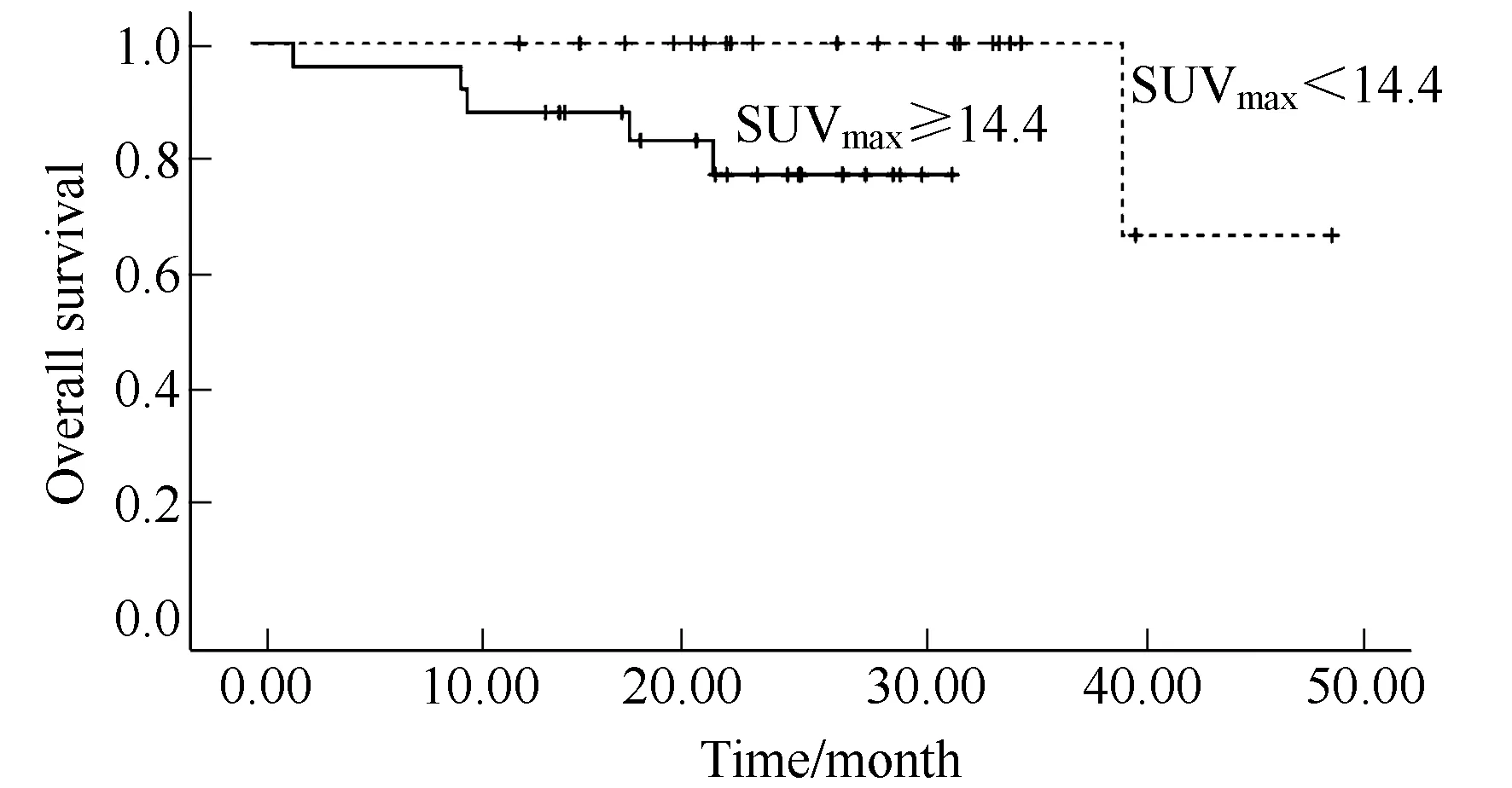
图4 SUVmax=14.4分层对OS的影响Fig.4 Effect of SUVmax=14.4 on OS SUVmax=14.4 was used for grouping. The dotted line represented the patients with SUVmax<14.4, while the real line represented the patients with SUVmax≥14.4.The difference between two groups was statistically significant, P=0.028. SUVmax: maximum standard uptake value; OS: overall survival.
以基线SUVmax16.7为界限值,SUVmax<16.7患者19例,随访结束时,3例患者出现疾病进展。SUVmax≥16.7患者28例,其中14例患者出现疾病进展。SUVmax<16.7组患者的中位PFS为(34.1±2.9)个月,SUVmax≥16.7组的患者中位PFS为(21.6±2.5)个月,两组相比差异具有统计学意义(P=0.025),详见图5。
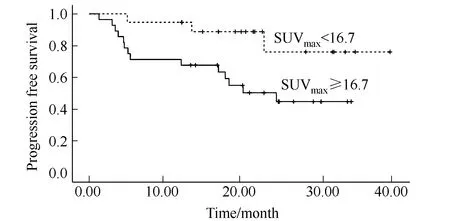
图5 SUVmax=16.7分层对PFS的影响Fig.5 Effect of SUVmax=16.7 on PFSSUVmax = 16.7 was used for grouping. The dotted line represented the patients with SUVmax<16.7, while the real line represented the patients with SUVmax≥16.7. The difference between two groups was statistically significant, P=0.025. SUVmax: maximum standard uptake value; PFS: progression-free survival.
随访结束时,两组中分别有2例、4例患者出现死亡,SUVmax<16.7组患者的中位OS为(38.3±1.6)个月,SUVmax≥16.7组的患者中位OS为(43.3±2.7)个月,两组相比差异无统计学意义(P=0.584)。
3 讨论
淋巴瘤尤其是DLBCL具有明显的分子异质性,相同评估标准下制定的相同方案可能会出现不同的生存结局[5]。PET/CT检查是评估淋巴瘤患者疗效及预后的研究热点,是目前淋巴瘤临床评估分期、疗效及预后的主要方法。PET/CT对常见类型的淋巴瘤,如DLBCL、FL诊断的灵敏度和特异度分别达80%和90%[6]。目前针对SUVmax的研究颇多,包括不同的淋巴瘤病理类型,如DLBCL、FL[7-8]、外周T细胞淋巴瘤[9]、套细胞淋巴瘤[10-11]等。研究[12-13]表明,较高的基线SUVmax数值反映了肿瘤细胞的增殖能力较强,生存预后相对较差。一项回顾性研究[14]显示,18F-FDG SUVmax是评估复发/难治性DLBCL疗效及预后的有力指标,97%的DLBCL病灶高度摄取18F-FDG,能够较早地判断淋巴瘤患者的个体化治疗疗效及预后。但是并非所有研究都证实了基线SUVmax的预后预测价值。Gallicchio等[15]的研究显示,淋巴瘤细胞呈现较高的基线SUVmax数值,可能对化学药物治疗的敏感性更强,相反可能会有较长的中位PFS;而Adams等[16]的研究显示基线SUVmax并没有相关的预后预测作用。
PET/CT18FDG摄取程度与葡萄糖的代谢、肿瘤增殖、病理学类型及分化程度都存在相关性[17]。本研究显示LDH浓度、1年内是否进展、病理类型与基线SUVmax有一定的相关性,而并未发现Ki-67、BCL-2、BCL-6、C-myc、CD5等免疫组织化学指标的表达与基线SUVmax值有相关性。有研究[18]证实,LDH、红细胞沉降率(erythrocyte sedimentation rate, ESR)等化验指标是淋巴瘤患者独立预后指标,且治疗后的18FDG SUVmax摄取值与LDH、ESR及C反应蛋白(C reactive protein,CRP)水平密切相关。由此可见,基线SUVmax对于淋巴瘤的疗效评估及预后可能具有一定的研究价值。
基线检查时较高的18F-FDG SUVmax摄取值提示预后不良,有文献[19]显示根据ROC曲线选取可以评估预后的SUVmax阈值不尽相同,18F-FDG SUVmax范围为6.0~15.0。本研究中,对于1年内有无进展而言,SUVmax界值为14.4,而对于随访时间内有无进展而言,SUVmax界值为16.7,两个临界值的差值较小,可能与随访时间相对短、样本量较少、只有3例患者SUVmax介于14.4与16.7之间等相关,但一定程度上反映了基线SUVmax对淋巴瘤患者实行个体化治疗方案的制定具有一定的指导意义及判断价值。
以SUVmax=14.4或SUVmax=16.7为界限值,中位PFS差异均有统计学意义,SUVmax低于14.4的患者中位PFS具有明显的优势。随访结束时,SUVmax<14.4组患者的中位OS优于SUVmax≥14.4组患者,虽然影响患者生存预后的混杂因素较多,但一定程度上也表明基线SUVmax水平对于患者生存的预测预后价值。2018年一项DLBCL患者的研究[20]中,18F-FDG最佳阈值为SUVmax=8.77,亚组分析,发现中位PFS、中位OS差异均具有统计学意义。本研究与此研究的差异在于入组患者标准不同,中位随访时间相对较短,且这两个研究均为临床回顾性研究,混杂因素较多,虽然最终得出的有统计学意义的SUVmax阈值有一定的差异,这两个研究对于疗效及生存预后的影响均得出了差异有统计学意义的结果。说明基线SUVmax水平对B细胞淋巴瘤患者的疗效及预后有一定的预测价值。
本研究还具有一定的局限性:单中心回顾性研究,例数较少,混杂因素较多;SUVmax只体现了某个瘤结节最明显的代谢活性,并不能代表全部肿瘤的代谢活性。另外SUVmax还受局部炎症、血清葡萄糖浓度等因素影响。
总之,本研究结果表明,基线18F-FDG PET/CT检查的SUVmax对于B细胞型非霍奇金淋巴瘤患者的疗效及生存预后有密切关系,具有很大的临床应用价值。

