紫花苜蓿花朵中花色苷的提取及其微胶囊化
钟迪颖,武治兴,刘 阳,杨晓月,张有林
(1.陕西师范大学食品工程与营养科学学院,陕西 西安 710119;2.榆林市科技发展服务中心,陕西 榆林 719000)
紫花苜蓿(Medicago sativa)是多年生优质豆科饲草作物,原产于亚洲,如今广泛种植于世界各地,种植面积居世界第一,具有产量高、品质好和适用性广等优良特性,被誉为“牧草之王”[1-4],在中国西部、中部和华北地区大面积种植[5],资源丰富。紫花苜蓿花朵中富含花色苷。花色苷是花青素和糖以糖苷键连接而成的化合物[6],主要存在于植物的果实、花朵、茎和叶等部位[7],可赋予植物红色、紫色和蓝色等绚丽的颜色[8],是一种天然的水溶性色素[9]。近年来,国内外学者对花色苷进行了广泛研究,发现其具有抗氧化和抗炎等保健功能[10-11],但关于紫花苜蓿花朵中花色苷的研究甚少[12]。据报道温度和光照等条件影响花色苷稳定性[13-14],造成花色苷应用的局限性[15]。微胶囊化是一种将活性成分包埋在特定壁材中的技术[16],可以提高活性物质的稳定性,延长物质的保存期[17],随着科学水平的进步,目前微胶囊化技术已成为21 世纪的重点高新技术之一,被广泛应用于食品、药品和化妆品等多个领域[18]。为此,采用超声辅助乙醇提取法对紫花苜蓿花朵中的花色苷进行提取,通过响应面法优化提取工艺对花色苷进行微胶囊化处理,以提高紫花苜蓿花朵中花色苷的稳定性和贮藏性,为提高紫花苜蓿利用率和开发新型食品着色剂提供技术方法。
1 材料与方法
1.1 紫花苜蓿花朵中花色苷提取
采摘新鲜紫花苜蓿花,去梗,于−60 ℃下真空冷冻干燥32 h,粉碎过0.425 mm 筛,制得紫花苜蓿花粉末,置于−18 ℃下保存备用。
准确称取紫花苜蓿花粉末,按一定液料比、乙醇浓度、提取温度、提取时间,在超声功率为250 W条件下进行超声辅助提取,用浓度为0.1%的盐酸调节pH 至1.5,提取液冷却后在4 ℃低温8 000 r·min−1高速离心10 min 后取上清液,真空抽滤后得紫花苜蓿花朵中花色苷粗提物,35 ℃旋转蒸发至膏状,预冻24 h 后于−60 ℃条件下真空冷冻干燥得紫花苜蓿花色苷。
1.2 花色苷含量的测量方法
参照Urszula 等[19]和宋德群等[20]的方法,以花色苷粗提物为样品计算花粉末中花色苷的含量,分别 取1.0 mL 样品加入9.0 mL 的0.025 mol·L−1的氯化钾缓冲液(pH 1.0)和0.4 mol·L−1的乙酸钠缓冲液(pH 4.5),振荡摇匀,室温条件下避光放置30 min,以蒸馏水为空白对照,在520 和700 nm 波长下测定吸光度。
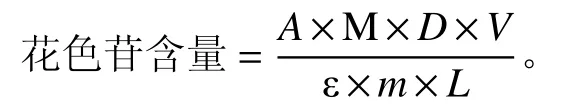
式中:A=A1−A2(A1和A2分别为pH 1.0 和4.5 时,样品在520 与700 nm 处的吸光度的差值);M为矢车菊-3-葡萄糖苷的相对分子量(449.2 g·mol−1);D为样品的稀释倍数;V为提取液总体积(mL);ε为矢车菊3-葡萄糖苷的消光系数26 900 L·(cm·mg)−1;m为紫花苜蓿花粉末质量(g);L为光程(cm)。
1.3 花色苷提取单因素试验
液料比:准确称量100 mg 紫花苜蓿花粉末,以提取剂为60% (V : V)乙醇,提取温度为60 ℃,提取时间为30 min,分别研究液料比为20、25、30、35 和40 mL·g−1对花色苷提取的影响。
乙醇浓度:准确称量100 mg 紫花苜蓿花粉末,液料比20 mL·g−1,提取温度60 ℃,提取时间30 min,分别研究乙醇浓度为40%、50%、60%、70% 和80%对花色苷提取的影响。
提取温度:准确称量100 mg 紫花苜蓿花粉末,液料比20 mL·g−1,乙醇浓度60%,提取时间30 min,分别研究提取温度为55、60、65、70 和75 ℃对花色苷提取的影响。
提取时间:准确称量100 mg 紫花苜蓿花粉末,液料比20 mL·g−1,乙醇浓度60%,提取温度60 ℃,分别研究提取时间为15、20、25、30 和35 min 对花色苷提取的影响。
花色苷响应面法优化试验设计:利用Box-Behnken 中心组合试验设计原理,以乙醇为提取剂,在上述单因素试验的基础上,选择液料比、乙醇浓度、提取温度和提取时间进行4 因素3 水平响应面优化试验设计(表1)。

表1 响应面优化试验设计因素与水平表Table 1 Response surface optimization design factors and levels
1.4 紫花苜蓿花色苷微胶囊化试验
微胶囊的制备:参照Cai 等[21]的方法。1) 壁材制备。第1 组:麦芽糊精(M)与黄原胶(H)按10 ꞉ 1、20 ꞉ 1 和30 ꞉ 1 (w : w)进行配比;第2 组:麦芽糊精(M)与阿拉伯胶(A) 按10 ꞉1、20 ꞉ 1 和30 ꞉1(w:w)进行配比,用蒸馏水制成胶体溶液,固体含量为5%(w : w),在4 ℃充分水合24 h。2) 花色苷制备。将紫花苜蓿花粉末按1.3 中得到紫花苜蓿花朵中花色苷最佳提取工艺条件进行超声波辅助乙醇提取,得到花色苷粗提液,低温旋转蒸发至膏状,预冻24 h 后于−60 ℃条件下真空冷冻干燥,得紫花苜蓿花色苷。3) 微胶囊制备。准确称取100 mg 紫花苜蓿花色苷,室温下溶于2.0 mL 蒸馏水中,加入8.0 mL 充分水合的壁材胶体溶液,在旋涡混合器3 000 r·min−1条件下充分混合5 min,之后转至培养皿预冻后冷冻干燥。制备的花色苷微胶囊分别命名为M/A(10/1)-ANS、M/A(20/1)-ANS 、M/A(30/1)-ANS、M/H(10/1)-ANS、M/H(20/1)-ANS 和M/H(30/1)-ANS。空白微胶囊作对照,为M-ANS。
微胶囊包埋率测定:参照Sahar 等[22]的方法。1) 总花色苷含量(TAC)测定:准确称量100 mg 包埋样品,加入1.0 mL 蒸馏水,在旋涡混合器中充分混合1 min,放入超声清洗机内水浴20 min,加入10.0 mL乙醇,提取5 min 后过滤。2) 表面花色苷含量(SAC)测定:准确称量100 mg 包埋样品,与10.0 mL 乙醇混合,在旋涡混合器中混合10 s,在3 000 r·min−1离心3 min 后取上清液。

扫描电子显微镜(SEM)观察:参考Amr 等[23]的方法。将样品均匀平铺于金属载物台,喷金处理60 s,共3 次,用环境扫描电子显微镜观察并拍摄微观结构。
色差测定:用色差仪测量样品的亮度(L)、红绿度(a*)和黄蓝度(b*),根据公式计算其色度(c)和色相角(h°)[21]。

热稳定性测定:在50 mL·min−1的氮吹扫流下,以10 ℃·min−1的温度上升速率在30~300 °C 范围内扫描约5 mg 样品。
X-射线衍射分析:参照Zhou 等[24]的方法。通过X-射线衍射仪对样品进行X-射线衍射(XRD)成像。以0.4 λ·min−1的扫描速度测试样品,记录2θ 在5°~70°的衍射图像。
贮藏特性:将包埋的微胶囊样品分别置于37 和5 ℃的恒温培养箱,每隔14 d 取样,测定花色苷含量。
1.5 数据处理
单因素试验数据采用OriginPro 软件处理,响应面试验数据采用Design Expert 软件处理,SPSS 软件进行显著性分析。
2 结果与分析
2.1 单因素试验结果分析
花色苷含量随液料比的增加呈先上升后趋于稳定的趋势,在液料比为30 mL·g−1时达到最大,可能是在适当的液料比条件下,提取剂用量的增加使花色苷与提取剂接触面积增大[25],促进花色苷的溶出,而当提取剂用量增加过多,花色苷溶出量已达最大值,同时导致糖类和脂类物质溶出[26],液料比以30 mL·g−1为宜。花色苷含量随乙醇浓度的增加呈先上升后下降的趋势,在乙醇浓度为60%时达到最大。可能是在低浓度条件下,乙醇浓度的增加使环境的渗透压增大,从而促进花色苷的渗出,而当乙醇浓度过高时,导致溶液的极性过低,不利于花色苷的溶出[27],乙醇浓度以60%为宜。花色苷含量随提取温度的增加呈先上升后下降的趋势,在提取温度为65 ℃时达到最大,可能是在适当的温度条件下,细胞内的花色苷易溶出,温度过高时,破坏了花色苷的结构,导致花色苷的提取量降低,提取温度以65 ℃为宜。花色苷含量随提取时间的增加呈先上升后下降的趋势,在提取时间为25 min 达到最大,可能是在适当的提取时间内,提取时间的增加使溶出的花色苷积累更多,提取时间过长时,部分花色苷被氧化、降解,从而导致花色苷的提取量降低,提取时间以25 min 为宜(图1)。

图1 不同液料比、乙醇浓度、提取温度、提取时间对紫花苜蓿花粉末花色苷提取效果的影响Figure 1 Effects of different liquid-to-material ratios, concentration of ethanol, and extraction temperature and time on extracting anthocyanins from alfalfa flower powder
2.2 响应面优化试验设计及结果分析
在单因素试验的基础上进行BBD 响应面优化试验设计(表2)。回归拟合后得到花色苷含量(Y)的二次多项回归模型Y=1.58 + 6.083 × 10−3A+7.833 × 10−3B+ 4.667 × 10−3C+ 1.917 × 10−3D+ 0.030AB−3× 10−3AC− 0.013AD+ 3.5× 10−3BC− 0.018BD+0.011CD− 0.023A2− 0.007 7B2− 0.057C2− 0.015D2。

表2 BBD 响应面优化试验设计与结果Table 2 BBD response surface optimization design parameters and results
该回归模型P< 0.001,模型极显著,失拟项不显著。R2= 0.990 3,RAdj2= 0.980 5,说明该回归模型与试验数据拟合较好,可用于紫花苜蓿花粉末花色苷含量的分析。该模型Y中A、B、AB、AD、BD、CD、A2、B2、C2和D2对结果影响极显著,C对结果影响显著(表3)。
各响应面曲线走势越陡,说明液料比、乙醇浓度、提取温度和提取时间的交互作用对提取花色苷影响越显著[28]。可以看出,影响作用表现为乙醇浓度 > 液料比 > 提取温度 > 提取时间(表3、图2)。

图2 各因素交互作用的响应面分析图Figure 2 Response surface evaluations of the interactions among these factors

表3 紫花苜蓿花粉末中花色提取量方差分析Table 3 Analysis of the extraction values for anthocyanins from alfalfa petal powder
2.3 最佳提取条件优化
紫花苜蓿花粉末中花色苷最佳提取工艺条件为液料比31.11 mL·g−1、乙醇浓度60.53%、提取温度65.15 ℃、提取时间24.56 min。考虑到实际操作的可行性,将以上工艺条件调整为液料比31 mL·g−1、乙醇浓度61%、提取温度65 ℃、提取时间25 min。在此条件下又进行了3 组平行试验,得出紫花苜蓿花粉末中花色苷含量为1.581 mg·g−1,该实际值与理论值接近且稳定,获得的最佳工艺条件可靠。
2.4 紫花苜蓿花色苷微胶囊化
2.4.1 紫花苜蓿花色苷微胶囊包埋率与色差分析
加入水胶体的微胶囊包埋率均高于空白对照,原因是加入水胶体改变了淀粉特性,增大了壁材粘度,使之带来更好的封装效率与致密性,但粘度达到一定程度再增加粘度对包埋影响不大。与单一材料相比复合材料更能提高微胶囊的稳定性,包埋效果最好的是M/H(30/1)-ANS,包埋率达到98.37% (表4)。

表4 不同壁材的花色苷微胶囊包埋率及色差分析Table 4 Analysis of encapsulation efficiency and color differences in anthocyanin microcapsules produced using different wall materials
加入水胶体的花色苷微胶囊亮度均高于空白对照。不同壁材的紫花苜蓿花色苷微胶囊均为红色。
2.4.2 紫花苜蓿花色苷微胶囊SEM 图像分析
不同壁材的紫花苜蓿花色苷微胶囊均呈多孔状结构,这是冷冻干燥过程中水分升华引起的收缩力不均匀造成的(图3)。从微胶囊的表面形态来看,M/H(30/1)-ANS 和M/A(30/1)-ANS 的表面较M-ANS光滑,进一步证实了水胶体的加入可提高微胶囊的封装效率[29]。

图3 紫花苜蓿花色苷不同壁材微胶囊微观形态Figure 3 Morphology of various alfalfa anthocyanin microcapsules produced using different wall materials
2.4.3 紫花苜蓿花色苷微胶囊热稳定性及X-射线衍射分析
采用热重分析仪对几种不同壁材的微胶囊进行热重测定。麦芽糊精与黄原胶和阿拉伯胶相互作用影响了紫花苜蓿花色苷微胶囊的热稳定性。包埋的微胶囊受热后重量损失较小,热稳定性较好(图4)。花色苷的最大失重发生在115 ℃,这可能是由于花色苷的脱糖反应与开环反应使其降解成了酚酸和醛[30]。含有花色苷的微胶囊的最大失重在225 ℃,这可能是花色苷中糖环发生了脱水反应及CO2流失所致[31]。
一般晶体材料的衍射图呈尖峰,非晶体材料的衍射图呈宽峰[32]。M-ANS、M/A-ANS 和M/H-ANS的微胶囊衍射峰都呈宽峰状,且衍射图基本相同,表明结晶度较低,均为非晶结构(图4)。微胶囊的结晶度与流动性和吸湿性有关,结晶度越高则吸湿性越差,Diego 等[33]研究表明,非晶体结构材料的吸湿性要强于晶体材料。本研究表明,紫花苜蓿花色苷微胶囊后吸湿性提高。

图4 不同壁材微胶囊热重变化及X-射线衍射图Figure 4 Thermogravimetry and X-ray diffraction of microcapsules produced using different wall materials
2.4.4 紫花苜蓿花色苷微胶囊贮藏特性
所有花色苷微胶囊在 5 ℃的稳定性均比37 ℃的稳定性高,添加了黄原胶与阿拉伯胶的微胶囊比未添加水胶体的空白微胶囊稳定性更好,水胶体的添加比例对微胶囊的贮藏效果无影响。在5 和37 ℃条件下,紫花苜蓿花色苷经微胶囊化后的贮藏稳定性均优于未经微胶囊化的花色苷。综合分析,贮藏效果最好的是M/H(30/1)-ANS,其在5 ℃下贮藏28 d花色苷保留率达97.67% (图5)。

图5 紫花苜蓿花色苷不同壁材微胶囊的贮藏特性Figure 5 Storage characteristics of Medicago sativa anthocyanin microcapsules produced using different wall materials
3 讨论与结论
紫花苜蓿富含各种生物活性物质,花色苷的提取工艺研究已有文献报道。许英一等[12]用正交试验法研究了紫花苜蓿花色苷的提取工艺,在料液比为30 g·mL−1,提取温度为60 ℃,超声时间为10 min,提取的总花色苷含量为93.23 mg·(100 g)−1。但上述工艺的提取量低于本研究的1.581 mg·g−1,可见该工艺具有一定的推广应用价值。Box-Behnken 试验法相较于正交试验法,不仅能得到各因素与响应值的明确的函数关系式,而且能全面反映各因素之间的交互作用,确定各因素对响应值的影响顺序[34]。本研究中影响紫花苜蓿花朵中花色苷提取含量的因素表现为乙醇浓度 > 液料比 > 提取温度 > 提取时间。
微胶囊化是一种将活性物质包埋嵌入包埋材料中,形成具有致密物理屏障的微小颗粒的技术,其中被包埋的活性物质称为芯材,包埋在外部的包埋材料称为壁材。麦芽糊精是一种易溶解的淀粉水解物,粘度低,可以保持花色苷分子的稳定性,因而被广泛用作包埋材料。根据水解程度的不同可得到不同分子量的麦芽糊精,其中,葡萄糖当量(DE)在10~20 的麦芽糊精最常用于花色苷的包埋[16,35]。目前,麦芽糊精、阿拉伯胶等水溶性小分子化合物已成功地用作包埋花青素提取物的壁材[36-37],且大量研究证明,麦芽糊精与水胶体组合可以提高微胶囊的包埋效率[22,38-39]。黄原胶具有耐高温、耐酸碱、性能稳定等优点,是一种良好的包装材料。阿拉伯胶具有良好的成膜性和乳化性,可以保护花色苷不被氧化。Ewelina 等[40]以麦芽糊精和阿拉伯胶等水胶体为包埋壁材,对野樱桃中的花色苷进行微胶囊化,结果表明采用复合包埋壁材的花色苷微胶囊包埋效果好,微胶囊化是保持花色苷等敏感化合物稳定性的有效方法。Cai 等[21]以不同配比的羧甲基淀粉和黄原胶为包埋壁材,对蓝莓花色苷进行微胶囊化,结果表明蓝莓花色苷微胶囊均具有较高的包埋率,且微胶囊化后的蓝莓花色苷稳定性提高。Kanha等[41]采用喷雾 + 冷冻干燥复合方式,以两种不同的亲水胶体(明胶-阿拉伯胶和壳聚糖-羧甲基纤维素)为壁材制备黑米花色苷提取物的微胶囊,结果表明:采用明胶-阿拉伯胶和壳聚糖-羧甲基纤维素制备的微胶囊包埋率分别为84.9% 和94.7%,且具有良好的缓释作用。Ban 等[32]以壳聚糖和羧甲基纤维素为壁材,采用真空冷冻干燥法包埋生姜精油,结果表明制备的微胶囊具有较好的微观结构和包埋率,能保持较高的营养品质。微胶囊制备的常用方法有喷雾干燥法和冷冻干燥法,喷雾干燥具备快速、灵活、低成本等优点,但其进出风口的高温易破坏热敏类物质的分子结构,而真空冷冻干燥方式由于其干燥过程中隔绝氧气、低温等特点,更有利于热敏物质的结构保留[42]。本研究采用真空冷冻干燥方式制备的紫花苜蓿花色苷微胶囊,微胶囊包埋率高且贮藏效果较好。
本研究在单因素试验的基础上,依据Box-Behnken 组合试验设计原理和响应面法对紫花苜蓿花朵粉末中花色苷提取条件进行优化,得出花色苷最佳提取工艺条件为:液料比31 mL·g−1、乙醇浓度61%、提取温度65 ℃、提取时间25 min、超声功率250 W。在此条件下花色苷提取量为1.581 mg·g−1。以麦芽糊精、黄原胶和阿拉伯胶作为壁材,采用冷冻干燥方式对紫花苜蓿花色苷进行微胶囊化,不同壁材的包埋率差异显著,其中最优的壁材为麦芽糊精 ꞉ 黄原胶=30 ꞉ 1 (w : w),包埋率可达到98.37%。微胶囊化的紫花苜蓿花色苷比未微胶囊化的稳定性好,加入胶体的壁材比只用麦芽糊精作为壁材包埋效果及贮藏特性更优,微胶囊化为扩大紫花苜蓿花朵中花色苷的应用提供了方法。

