平原河湖系统中典型全氟化合物的胶体吸附特征及生态风险评估*
刘建超,郑超亚,任静华,陆光华,李一平
(1:河海大学环境学院,浅水湖泊综合治理与资源开发教育部重点实验室,南京 210098)(2:江苏省地质调查研究院,自然资源部(国土)耕地生态监测与修复工程技术创新中心,南京 210018)
全氟化合物(Perfluorinated compounds, PFCs)是一类人工合成的新型持久性有机污染物,具有一定的生物累积性、环境持久性和长距离迁徙性,其在化工、电子、纺织、制药、航空、电镀和合成洗涤剂等方面被大量使用[1-3]. PFCs能够通过多种途径进入环境,在地表水[4-5]、沉积物[6]、土壤[7]、野生动物[8]甚至人体[9]内广泛赋存,产生生殖毒性、神经毒性及致畸性,威胁生态安全及人类健康[10-12]. 作为两种主要的PFCs,全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)和全氟辛酸(perfluorooctanoic acid, PFOA)生产量和使用量最大,环境检出最为频繁,先后被列入斯德哥尔摩公约和美国环保署的限制生产排放协议[13]. 为了满足生产需要,包括中国在内的多个发展中国家仍在大量使用,导致PFCs成为危害我国生态环境的重要污染物,尤其是在长江三角洲地区、珠江三角洲地区、中北部工业区等. 我国长江流域氟化工业发达,该区域河流、湖泊以及水库中PFCs均有高频次的检出,检出浓度一般低于μg/L水平. 例如,长江重庆段16种PFCs的总浓度在1.54~61.93 ng/L(均值23.94 ng/L)[14],长江汉江段11种PFCs的总浓度为0.16~23.04 ng/L[15],长江中游的武汉段、洞庭湖、鄱阳湖、洪湖等区域,平均浓度达到了22.53 ng/L以上[16],到长江下游黄浦江水体中,14种PFCs浓度最高达到596.2 ng/L(平均浓度226.3 ng/L)[17]. 整个长江流域PFOS都是最主要的PFCs,下游水体污染程度明显高于上游. 流域对比来看,长江流域中PFCs污染水平高于太湖流域[18]、珠江流域[19]和乌梁素海流域[20],与韩国[21]、西班牙[22]部分河湖水域中PFCs浓度相当. 现有的研究大多集中在大江大河水体,平原地区不同受纳水体中PFCs的污染特征尚不明确.
目前PFCs在水环境介质中的调查主要集中在传统水相和沉积相,对于胶体介质的吸附影响研究还相当匮乏. 胶体介质具有体积小、比表面积大、吸附位点多等特点,能够有效吸附水中的有机化合物,并对其迁移、转化、生物有效性等环境行为产生重要影响[23-24]. 长江滨岸水体中胶体对新兴有机污染物的吸附贡献率可达42.3%,吸附作用与胶体的粒径、电位、类腐殖质等因素直接相关[24]. 泰州市姜堰区地跨长江三角洲和里下河平原,区域内河流湖泊众多,水产丰富,水资源利用类型多变,经济社会与环境保护协调发展,是我国建设的首批国家级生态示范区. 基于以上背景,本研究以姜堰区为完整研究区域,在农业区、工业区、养殖区、湿地区、城市区、农村居民聚集区等不同受纳类型河湖水体中开展4种典型的PFCs的定性定量分析工作,探讨其污染水平、成分组成、空间分布和胶体吸附潜能,并评价其生态风险,以期为生态示范区的水环境保护和有机污染物综合治理提供理论基础和参考依据.
1 材料和方法
1.1 标准品和试剂
4种PFCs标准品全氟辛酸(PFOA)、全氟壬酸(PFNA)、全氟正癸酸(PFDA)和全氟辛烷磺酸(PFOS)购买于Sigma-Aldrich试剂公司;正己烷、二氯甲烷、乙腈、甲醇、丙酮均为色谱纯试剂,购于美国Merck公司;Waters Oasis WAX 固相萃取小柱(200 mg, 6 mL),购于美国Waters公司;实验用水为Milli-Q纯净水.
1.2 采样点布设
在泰州市姜堰区共设置了33个采样点位,采样时间为2018年8月,采样时节为丰水期,天气情况良好,水温在25.0~28.6℃之间,每个点位采集水样2 L,平行样品2个. 采样点主要分布在7类区域,分别为水产养殖区(S1和S2)、溱湖湿地公园(S3~S5)、农业区(S6~S10)、农业/居民混合区(S11~S19)、居民聚集区(S20~S24)、工业区(S25~S29)和城市区(S30~S33),具体见图1.
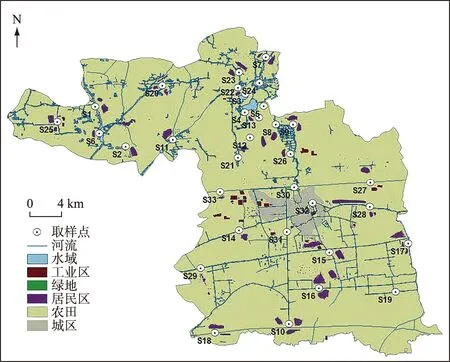
图1 江苏省泰州市姜堰区采样点布设示意Fig.1 Distribution of sampling sites in Jiangyan District, Taizhou City, Jiangsu Province
1.3 样品采集与前处理
在水面以下0.3~0.5 m范围内用准备好的聚丙烯采样瓶采集水样2 L,现场测定水质参数,采集后的水样过1.0 μm的醋酸纤维滤膜. 将过滤后的水样利用切向超滤装置和孔径为1000 Da聚醚砜过滤膜进行分离,以获得胶体相(1000 Da~1 μm)和超滤水相(<1000 Da). 胶体相和超滤水相加甲酸调至pH=2.5,用固相萃取装置萃取. 用5 mL甲醇、5 mL 0.1%(V/V)氨-甲醇溶液和5 mL超纯水活化WAX小柱,以2~2.5 mL/min的速率过样,经10 mL超纯水进行淋洗. 最后用5 mL甲醇和5 mL 0.1%(V/V)氨-甲醇溶液进行洗脱,洗脱液被收集到聚丙烯管中,氮吹至近干,用甲醇定容至1 mL,然后过0.22 μm滤膜,置于聚丙烯材质进样瓶中,低温冷藏待测.
1.4 仪器分析与质量控制
超高效液相色谱-三重四级杆串联质谱仪(配有电喷雾离子源), Waters ACQUITY UPLC Xevo TQ,美国Waters公司;ACQUITY BEH C18色谱柱(2.1 mm×100 mm, 1.7 μm,美国Waters公司). 流动相A为5 mmol/L的醋酸铵溶液,流动相B为100%乙腈;流动相梯度变化如表1所示.
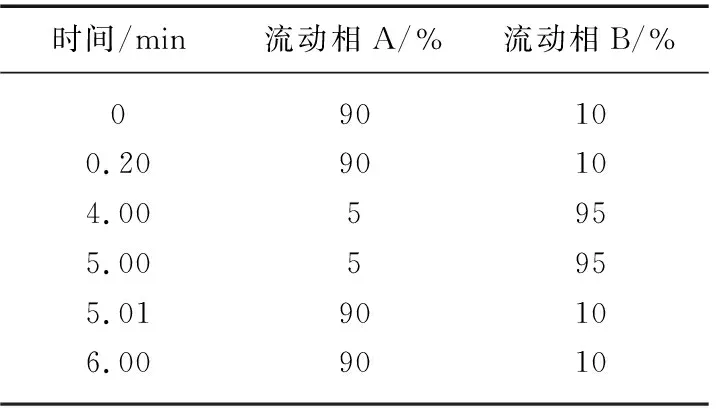
表1 流动相梯度变化Tab.1 Gradient change of mobile phase
采用正负离子模式的电喷雾(ESI)离子源以及多反应监测模式(MRM)定量分析目标污染物. 质谱仪条件:毛细管电压3.0 kV,碰撞气体流速0.16 L/min,离子源温度150℃;锥孔反吹气流量50 L/h;脱溶剂气温度400℃;脱溶剂气流量900 L/h目标微污染物的电离模式、母离子、子离子、碰撞能等质谱条件见表2.
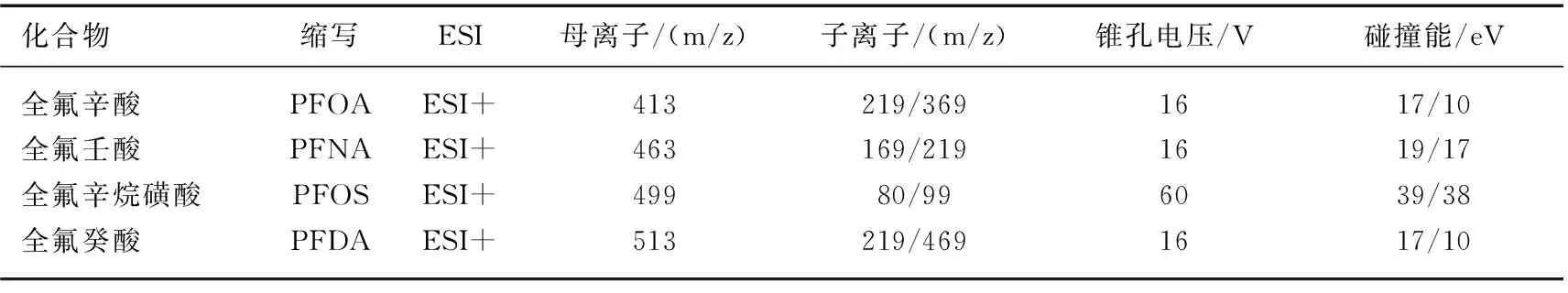
表2 目标化合物质谱参数Tab.2 Mass spectrum parameters of the target compounds
样品采集、样品前处理及样品分析整个过程遵循严格的质量控制程序. 采样过程设置野外现场空白. 每批样品添加一个方法空白、溶剂空白和空白加标样进行实时校正. 空白组的基质为去离子水,在现场空白、方法空白和溶剂空白中4种PFCs目标物均未检出或低于定量限. 标准曲线的浓度范围为 0.1~200 μg/L,线性相关系数R2>0.99,以3倍信噪比(S/N)确定方法检出限(LOD),4种PFCs的LODs在8.3~30.0 ng/L之间,在100 ng/L浓度水平下的加标回收率范围为68.9%~108.5%,满足分析要求.
1.5 数据分析方法
为评估水体中PFCs对水生生物的影响,采用风险熵值法(RQ)对PFOA、PFNA、PFOS和PFDA进行生态风险评价,RQ的计算方法为:
RQ=MEC/PNEC
(1)
式中,MEC和PNEC分别为环境介质中实测浓度和预测无效应浓度. 根据所选毒性数据和模式生物营养级的不同,PNEC需用不同的评估因子(AF)计算得到. 采用急性毒性数据EC50或LC50前提下,AF取值为1000;当选用长期或慢性无可观察效应浓度(NOEC)时,根据生物的营养级水平分别选取AF值为100、50和10. 由于慢性毒性数据缺失和有限的急性毒理数据,综合考虑毒性试验的标准程度和毒性终点的敏感性,PNEC采用评价因子法和基于物种敏感性分布的统计外推法获得,PFOA、PFNA、PFOS、PFDA对于藻类、溞类、鱼类的部分毒理数据见表3[25]. 通常按RQ的大小将污染物的生态风险水平分为 4 个级别,>1为高风险,0.1~1之间为中等风险,0.01~0.1之间为低风险,<0.01为无风险.
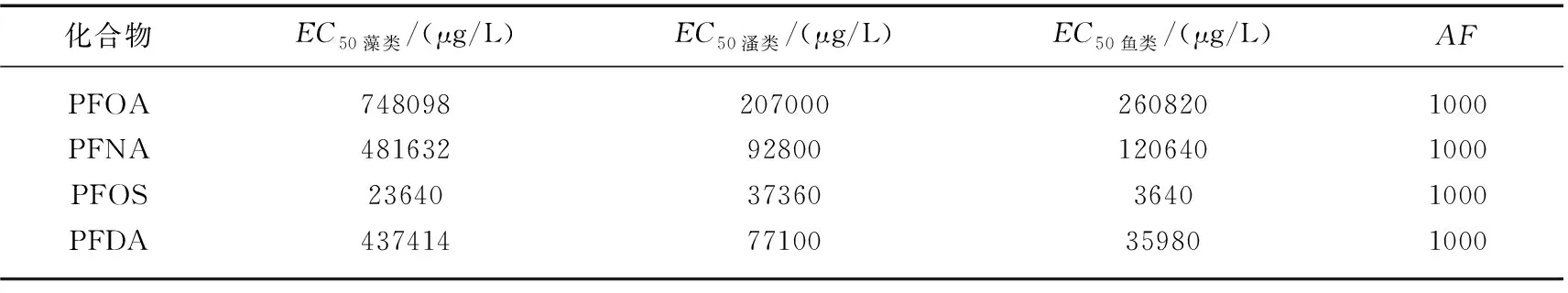
表3 4种PFCs对水生生物的毒理数据Tab.3 Toxicological data of four PFCs for aquatic organisms
2 结果与讨论
2.1 PFCs在传统水相中的分布特征
传统溶解相中4种PFCs的污染水平及空间分布特征见图2和表4. 从结果可知,4种PFCs中,PFOA、PFNA和PFOS的检测率最高,为100%,而PFDA则为78.8%. 4种PFCs的总浓度在12.5~92.1 ng/L之间,平均浓度为41.6 ng/L. PFOA作为最主要的污染物,其浓度范围为11.5~69.3 ng/L,平均浓度为28.7 ng/L. PFOS和PFNA浓度相当,最高浓度分别达到21.0和20.1 ng/L,平均浓度分别为7.7和3.6 ng/L. PFDA浓度最低,平均浓度为1.6 ng/L,最高达到13.0 ng/L. 从单体贡献率上来看,PFOA浓度占所有PFCs检出总浓度的70%以上,其次是PFOS(平均贡献率为18.5%)、PFNA(7.8%)和PFDA(2.8%). 相似的结果在我国千岛湖表层水和胶州湾表层海水中被发现,在这两个区域中PFOA是众多PFCs中检测频率和检出浓度最高的污染物,接近100%,在胶州湾海水中PFCs的总浓度在1.71~48.27 ng/L之间,PFOA平均浓度为16.41 ng/L,单体贡献率在29.2%~95.6%之间[26-27]. 这与PFCs的市场使用量和使用途径直接相关,PFOA和PFOS被广泛应用于石化行业、五金电镀、纺织品生产、橡胶乳化等工业制造和食品包装、纸类表面处理等生活用品生产,而PFNA和PFDA主要源于全氟羧酸生产过程的排放,使用量和使用途径相对偏低.
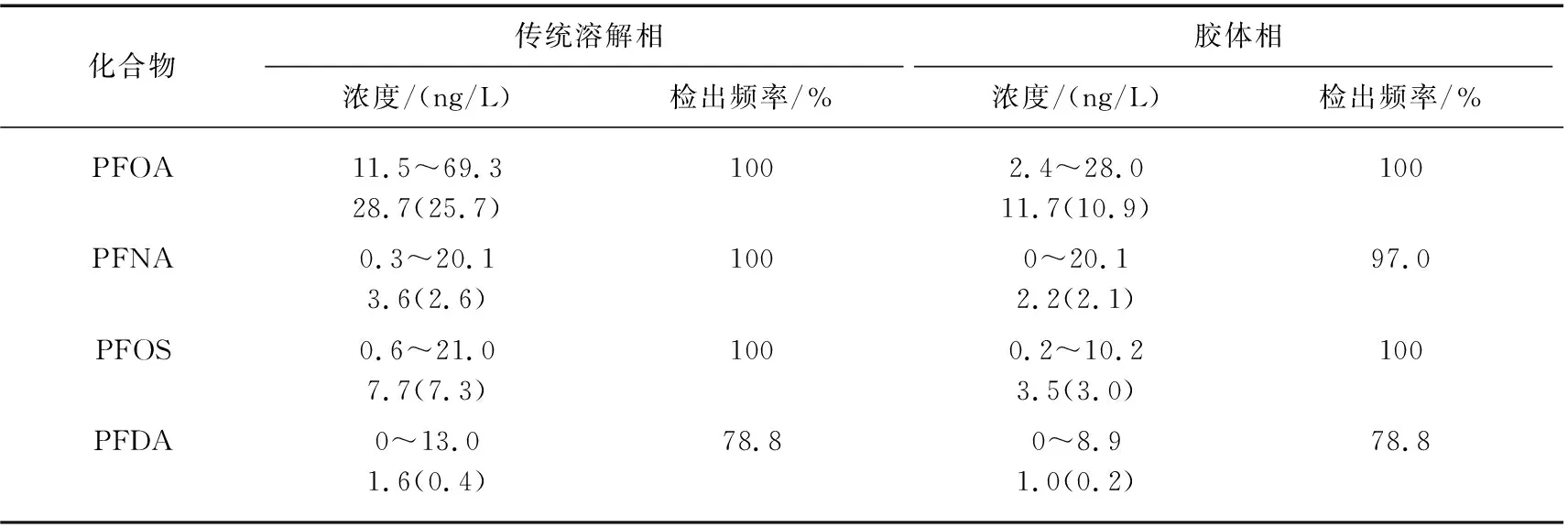
表4 姜堰区地表水中PFCs的浓度范围和平均值(中值)Tab.4 Concentration ranges and mean (median) values of PFCs in surface water from Jiangyan Districty
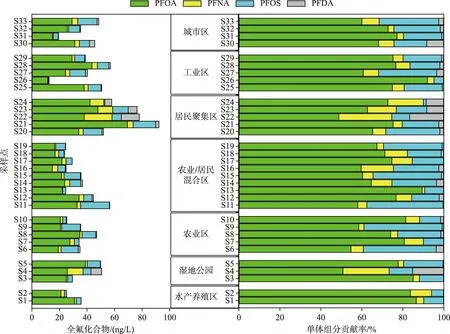
图2 PFCs在姜堰区地表水传统溶解相中的浓度及组分贡献率Fig.2 Concentrations and compositions of PFCs in traditionally dissolved phase of surface water from Jiangyan District
从空间分布来看,居民聚集区(S20~S24)污染水平最高,5个采样点的PFCs总浓度范围为51.9~92.1 ng/L,平均浓度为71.2 ng/L. 其中泰东河(S21)在所有采样点中检出浓度最高(92.1 ng/L),PFOA浓度达到69.3 ng/L,单体贡献率为75.2%. 泰东河是姜堰区最主要的主干河道,东接溱湖湿地,西连新通扬运河,沿岸居民聚集,支流汇入口众多,是该流域农业面源径流和居民生活污水的主要受纳水体,这可能是引起PFCs浓度偏高的主要原因. 溱湖湿地公园平均浓度为43.3 ng/L,显著低于居民聚集区,略高于其他几个研究区域. 溱湖湿地公园与泰东河水体连通,在水体交换过程中泰东河水体中的PFCs进入到湿地公园,可能是该区域PFCs相对偏高的原因. 其他研究区域(包括城市区、工业区、农业区、水产养殖区等)浓度相近,PFCs平均浓度在30~40 ng/L之间,其中PFCs浓度最高的为工业区(39.8 ng/L),污染浓度最低的是水产养殖区(30.4 ng/L). PFNA、PFOS和PFDA 3种单体的最高浓度均出现在居民聚集区或居民/农业混合区. 分析7个研究区域中4种PFCs贡献率,发现姜堰区所有采样点中4种PFCs贡献占比具有较高的相关性(0.999>R2>0.942,P<0.01),这说明姜堰区河湖水系中PFCs的污染来源具有相似性. 根据比值法对PFCs来源定性分析[28],在整个采样区域PFOS/PFOA值均小于1,这表明该区域降雨输入是最主要的污染途径,42%的点位PFOA/PFNA值在7~15之间,36%的点位PFOA/PFNA值大于15,这表明研究区域PFCs污染受工业排放和前驱体降解的双重作用,在水产养殖区、溱湖湿地、城市区PFCs的来源由前驱体发生降解主导,其他区域主要受工业点源排放的影响. 农村或乡镇居民聚集区相对于城市居民聚集区来说,PFCs污染更为严重,主要由于农村或乡镇区域的污水收集、处理能力偏弱,小型工厂零星分布. 另外,农村或乡镇居民聚集区水系中PFOA/PFNA均值为7.6,表明该区点源排放是PFCs污染的主导因素,而湿地公园PFCs污染应考量汇入河流的水质情况.
溱湖湿地是我国著名的国家级生态湿地公园,4种PFCs检出率接近100%,检出总浓度在29.4~50.6 ng/L之间,其中PFOA和PFOS是最主要的污染物,浓度范围分别为25.0~38.8 ng/L(平均浓度29.8 ng/L)和3.5~9.6 ng/L(平均浓度6.3 ng/L). 以PFOA和PFOS为目标,表5总结了溱湖湿地公园与其他淡水湖泊中两种污染物的污染水平. 从表5可以看出, PFOA在溱湖湿地中的污染水平显著低于白洋淀(2010)、武汉的东湖(2009)和汤逊湖(2011),与巢湖(2015)、太湖流域(2009)污染水平相当,显著高于千岛湖(2017)、深圳水库(2012)、官厅水库(2008)、鄱阳湖(2011)、意大利Maggiore Lake(2006)等水域. PFOS污染水平显著低于白洋淀(2010)、武汉东湖(2009)和汤逊湖(2011)、太湖(2009)、东莞同沙水库(2017)和韩国Shihwa Lake(2004),与巢湖(2015)、意大利Maggiore Lake(2006)和美国的Great Lake(2019)污染水平相当,显著高于鄱阳湖(2011)、官厅水库(2008)等水域. 总体上溱湖湿地公园中PFOA和PFOS的污染程度处于中等偏下水平.
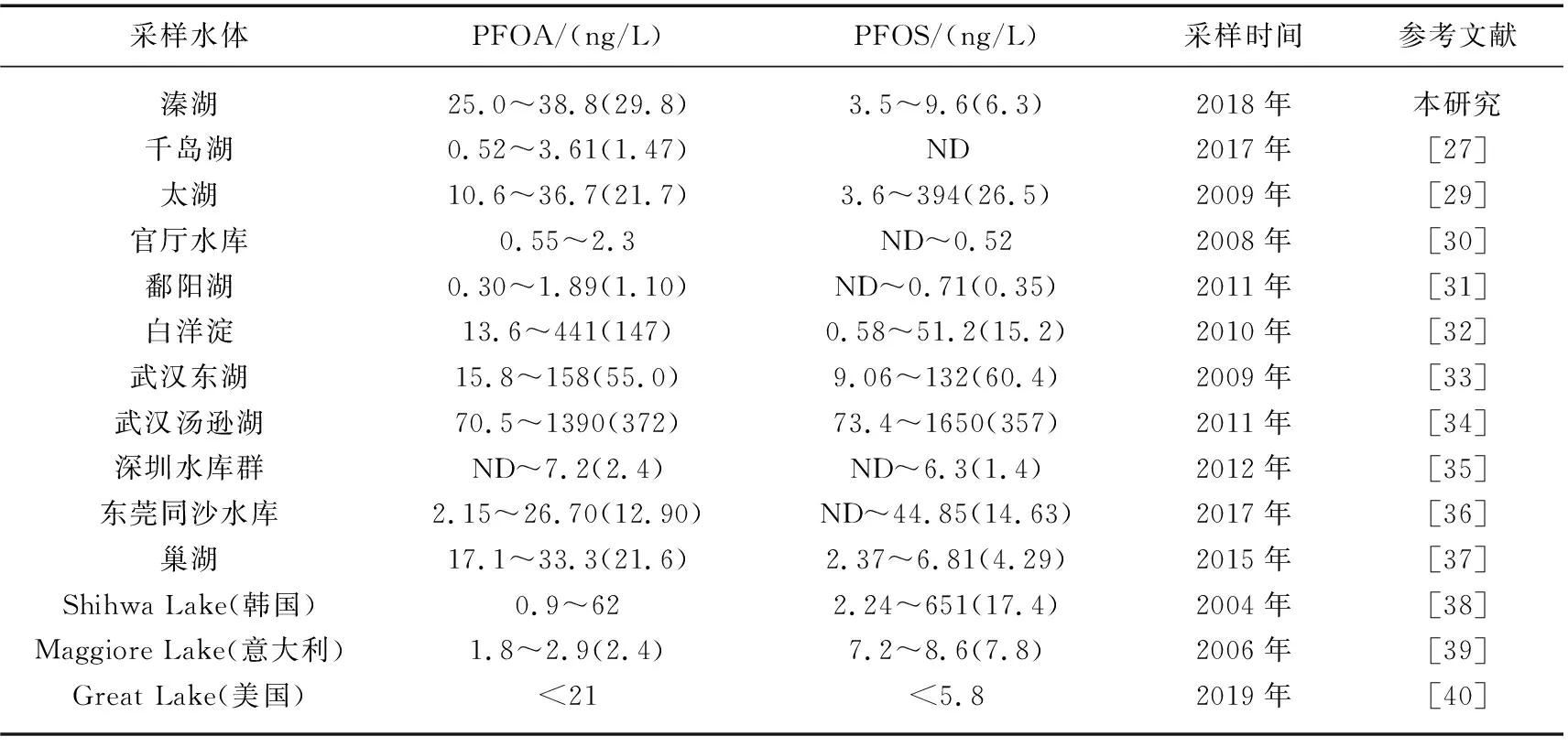
表5 溱湖湿地公园与全球部分地区淡水湖泊PFOA和PFOS浓度比较*Tab.5 Comparison of the concentration of PFOA and PFOS between Qinhu Wetland Parkand freshwater lakes around the world
2.2 PFCs在胶体相中的分布特征
胶体广泛存在于地表水环境中,是多种新型有机污染物的重要“汇”[41],能改变污染物在水环境中的迁移、转化、生物累积等多种环境行为,并对水生生物的生长产生重要影响[42-43]. 4种PFCs在胶体介质中的赋存状况见图3和表4. 在胶体相中,4种PFCs中均被检出,检出率为78.8%~100%,其中PFOA和PFOS检出率100%,PFNA次之(97%). 胶体相中PFCs的总浓度范围为5.4~49.9 ng/L. 与PFCs在传统溶解相中的单体分布相似,PFOA仍然是最主要的污染物,浓度范围为2.4~28.0 ng/L,其次是PFOS (0.2~10.2 ng/L)、PFNA (0~20.1 ng/L)、PFDA (0~8.9 ng/L),平均浓度分别为11.7、3.5、2.2和1.0 ng/L. 就单体组成而言,在胶体相中,PFOA的平均占比为66.6%,其次是PFOS(19.6%)、PFNA(9.9%)和PFDA(4.0%). 在太湖流域常熟地区平原河网中,PFOA、PFOS、PFNA和PFDA的平均浓度分别达到113.07、47.41、15.72和40.25 ng/L,高于姜堰区PFCs在胶体中的赋存水平,但成分组成占比与本文相似[44].
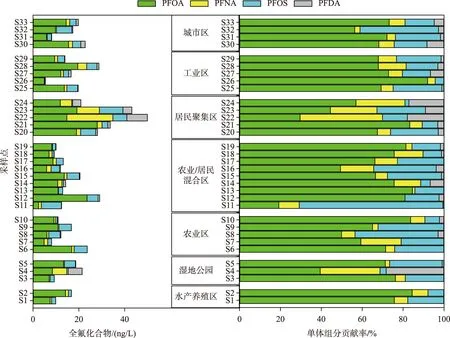
图3 姜堰区33个点位胶体相的PFCs浓度与组成Fig.3 Concentrations and composition of 33 PFCs in colloidal phase of Jiangyan District
从空间分布来看,居民聚集区地表水体中PFCs的赋存水平最高,总浓度达到35.1 ng/L,其他区域水体中PFCs总浓度相差不大,浓度范围为13.3~17.0 ng/L,最高浓度依然出现在姜堰区的主干河流泰东河(S22),位于传统溶解相PFCs污染水平最高点(S21)的上游,毗邻溱湖湿地公园. 与溶解相相比,该点位(S22)胶体相中的主要PFCs组分是PFNA和PFOA,浓度分别达到20.1和14.8 ng/L,单体贡献率分别为40.3%和29.6%,其次为PFDA(17.9%)和PFOS(12.2%),说明胶体中污染物的组成与溶解相略有区别,这可能与污染物物化性质等相关. 从7个区域河湖水系中PFCs的组成来看,4种PFCs的贡献占比具有相似性,除了居民聚集区和城市区中PFCs组分占比相关性稍低外(R2<0.88),其他区域组分贡献相关性均大于0.9,这说明在研究区域胶体相中4种PFCs与传统溶解相具有相似的赋存特性,而PFCs单体贡献率在城市和农村居民聚集区水系胶体中相关性偏弱的影响机制有待进一步研究.
2.3 PFCs在水体中的胶体吸附特征
为了评估胶体对PFCs的潜在影响,图4显示了胶体在传统溶解相中对PFCs的吸附潜能. 传统溶解相中,胶体对4种PFCs的平均吸附贡献率在42.6%~66.1%之间(图4A),其中胶体对PFDA的吸附潜能最大,吸附贡献率在35%~89%之间,平均值为66.1%,其次是PFNA(均值53.5%)、PFOA(47.0%)和PFOS(42.6%). 从空间分布来看,居民聚集区和水产养殖区水体中胶体对PFCs的吸附贡献率最大,分别达到57.4%和56.5%,其次是城市区(52.8%)、工业区(52.3%)、农业/居民混合区(50.3%)、农业区(49.5%)和湿地区(47.9%),这说明农村居民聚集区和水产养殖区水体中胶体对PFCs具有更高的吸附潜能,这可能与该区域的污废水直排和胶体性能有关. 研究发现污水和养殖废水能够改变水体中胶体的粒径分配,进而影响胶体对污染物的吸附潜能[24]. 在太湖流域常熟地区河网系统中,发现胶体对PFCs的吸附贡献率在45.46%~62.59%之间[44],胶体有机碳含量、颗粒粒径、电荷条件等因素是影响PFCs在水-胶体两相分配的主要原因,而与胶体浓度无明显相关. 与悬浮颗粒物相比,胶体对PFCs具有更高的吸附潜能[44],其吸附潜能比悬浮颗粒物高1~2个数量级[45]. 相似的结果在其他新型污染物中也被发现,传统溶解相中4%~45%的药物活性化合物和9.5%~50.4%的双酚类化合物被胶体介质吸附,胶体吸附潜能与物质的疏水特性和胶体有机质含量显著相关[45-46]. 胶体不仅具有较小的粒径、较大的比表面积,其较高的溶解性有机碳(DOC)含量,更有利于胶体对有机污染物的吸附作用[47]. 此外,胶体颗粒还存在Ca、Mg、Na和K等多种元素,可以通过静电作用和阳离子交换作用与PFCs等有机化合物稳定结合[28,47]. 本研究中胶体对PFCs吸附含量占传统溶解相PFCs总含量的50%左右,胶体对4种PFCs的吸附贡献率与其正辛醇-水分配系数(lgKOW)呈现显著的正相关(图4B). 这些研究结果表明在传统溶解相中胶体对多种有机污染物具有极强的吸附作用,化合物的疏水性能是影响水体中PFCs赋存和分配的主要因素之一. 胶体粒径较小、结合位点多,极易与有机污染物结合被水生生物摄取,且胶体具有较高的生物利用度,能够改变有机污染物的生物有效性[48-49],但胶体及其结合物生物效应改变的原因尚不明确,胶体对污染物的吸附机制研究仍需进一步加强.
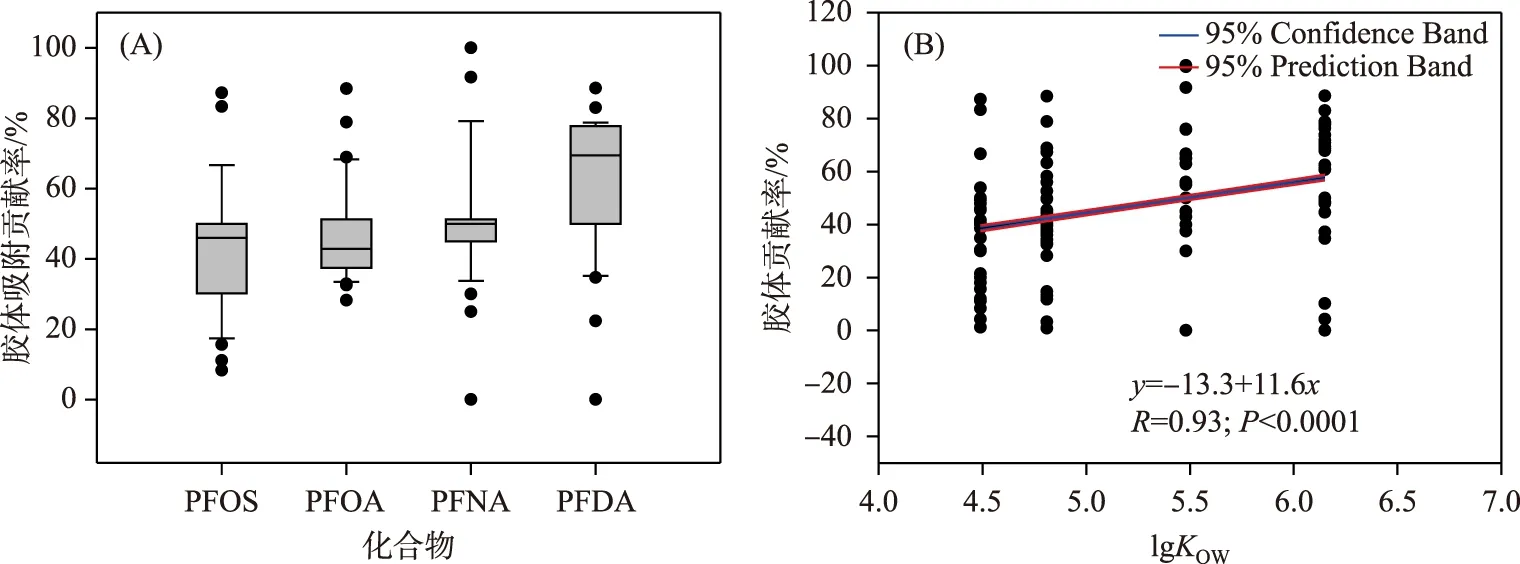
图4 地表水传统溶解相中胶体对PFCs吸附贡献率(A)及其与lgKOW的关系(B)Fig.4 Contribution rates of colloids to the PFCs (A) and the relationships between lgKOW and contribution rates (B) in traditionally dissolved phase of surface water
2.4 PFCs的生态风险评价
PFCs对生物具有毒性作用,长期暴露能够影响幼鱼的性腺发育,引起雌雄数量失调,对胚胎生长、生殖和后代发育产生不利影响,甚至个体死亡[50-52]. 根据国内外生态风险评价进展,本研究主要基于熵值法和水质量基准进行量化表征. 根据本研究区域中4种PFCs在传统相的检出浓度(<70 ng/L)和评价因子法得到的PNEC(3640 ng/L 图5 研究区域传统溶解相中PFOS的生态风险值(RQPFOS)和PFOA、PFOS环境检出浓度与环境质量标准比值(DIPFOA和DIPFOS)Fig.5 RQPFOS, DIPFOA and DIPFOS of PFOA/PFOS in traditionally dissolved phase of surface water from study area 根据欧盟委员会设定的PFOS在淡水环境中的年均环境质量标准AA-EQSfw(0.65 ng/L),所有采样点中PFOS的污染水平均高于0.65 ng/L,环境检出浓度与AA-EQSfw的比值(DIPFOS)在0.9~32.3之间,接近60%的点位高出此标准10倍以上,最高达到32倍左右,但仍远低于最大允许浓度36 μg/L,这表明姜堰区水环境中PFOS对水生生物产生急性风险的概率较低,但长期慢性风险不容忽视. 这与我国天津滨海新区湿地公园PFOS生态风险水平相似,湿地公园中PFOS的浓度大于0.65 ng/L,低于最大允许浓度36 μg/L[22,54]. 根据Valsecchi等[55]计算的年均环境质量标准AA-EQSfw(0.1 μg/L),PFOA在所有采样点中的污染水平均低于0.1 μg/L,环境检出浓度与AA-EQSfw的比值(DIPFOA)在0.12~0.69之间,在姜堰区主要纳污河流泰东河流域PFOA污染水平接近年均环境质量标准值,存在一定的慢性生态风险,但均低于2220 μg/L的最大可接受浓度和EPA规定的饮用水中的限值(0.4 μg/L). 利用Valsecchi等提出的海水水生生物的浓度限值[55],王世亮等对山东省20个滨海旅游度假区水体中PFOA和PFOS污染水平进行风险评估,发现该区域水体中PFOA和PFOS污染水平均高于欧盟规定的保护海洋生物的浓度限值,PFOS和PFOA造成的生态毒理风险不容忽视,建议加强立法与污染管控[56]. 在传统溶解相和胶体相中,PFOA、PFNA、PFOS和PFDA均被检出,检出率在78.8%~100%之间,总浓度范围分别为12.5~92.1和5.4~49.9 ng/L. PFOA是溶解相和胶体相最主要的PFCs,贡献率在65%以上. 从空间分布来看,居民聚集区水域中PFCs污染水平最高,其次是溱湖湿地公园、工业区、农业区及城市区,水产养殖区污染水平最低. 在传统溶解相中,胶体对PFCs的平均吸附贡献率在42.6%~66.1%之间,农村居民聚集区和水产养殖区水体中胶体呈现出较高的吸附潜能. 胶体对PFCs的吸附贡献率与其疏水特性呈显著正相关,传统溶解相中平均66.1%的PFDA吸附在胶体介质中. 从风险评价结果可知,PFOS对大部分水域中的水生生物产生低风险毒理影响. 此外,PFOS的污染水平均高于欧盟委员会设定的PFOS在淡水环境中的年均环境质量标准(0.65 ng/L),且PFCs具有累积特性和长距离传输能力,其长期的累积效应依然不容忽视.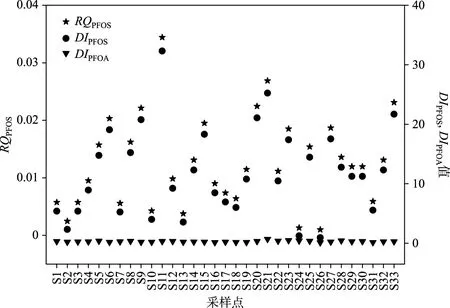
3 结论

