太湖贡湖湾人工湖滨带水生植物恢复及其富营养化控制*
姚 程,胡小贞,姜 霞,陈俊伊,王 坤
(1:北京师范大学水科学研究院,北京 100875)(2:中国环境科学研究院湖泊水污染治理与生态修复国家工程实验室,北京 100012)
湖滨带是湖泊、陆地生态系统之间的重要过渡区,具有拦截污染物、防止土壤侵蚀、提供栖息地等生态功能[1]. 由于污废排放、土地开发,湖滨生态系统正逐渐被破坏、侵蚀,逐渐失去了以上生态功能,加剧了湖泊富营养化等问题[2]. 湖滨带修复正是在此背景下提出,内容主要包括修复被破坏的湖滨景观,显著降低污染物浓度,恢复湖滨带生物多样性等[3]. 重建水生植物群落是湖滨带修复过程中最常用的技术手段, 例如加拿大锡姆科湖(Lake Simcoe)就采取重建沿岸水生植物群落的方式控制磷点源污染,捷克利普诺水库(Lipno Reservoir)沿坝体重建水生植物群落,恢复当地生物多样性,美化水库沿岸[4-5]. 我国近年来在太湖、巢湖、鄱阳湖等地开展的湖滨带生态修复项目中也广泛实施了水生植物群落重建[6-8].
水生植物在控制湖泊富营化方面发挥着重要作用. 洪湖湖滨带长期监测结果显示完整的沉水、挺水、浮叶植物群落提高了湖泊的自净能力,缓解了湖泊富营化趋势[9]. 在滇池、洱海湖滨带水生植物控制水体氮磷,抑制了藻类活动[10]. 沉水植物群落还可以稳定基底,减少水力扰动带来的沉积物再悬浮,提高水体透明度[11]. 室内模拟试验结果显示水生植物不但可以适应高氮磷环境,在生长过程中还能稳定同化氮磷元素,全生命周期内减缓氮磷循环速度[12-14]. 但是水生植物生长还受到水位以及自身习性的影响,例如水体富营养化压力下浮叶植物往往比沉水植物表现出更强的适应性[15-16]. 水生植物群落重建过程中的适应性以及氮、磷控制效果上的讨论仍在继续. 例如沉水植物生长一方面可以吸收水体中的可溶性磷,同时也会提高沉积物中磷的有效性,增加湖泊中磷的内源释放风险[17]. 尤其在退圩还湖、生态修复过程中人工构建湖滨带水生植物的适应性以及对水体-沉积物系统中氮磷的控制效果还需要进一步观察研究.
贡湖湾位于我国太湖东北部,是太湖的重要组成部分,紧邻江苏省无锡市,与贯穿市区的河网紧密相连. 1970s因为城镇发展,当地采取填湖筑坝的方式破坏了当地自然湖滨带,沿岸水生植物群落基本消失,伴随着市政污水排放压力,自2000年起频繁的蓝藻暴发成为影响当地用水安全的主要问题[18]. 贡湖湾主体湖区在2008年总氮浓度达到4.0 mg/L以上,总磷浓度达到0.05 mg/L 以上,湖滨区域由于市政污水压力,总氮、总磷浓度更高[19]. 2012年起以恢复自然湖滨带、控制入湖氮磷浓度为目的的生态修复工程在贡湖湾湖滨带实施,重建水生植物群落是其中重要环节. 各类水生植物对人工基底、高氮磷水体的适应性,以及缓解富营化的效果有待研究.
流域尺度上的野外调查和微观层面上的室内模拟取得了丰富的各类成果,但中/小尺度下水生植物的恢复以及氮磷控制效果还需要补充完善. 人工修复湖滨区域为研究水生植物生长对水深、水质等环境因素的适应性提供了良好条件,而不同的水生植物群落构成是否影响其氮磷控制效果将得到进一步验证. 本研究拟从水生植物移植栽种初期到基本稳定的成熟期,以季度为时间单位,为期3年,现场监测水体、沉积物氮磷含量,浮游藻类及水生植物生长情况. 通过量化、分析水生植物生长情况以及与氮磷含量的相关关系,以期系统地阐述水生植物的恢复过程以及在控制湖泊富营化上发挥的作用,进一步丰富水生植物在湖泊保护上的工程应用.
1 研究区域与方法
1.1 研究区域
湖滨带修复区位于太湖贡湖湾北部沿岸,紧邻无锡市区. 如图1所示,整个修复区四周由护堤包围,修复区与贡湖湾主体相连且东侧与无锡市区河网入湖口相连. 护堤内原属1970s围湖造田形成的农业用地,2012年以来完成了以基底重建为主的湖滨带修复初步工作. 整个湖滨带修复区在2012年完成了基底重建,为2014年全面开展水生植物群落重建打下基础,至2016年基本完成湖滨带水生植物重建. 为了研究不同水生植物在修复期间的生长情况以及氮、磷控制效果,在湖滨带修复区内选取2个研究区域、1个参考对照区. 研究区A(31°27′19.91″~31°27′25.38″N, 120°19′48.04″~120°19′56.39″E)位于湖滨带修复区北岸,在150 m×180 m的矩形区域内沿着水深变化栽种了浮叶、沉水植物并在南侧设置了消浪带. 研究区B (31°27′10.59″~31°27′12.71″N, 120°20′4.91″~120°20′6.30″E)位于湖滨带修复区南侧,在90 m × 100 m 的矩形区域内设置消浪带、栽种水生植物. 对照区位于修复区中心,修复期间仅处理了基底、栽种少量沉水植物,未设置消浪带或栽种其他水生植物. 研究区、对照区在2012年基本完成基底构建,在清除原农田土壤后覆盖当地沙壤土. 研究区A及对照区按照3%的设计坡度找坡,研究区B则按照5%的设计坡度找坡,水深均按照最深处2 m的设计构建基底. 2013年完成岸上植物的栽种,并种植市售水生植物幼苗. 根据岸坡坡度及设计水深,从岸边向底部栽种浮叶、沉水植物. 研究区内水生植物种类丰富,且具备完善的消浪围护,为研究水生植物的恢复和作用提供了良好条件.
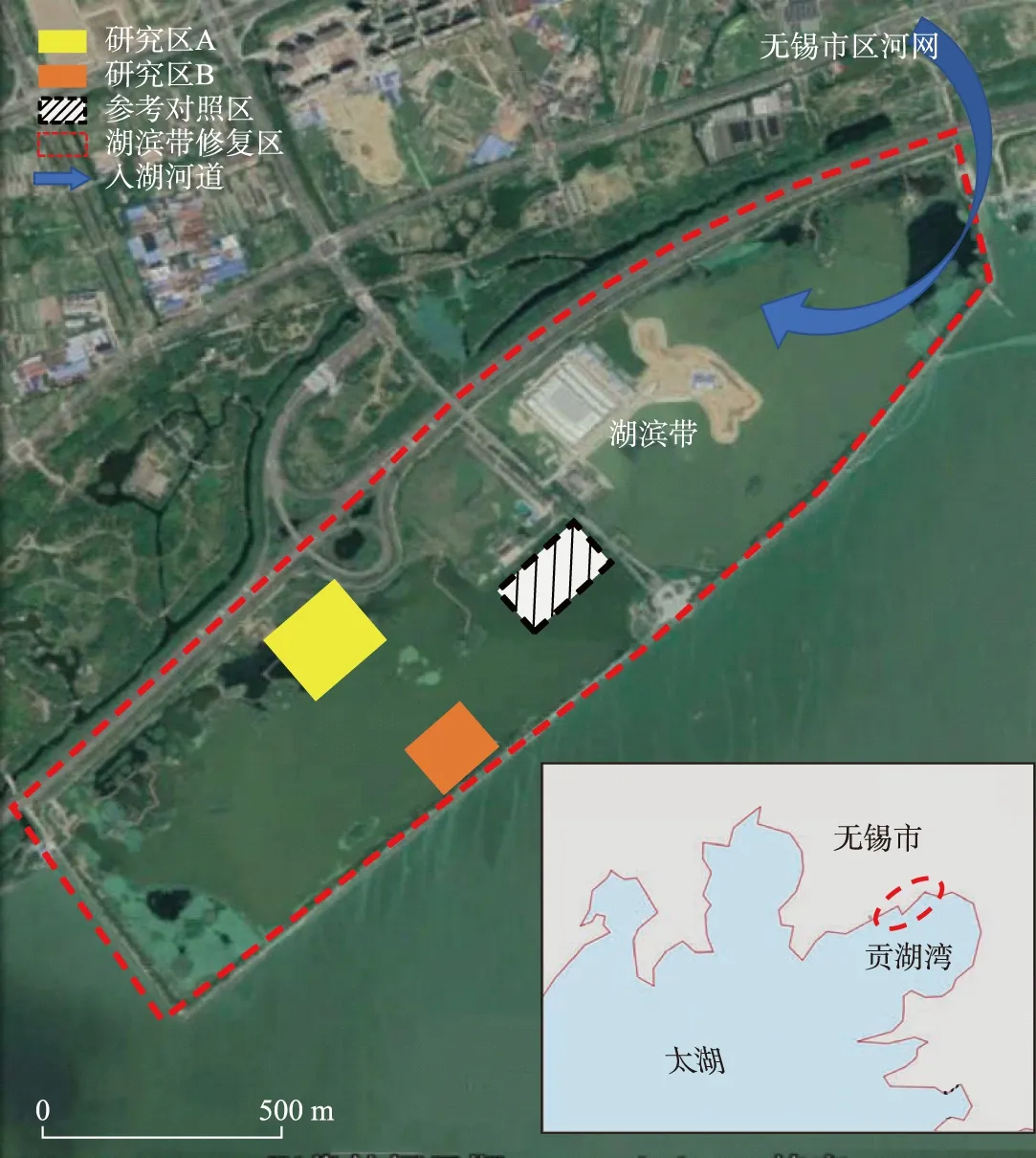
图1 太湖贡湖湾湖滨带生态修复区以及研究区A、研究区B、对照区Fig.1 The study area (A, B) and control area in ecological restoration of Gonghu Bay, Lake Taihu
1.2 研究方法
2014-2016年每年夏季(6月)、冬季(12月)对研究区内的水体、沉积物和水生植物指标进行监测. 在研究区A、B以及对照区内分别设置6个、5个采样点,采集水体、沉积物样本. 水生植物统计根据样方法[20],分别在两个研究区内设置20 cm× 20 cm样方33、28个. 水体化学需氧量(CODMn)、氨氮(NH3-N)、总氮(TN)、总磷(TP)、叶绿素a(Chl.a)浓度等指标在采样24 h内带回实验室根据标准方法检测[21],水体透明度(SD)在现场由透明度盘测定. 使用彼得逊采泥器采集表层沉积物(0~5 cm)样品,沉积物样品采取冷冻干燥方式前处理,粉碎过筛(孔径:150 μm)以去除动植物组织和岩石颗粒的干扰,进一步过筛(孔径:75 μm)备用. 沉积物有机物含量由烧失量(ignition loss, IG)表示,称量单位沉积物样品质量在550℃焚烧2 h后变化所测定. 沉积物磷含量由高氯酸、硫酸消解法所得. 沉积物氮含量根据凯式定氮法利用自动化蒸馏滴定系统测定(VELP Scientifica, Usmate, Italy). 浮游藻类的采集、固定、镜检分类计数采用《水和废水监测分析方法》(第四版)[22]及水生生物分类鉴定图谱.
湖泊营养状态指数(trophic level index,TLI)是评价湖泊营养化程度的综合性指标,该指数将叶绿素a、总磷、总氮、透明度、化学需氧量作为主要参数,并根据全球各地长期观察结果为基准建立起一套无量纲过程和划分标准[23]. 该指数在长江流域湖泊中的应用证明了其对我国湖泊富营养化情况的适应性[24-25].TLI计算公式如下:
TLI(Chl.a)=10×(2.5+1.086 ln(Chl.a))
(1)
TLI(TP)=10×(9.436+1.642 ln(TP))
(2)
TLI(TN)=10×(5.453+1.694 ln(TN))
(3)
TLI(SD)=10×(5.118-1.94 ln(SD))
(4)
TLI(CODMn)=10×(0.109+2.66 ln(CODMn))
(5)
(6)
湖泊综合营养状态指数TLI(∑)<30,水体呈贫营养;30≤TLI(∑)<50,水体呈中营养; 50≤TLI(∑)<70,水体呈富营养; 70≤TLI(∑), 水体呈严重富营养.
生物生产力指数(bio-production index,BPI)是从沉积物角度评价湖泊营养程度的常用指标,反映了一个湖泊生态系统长期、整体上所能承载的生物量. 不同于水体TLI主要针对浮游植物的营养程度评价,BPI是反映包括浮游动植物、水生植物、底栖动物在内整个生态系统所能获得的营养水平[26]. 对于初期的人工生态系统,BPI主要反映湖滨带对水生植物的支持能力,同时也反映外源营养物质在湖滨带的积累情况. 根据BPI的定义,在沉积物氮含量与有机物含量的线性回归中ω(IG)=100‰时所对应的氮含量. 这是一种建立在碳氮比例和数量下对湖泊生态承载力的估算,BPI指数与湖泊水体富营养化间的相关关系在国内外研究中得到了印证.
1.3 数据分析
为保证数据的准确性和可靠性,所有样品分析过程中均采取平行检测,标准物质采用Sigma-Aldrich RTC公司水系沉积物标准品CNS392. 本研究重复样本分析误差<5%,标准物质测试误差<±10%. 本研究指标间独立性采取样本独立t检验. 利用Pearson分析法处理水体指标之间的相关关系. 水体氮、磷浓度与水生植物生物量、覆盖度之间的线性回归以及沉积物有机物、氮含量之间的线性回归采用SPSS 22软件 (IBM, Armonk, NY, USA)执行.
2 结果分析
2.1 水生植物的恢复
研究区内的主要浮叶植物有荇菜(Nymphoidespeltatum(Gmel.) Kuntze)、睡莲(NymphaeatetragonaGeorgi)、菱(TrapabispinosaRoxb.),主要沉水植物包括黑藻(Hydrillaverticillata(Linn. f.) Royle)、狐尾藻(MyriophyllumverticillatumL.)、小眼子菜(PotamogetonpusillusL.)、竹叶眼子菜(Potamogetonmalaianus). 水生植物恢复采取幼苗移植的方式,浮叶植物种植密度为:睡莲2~3株/m2,荇菜20~30株/m2,菱5~6株/m2;沉水植物种植密度为:竹叶眼子菜50~60 株/m2,小眼子菜和黑藻均为40~45株/m2,狐尾藻30~40株/m2. 如图2所示植物栽种后逐渐恢复水位,在2014年水生植物群落初步成熟. 湖滨带水生植物恢复在一定程度上依赖于消浪技术的应用,良好的水体透明度是水生植物,尤其是沉水植物生存的必要条件[27-29],而低透明度甚至可能带来沉水植物的消亡[30]. 以人工构造围护、消浪带为代表的消浪技术在太湖五里湖区域的应用证明了其在减少水力扰动、提高水体透明度方面的价值[8]. 水生植物的生长促进了水体透明度的提高. 图3a反映出沉水植物生物量与水体透明度表现出良好的正相关(Pearson’sr>0.89,R2>0.75). 人工消浪措施为修复初期水生植物的生长提供了良好的水力条件和水体透明度,随着水生植物的生长水体透明度得到进一步提高. 研究区A在2014年时水体透明度就好于研究区B,并且伴随着水生植物的生长有着更快的提高. 图3b反映出浮叶植物的覆盖度与水体透明度之间的正相关关系(Pearson’sr=0.92,R2=0.95),进一步说明水生植物的恢复利于水体透明度的提高.

图2 2012-2016年湖滨带景观变化Fig.2 The landscapes of lakeshore from 2012 to 2016

图3 研究区水体透明度与水生植物生物量(a)、覆盖度(b)分布情况Fig.3 The distributions of macrophytes’ biomass (a) and coverage (b) with water transparency in study area
不同植物习性各异,浮叶植物开花、持续时间也不尽相同. 例如,菱作为一年生草本水生植物,冬季时除沉积物中留存的母茎外,枝杆枯黄,叶子和果实枯死返回沉积物,所以其生物量和覆盖度在冬季时可以忽略不记. 如表1所示,总体上植物覆盖度、生物量在夏季达到最高,在冬季处于最低水平,逐年稳定增长. 通过对比研究区A、B内的水生植物,可以发现研究区A的浮叶植物覆盖度、生物量更高,在研究区A 内荇菜、菱的分布更为广泛,而研究区B内睡莲分布则较广. 研究区A、B基底坡度的不同可能是造成这种差异的原因之一. 研究区A内3%的缓坡造成了大片水深在1 m以内的浅水区,为以匍匐茎、横走茎为主茎主要部分的荇菜、菱提供了合适的生长环境. 研究区B内5%的坡度使得浅水区面积有限,而水深1.0~2.0 m 的区域面积较大,为具有肥厚根状茎的睡莲提供了良好条件. 研究区B 中的沉水植物生物量增长较快,在2015年冬季时就超过研究区A. 在消浪带保护下水力条件的差异在研究区A、B之间几乎可以忽略,但水生植物构成上的差异指出水位、水质以及沉积物营养条件均是潜在的影响因素.
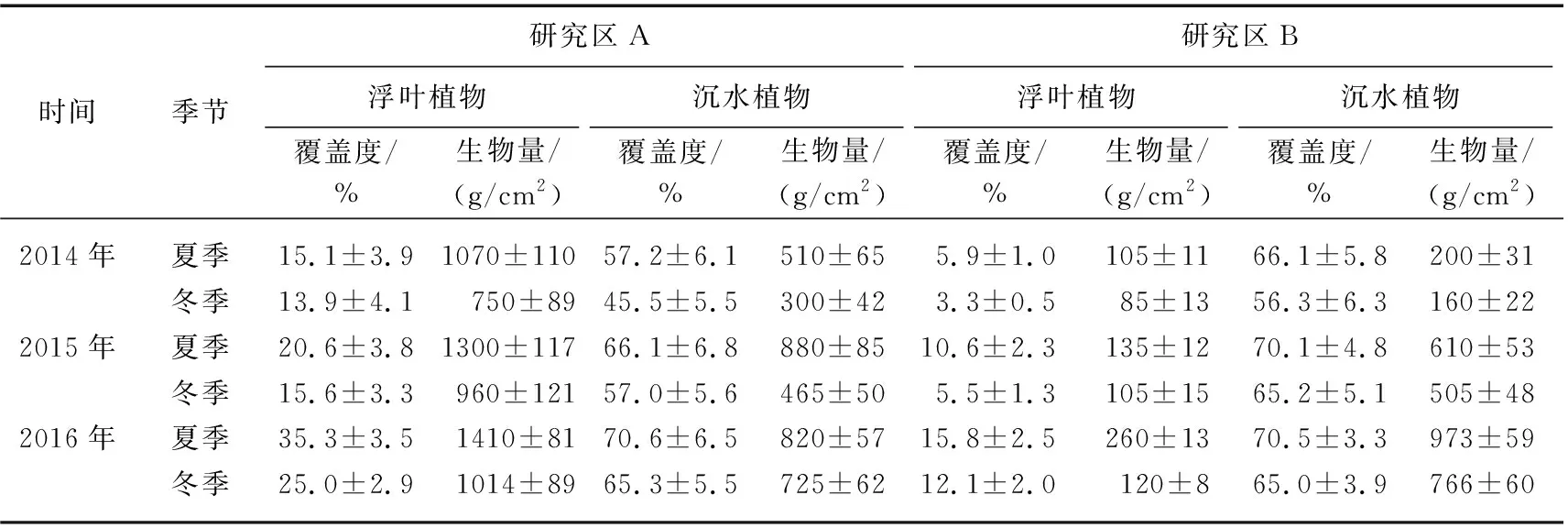
表1 2014-2016年研究区A、B内水生植物覆盖度和生物量Tab.1 Macrophyte’s cover and biomass in study area A and B from 2014 to 2016
2.2 水体营养状态指数变化
如图4所示,研究区水质提高明显,水体平均DO浓度由4.0 mg/L增至 8.0 mg/L,DO、Chl.a浓度持续上升,虽然在夏季与冬季有不同程度的反弹,但TP、CODMn、NH3-N、TN浓度总体上持续下降. 对照区的各项指标在2014-2016年间没有显著变化,说明在2014-2016年间外部输入营养盐和水质情况没有变化. 虽然水生植物恢复初期研究区A、B在CODMn、TN、NH3-N等指标方面存在差异, 可能对水生植物的恢复效果造成影响,但研究区内氮磷水平的下降以及水质的改善是显著的.

图4 2014-2016年湖滨带生态修复研究区水质指标Fig.4 Water indicators in lakeshore restoration from 2014 to 2016
水体营养状态指数TLI将叶绿素a浓度作为核心,与其他指标(TP、TN、SD、CODMn)在空间分布上的相关系数(rij)分别为0.84、0.82、-0.83、0.83,整理后得到各指标权重如表1所示. 根据公式(6)计算得到综合营养状态指数TLI(∑)在修复过程中逐渐下降,2016年研究区 A、B降至中营养水平(表2). 研究区A在2014年基本保持在富营养水平,在随后的修复过程中营养水平逐渐下降,但是年内变化情况指出冬季营养水平要略高于夏季,总磷成为影响其综合得分的重要因素. 研究区B在2014、2015年基本维持在富营养水平,2016年逐渐达到中营养水平,总磷、叶绿素a浓度虽有季节性的回升,但总体在平稳下降. 对照区内的水体TLI值一直处于富营养水平,透明度、总氮以及化学需氧量得分高于研究区.

表2 2014 -2016年夏季和冬季Chl.a、TP、TN、SD、CODMn营养状态指数(TLI)及综合营养状态指数TLI(∑)*Tab.2 Trophic level index (TLI) for the water indicators (Chl.a, TP, TN, SD, CODMn) and the TLI(∑) values in summer and winter from 2014 to 2016
2.3 表层沉积物营养水平
表层沉积物(0~5 cm)不仅是氮、磷等营养物质在水体-沉积物之间交换的重要场所,还是湖泊生态系统中水生植物、底栖生物、微生物的重要栖息场所. 表层沉积物赋存的有机物、氮、磷等营养物质是整个湖泊生态系统潜在的承载力,以及水生植物重要的营养盐来源. 表层沉积物在基底构建阶段(2012年)主要由当地沙壤土构成,水位恢复后(2013年)还有沉淀带来的新生底质. 如表3所示,修复初期(2014年)研究区内的表层沉积物中有机物含量为30‰~50‰,N含量为1.5~2.3 mg/g,P含量为0.16~0.21 mg/g. 随着水生植物恢复存在不同程度的下降, 沉积物N含量迅速下降,在研究区A内由1.50 mg/g降至0.56 mg/g,在研究区B内由2.31 mg/g降至1.56 mg/g,研究区内沉积物P含量没有显著变化. 对照区沉积物氮、磷含量小幅上升. 研究区内的BPI指数由2014年4.80降至2015年2.41,2016年稍有回升至2.45(表3). 根据BPI评分标准,湖滨带正在从富营养转变为中营养,这与研究区内水体TLI显示的营养变化情况相似. 对照区BPI指数由修复初期的3.41逐渐升至4.00,修复期间一直处于富营养水平. 该结果指出成规模的水生植物恢复消耗了沉积物中赋存的营养盐,降低了整个湖滨生态系统富营养化的风险. 当水生植物恢复比较成熟时,并不会进一步降低湖滨带潜在的生态承载力,BPI会达到一个相对稳定的状态.
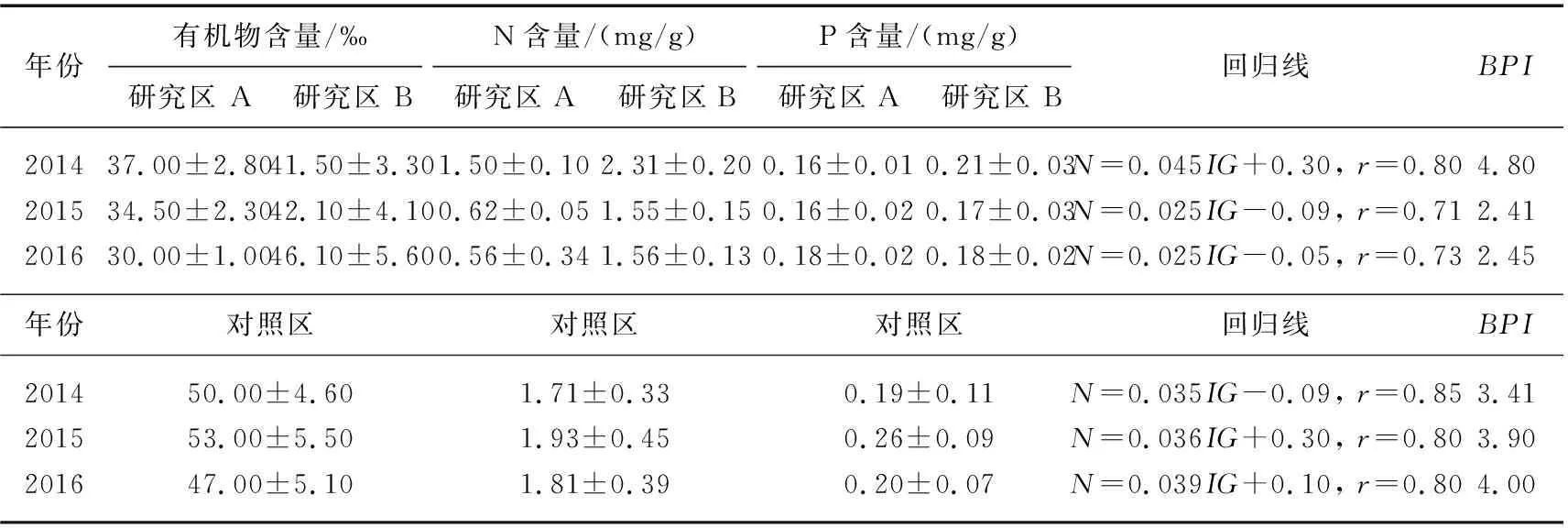
表3 2014-2016年研究区A、B表层沉积物年均有机物(IG)含量、N含量、P含量以及生物生产力指数(BPI)Tab.3 Annual mean contents of organic matter(IG), nitrogen and phosphorus in the surface sediment of study area A, B and the bioproduction index (BPI) from 2014 to 2016
2.4 浮游藻类的变化
夏季是浮游植物生长繁殖旺盛的时期,研究区A内主要由蓝藻门平裂藻属(Merismopedia)、绿藻门十字藻属(Crucigenia)、硅藻门直链条藻属(Melosira)构成,研究区B内主要由蓝藻门颤藻属(Oscillatoria)、绿藻门十字藻属(Crucigenia)、蓝藻门平裂藻属(Merismopedia)、蓝藻门鱼腥藻属(Anabaena)组成. 研究区内浮游植物主要种类占总密度的90%以上,而具体的构成情况如图5所示. 湖滨带水体与太湖贡湖湾主体相连,在修复初期就形成了蓝藻为优势种群的格局. 从修复初期(2014年6月)至后期(2016年6月),研究区A内一直以蓝藻门平裂藻属为最优势浮游植物,其占比一直升高,而绿藻门十字藻属的占比则持续下降. 研究区B内浮游植物群落结构发生了显著变化,蓝藻门平裂藻属占比持续上升,2016年夏季时已经成为最优势种群,绿藻占比则快速下降,2016年夏季时已不再是主要种群. 总体上看,蓝藻逐渐占据优势,绿藻、硅藻则逐渐衰退. 研究区A内藻类密度在2015年达到最高后下降,研究区B内藻类密度也有相似变化趋势. 研究区A、B内浮游植物种类存在差异,变化趋势却大致相同,即总密度得到控制,但是种群结构也愈发单一. 对照区内浮游植物也由上述藻类构成主要种群,密度也维持在2.5×105~3.0×105cells/L左右,但是群落结构在2014-2016年间没有显著变化,主要种群占比均在20%~30%之间. 蓝藻在研究区逐渐取得优势地位,氮磷水平下降造成的竞争,以及水生植物对水下光照、溶解氧的影响都有可能造成此类结果.

图5 研究区A、B内主要浮游植物密度及占比Fig.5 The main phytoplankton species’ density and proportions in study area A and B
3 讨论
水生植物的生长受到水深、水质的影响,研究区A、B水生植物群落恢复情况的不同是两处水深、水质上差异的结果. 如表4所示水深与浮叶植物的覆盖度呈反比(Pearson’sr=-0.630,P<0.1), 与沉水植物的生物量呈正比(Pearson’sr=0.598,P<0.1). 正如2.1节反映的情况一样,研究区A内相对广阔的浅水区为丰富的浮叶植物群落提供了条件,而研究区B内1~2 m水深的区域更利于沉水植物的生长. 同时水体总氮、氨氮浓度与水生植物指标存在显著的负相关(详见表4),图6还显示总氮浓度与浮叶植物覆盖度有良好的线性负相关关系,即浮叶植物覆盖度从空间、时间上看均与总氮呈反比. 相关研究也发现高氨态氮胁迫下水生植物生理机能有显著的减弱[31]. 研究区B初期较高的总氮(>3.0 mg/L)、氨氮(>0.6 mg/L)浓度以及较深水位(1~2 m)综合作用下造成了浮叶植物在相同的栽种总类和密度下恢复情况不如研究区A,其中荇菜、菱对总氮、氨氮相较于睡莲更为敏感.

表4 2014-2016年研究区内水深,水质指标(SD、CODMn、TN、NH3-N、TP、Chl.a)与浮游藻类、水生植物指标的相关性分析Tab.4 The relationships of water depth and quality indicators (SD, CODMn, TN, NH3-N, TP, Chl.a) with phytoplankton, macrophyte indicators in study area from 2014 to 2016
为了减少人为干扰,实验期间除了少量的采集监测,没有实施水生植物的收割. 冬季水生植物枯萎可能导致部分同化的氮磷返回到湖滨带生境中,但是在研究区生境中并没有出现冬季氮磷含量的普遍上升. 氮、磷总体上由湖滨带生境通过水生植物、浮游藻类向湖滨生态系统累计. 随着水生植物的生长,湖滨生境中的氮磷浓度得到了控制. 图7综合反映了研究区水体/沉积物氮均有不同程度的下降,而对照区内,水体总氮浓度在4~5 mg/L之间,沉积物平均氮含量则由1.71 mg/g上升至1.81 mg/g,外界输入的氮逐渐累计在沉积物中. 相关研究指出水生植物主要通过根系吸收沉积物中的营养盐,间接控制上覆水体中的氮浓度[32]. 水体总氮浓度与浮叶植物覆盖度、沉水植物生物量存在负线性关系(图6),反映出这两类水生植物的关键生长指标直接响应了水体总氮情况. 水生植物即可以通过根系吸收沉积物中的有效氮,也可以直接利用水体中硝酸盐、亚硝酸盐、氨氮等溶解性氮[33-34]. 研究区内沉积物氮逐年下降,水体总氮在水生植物的影响下直接下降,反映出水生植物在吸收沉积物中氮的同时,也在直接利用水中部分有效氮. 水生植物在生长过程中受到总氮/氨氮浓度的影响,但是在形成成熟稳定的群落后可以有效固氮,减少了输入型氮在生境中的累计.

图6 2014-2016年水体TN、TP浓度与水生植物生物量、覆盖度的线性回归Fig.6 Linear regressions between the TN, TP concentration and the macrophyte biomasses, covers from 2014 to 2016
如图7所示,研究区水体总磷浓度逐年下降,但研究区A夏季水体总磷浓度要低于冬季,研究区 B 夏季水体总磷浓度则要高于冬季. 总磷浓度除了与沉水植物生物量存在负相关性,还与叶绿素a浓度 (Pearson’sr=-0.564,P<0.1)、蓝藻数量(Pearson’sr=-0.501,P<0.1)、绿藻数量(Pearson’sr=-0.609,P<0.1)存在显著负相关性(表4). 以上统计分析结果显示随着浮游藻类活动增强,其对水体磷吸收的能力也增强. 实际上相关研究已经指出浮游藻类与水生植物对磷酸盐有竞争性吸收,并且对磷有更敏感的反应,湖泊中往往呈现出磷驱动下的藻类活动规律[35-36]. 研究区水体总磷的季节性差异来自于浮游藻类群落的不同,根据浮游藻类调查结果(详见2.4节),研究区A、B内蓝藻一直处于优势地位,但研究区A 以平裂藻属为主,研究区 B内颤藻为重要组成部分. 相关研究指出水生植物通过改变光照、溶解氧以及pH等理化条件对浮游植物群落结构有直接影响[36]. 颤藻对磷的高效吸收利用往往使其在富营化浅水湖泊中占据优势[37]. 在研究区B内颤藻作为优势种在冬季其他藻类对磷吸收效率下降时仍能有效吸收水体中的磷,造成了上述水体总磷浓度季节性的差异. 相关研究发现平裂藻喜碱性环境,能够高效吸收氮,但对磷的吸收利用要低于其他蓝藻[38]. 广泛存在于研究区A的平裂藻在冬季对磷的吸收利用效果低于颤藻,对照区内各类蓝藻、绿藻、硅藻比例相近,没有明显的优势种,虽然随着藻类活动逐渐增强,叶绿素a浓度升高,水体总磷浓度略有下降,也出现了冬季总磷浓度高于夏季的现象. 但与研究区不同的是对照区年均总磷水平没有显著变化,沉积物中磷含量还略有升高. 对比研究区与对照区,可以发现水生植物与浮游藻类共同吸收利用环境中的磷,浮游藻类会相比水生植物会更直接地同化利用水环境中的磷,而水生植物主要针对沉积物磷进行吸收利用. 考虑到水生植物对浮游藻类群落的影响,水生植物在湖滨区域起到了良好控磷作用.

图7 2014 -2016年研究区A、B水体TP、TN、NH3-N浓度和沉积物TP、TN含量Fig.7 TP, TN, NH3-N concentration in water, and TP, TN contents in surface sediment of study area A, B from 2014 to 2016
4 结论
构建合适的生境是人工湖滨带水生植物修复的首要条件. 在减少水力扰动前提下,水位、水质对水生植物的恢复有着显著的影响. 以荇菜、睡莲、菱为代表的浮叶植物群落受水深、水质的影响相比以黑藻、小眼子菜、竹叶眼子菜为代表的沉水植物更为明显. 较高浓度的总氮(>3.0 mg/L)、氨氮(>0.6 mg/L)环境会抑制浮叶植物的生长,而沉水植物则表现出更好的适应性. 随着水生植物的恢复,水体、沉积物中氮磷营养物质逐年减少,水体TLI、沉积物BPI值显著下降,水体透明度显著提升.
水生植物在氮、磷控制的方式上存在显著的差异. 虽然水生植物可以从湖滨带生境中吸收利用氮磷营养元素,尤其显著降低了水体总氮、氨氮浓度,但是对水体总磷的直接吸收有限. 研究发现浮游藻类活动的增强减少了水体总磷浓度,冬季颤藻相对直裂藻及其他绿藻、硅藻更高效地吸收利用水体中的磷,造成了研究区年均总磷浓度持续下降的背景下季节性的差异. 水生植物可能正是通过影响藻类构成的方式间接地控制水体总磷. 总结上述结论,恢复一个丰富的水生植物群落在湖滨区域作为控制氮磷的有效办法可以缓解湖泊的富营化趋势,但水生植物与浮游藻类之间的互动和影响仍是其作为工程技术手段需要扩展考察的方面.
——以武汉紫阳湖为例

