不同PE材料遮光下血橙转色期果皮花色苷合成及其相关基因的表达分析
杨海健, 张云贵, 周心智, 洪 林, 杨 蕾, 彭芳芳, 王 武
(重庆市农业科学院 果树研究所,重庆 401329)
血橙(CitrussinensisL. Osbeck)原产于地中海地区,四川和重庆是我国的主要栽培产区,品种以塔罗科血橙为主。血橙是典型的花色苷着色柑橘品种[1],其红色靓丽的外观深受消费者喜爱,红艳的色泽可谓是血橙最重要的经济性状[2]。引起血橙果皮着色的主要是花色苷和类胡萝卜素,而花色苷起决定性作用[3]。花色苷是植物体内重要的次生代谢物质,属于黄酮类化合物[4]。研究认为,花色苷有抵御紫外线损伤的作用[5],同时还具有重要的营养和药理作用,如抗氧化[6]、抗炎[7]、抗癌[8]、预防心血管疾病[9]等。血橙外观品质很大程度上代表着血橙的经济价值,因此,外观一直是血橙产区关注的重点,而目前生产上存在不同程度的血橙果面着色浅的问题。血橙果面花色苷合成除遗传因素外,外界环境对其合成积累也具有重要调节作用。作者前期已经证实血橙果皮花色苷的合成受光照调控[3],该研究在此基础上,以塔罗科血橙新系为试验材料,进一步研究了血橙转色过程中(花后189~264 d血橙果皮由绿转黄再转红)在不同PE材料遮光处理下的果皮花色苷动态含量、花色苷合成的主要基因的动态表达量,深入探索血橙果面花色苷积累受光调控的机理,以期为改善生产中血橙果面着色不良问题提供解决思路。
1 材料与方法
1.1 试验材料
试验地位于重庆市万州区武陵镇塔罗科血橙园,该园为丘陵地果园,海拔256~300 m;土壤为紫色土,土壤pH 6.6~7.1,土层厚度40~55 cm,年平均气温17.7 ℃,年平均日照时数1 484.4 h。于2019年10月选择园内受光条件较好的10株塔罗科血橙健康树为试验树。采用5种厚度(12丝)相同、颜色不同的PE透光袋作为遮光材料,颜色分别为透明、红色、绿色、蓝色、紫色。
1.2 试验处理
于2019年10月15日,对树体外围血橙果实进行套袋遮光处理,袋子套好后剪掉袋子的4个角,利于透水透气,以未套袋的外围果实作为对照,由于红色PE袋在日光下容易褪色,试验在血橙的整个转色期需要对红色PE袋进行频繁的换新。2019年4月25日为血橙谢花末期,采样日期为2019年11月1日(花后189 d)至2020年1月15日(花后264 d),每隔15 d采样1次,每处理3个重复,每重复5个果实,当天带回实验室立即削取果皮外皮层于液氮中速冻,-80 ℃保存备用。
1.3 样品测定
1.3.1 遮光袋透光率测定
采用紫外可见近红外分光光度计(UV-7502C)分别测定各遮光袋在250~700 nm的透光率,每隔25 nm测定一次。
1.3.2 总花色苷含量测定
采用pH示差法[10-11]对不同采样时期的各处理血橙果皮中总花色苷含量进行测定。
1.3.3 果皮色泽测定
采用KONICA MINOLTA便携式色差计对花后264 d各处理果实果面进行色泽测定,每处理测定5个果实,每个果实沿赤道均匀采集4个点进行测定。
1.3.4 RNA提取、cDNA制备与实时荧光定量PCR
RNA提取与cDNA制备采用大量法并略作修改。液氮研磨0.5 g样品成粉末,快速转入已加入5 mL RNAiso Plus(TaKaRa)抽提液的15 mL离心管中,上下颠倒混匀后静置15 min,加入1.5 mL氯仿,剧烈振荡15~30 s后静置10 min,在4 ℃下,10 000×g离心15 min,取上清至另一离心管中,再加入1.5 mL氯仿重复操作。上清液转至新离心管后加入等体积异丙醇,室温静置2~3 min,4 ℃,10 000×g离心20 min,弃上清后加入1.5 mL预冷的75%乙醇,在-20 ℃冰箱中静置30 min,再加入1.5 mL预冷的75%乙醇重复操作。10 000×g离心8 min,弃乙醇,按沉淀大小加DEPC水溶解。1%琼脂糖凝胶电泳检测,分光光度计检测,分装。以提取的RNA为模板,利用PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time) 反转录试剂盒合成cDNA。
实时荧光定量PCR。内参基因选用EF-1α(登录号XM_015533332),内参EF-1α、CHS、DFR、UFGT基因引物序列参考Crifò等[12],Ruby、MYBF1、PAL、GST、ANS、CHI、C4H、4CL、F3H基因引物序列参考Carmona等[13]。引物序列见表1。

表1 实时荧光定量 PCR 引物序列
利用TB Green®Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒进行qRT-PCR 反应,反应体系20 μL,其中TB Green Premix ExTaq(Tli RNaseH Plus) Ⅱ(2×)10 μL,PCR上下游引物10 μmol·L-1各0.4 μL,cDNA模板(<100 ng)8.2 μL。反应程序为:95 ℃ 1 min;95 ℃ 10 s,58 ℃ 30 s,40 个循环。每个模板做3次重复。采用 2-ΔΔCt法计算基因相对表达量。反应仪器为BIO-RAD CFX96TM Real-Time Systerm。
1.4 统计分析
试验数据采用Excel 软件进行整理分析与绘图,利用SAS 8.0的SAS ANOVA多重分析比较法进行差异显著性分析。
2 结果与分析
2.1 不同PE袋的透光率分析
采用分光光度计对5种颜色PE遮光袋进行透光率测定(图1)。结果显示,无论是可见光还是紫外光部分,透明袋的透光率均为最高,且随着波长变短,透明袋的透光率呈现逐渐下降的趋势。在250~700 nm的整个光谱中,绿袋和紫袋表现出近似的透光曲线,透光率沿波长由长到短呈现缓波浪向下的趋势。在300~700 nm的光谱中,红袋与蓝袋的透光率曲线趋势相反,红袋透光曲线的波峰和波谷正好与蓝袋的波谷和波峰相遇,蓝袋对红光(620~700 nm)、黄光(580~620 nm)、UVA光(320~400 nm)的透过率明显较其他PE袋差,而红袋对绿光(490~580 nm)、蓝光(450~490 nm)、紫光(400~450 nm)的透过率明显较其他PE袋差,而在小于300 nm的光谱中红、蓝两种PE袋表现相同的下降趋势。在280~315 nm的(UVB、UVC)紫外光谱中,透明袋呈现最高的透光性(约为71.7%~63.6%),绿袋和紫袋次之(约为55.2%~48.3%),红袋和蓝袋的透光性则最差(约为48.4%~29.1%)。
2.2 不同PE袋遮光下血橙果皮总花色苷含量的变化
如图2所示,在花后189 d血橙果皮正处在由绿转黄时期;花后204 d对照血橙果皮完全转黄;花后219 d对照血橙果皮开始出现肉眼可见的花色苷着色,透明袋中部分果实的果皮也开始显现少量花色苷着色,其他PE袋处理着色不明显;花后234 d,所有处理果皮均出现花色苷着色,只是红袋和蓝袋处理果皮花色苷着色较少;花后249~264 d,各处理果实果皮花色苷着色迅速增加,并根据果皮着色深浅可将其分为4组:对照血橙果实果皮着色最深,面积最大;透明袋处理次之;绿袋和紫袋处理再次之;红袋和蓝袋处理着色最浅。
如图3所示,花后189~204 d各处理血橙果皮中均未检测到花色苷含量。花后219 d,在除红袋遮光以外的其余各处理血橙果皮中检测出花色苷,其中,对照和透明袋处理果皮花色苷含量较高。之后,各处理果皮的花色苷含量增加,以对照果皮花色苷含量增加最快,透明袋处理次之,绿袋和紫袋处理再次之,红袋和蓝袋处理花色苷含量增加相对较慢。各处理果皮总花色苷测定结果与肉眼观察的血橙着色基本一致。
色差计测定结果(表2)显示,各处理间代表红色的a值以对照最高,透明袋处理次之,红袋处理最低,其中对照与绿袋、蓝袋、红袋处理的a值具有显著性差异,而与透明袋和紫袋之间无显著性差异,透明袋a值与红袋、蓝袋具有差异显著性,a值由大到小分别为:对照>透明袋>紫袋>绿袋>蓝袋>红袋。而代表黄色的b值则呈相反趋势:红袋>蓝袋>紫袋>透明袋>绿袋>对照。亮度值(L)表现为对照最低,套袋处理较高,且表现出PE袋的遮光率越高,遮光后果面越亮的趋势。
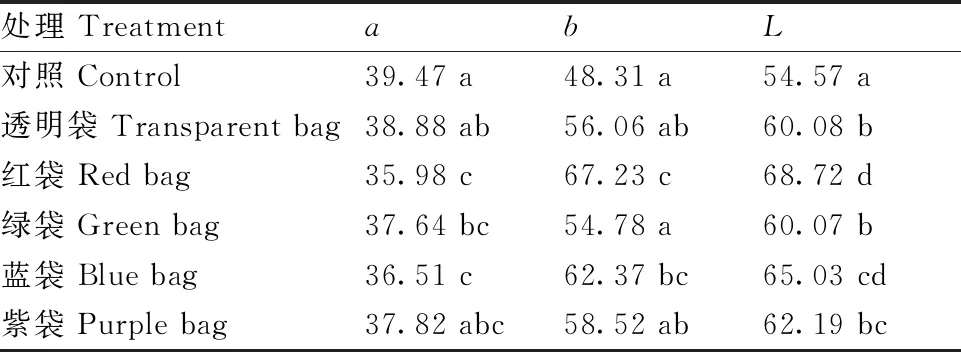
表2 不同处理血橙果实表皮的色泽情况
2.3 不同PE袋遮光下血橙果皮花色苷合成相关基因表达量的变化
血橙果肉中花色苷的代谢途径研究得较为清晰。苯丙氨酸在苯丙氨酸裂解酶(PAL)、肉桂酸羟化酶(C4H)、香豆酞 CoA连接酶(4CL)、在查尔酮合成酶(CHS)、查尔酮异构酶(CHI)、黄烷酮-3-羟化酶(F3H)、二氢黄酮醇-4-还原酶(DFR)、花青素合成酶(ANS)、类黄酮糖苷转移酶(UFGT)、谷胱甘肽转移酶(GST) 等为血橙花色苷生物合成途径中的主要结构基因[13]。R2R3-MYB是花色苷生物合成的关键正调节剂,而Ruby和MYBF1是R2R3MYB的转录因子[13-14],二者对血橙花色苷的产生至关重要。
由图4可知,遮光对血橙果皮花色苷合成相关基因的影响较大。8个结构基因GST、ANS、CHS、DFR、F3H、UFGT、PAL、4CL和2个调节基因Ruby、MYBF1在遮光处理后的表达量明显降低。其中基因GST、ANS、CHS、DFR、PAL、UFGT、Ruby在不同处理下的表达趋势与对照一致,在果实逐渐成熟过程中均呈上升表达,只是表达量较自然光下有明显降低。而基因F3H、MYBF1、4CL在遮光处理下的动态表达曲线与对照不同,遮光导致了这3个基因在果实转色期间的表达增幅变小。自然条件下,这些基因在花后189~204 d维持在较低的表达水平,204~234 d表达量开始缓慢增长,234 d表达量进入较快速增长,249 d表达量急速提升,迅速与遮光后的基因表达量拉开差距。而CHI、C4H两个基因无论在自然光照下还是在遮光处理下,均未出现明显上升表达。
遮光条件下,血橙果皮花色苷合成相关基因表达与PE材料的透光性相关。结构基因GST、ANS、CHS、DFR、F3H、UFGT、PAL、4CL和调节基因Ruby、MYBF1在果实成熟过程中的动态表达量可按遮光PE材料分为3组:透明袋表达量最高,紫袋、绿袋次之,红袋、蓝袋表达量最低,基本与各遮光PE材料对UVB、UVC的透过率相对应,即透明袋透过率最高,其次为紫袋、绿袋,红袋、蓝袋透过率最低。
3 讨论
血橙果实在成熟过程中的遮光处理,阻碍了果皮花色苷的合成,这种阻碍首先表现在时间上,遮光延迟了血橙果皮花色苷的合成时间,这点在所有不同颜色PE遮光袋上均有表现,其中以红色袋表现最为明显(图3)。其次表现在面积上(图2),自然条件下,血橙果皮大部分面积裸露在光下,花色苷合成沿一个面或多个面同时合成,形成较大的花色苷着色面积,特别是在花后264 d,很多果实呈现整果面着色,而遮光处理的果面只是一部分或半边着色,有些果面出现斑块状或斑点状着色,着色不均。这可能与复杂的果面光际环境有关,因为PE袋套果后袋子离果面的距离有远近差异,且袋子容易出现褶皱,光线在穿过PE袋时产生各种折射角度等都会引起果面受光的不同,在这些因素的附加作用下产生了复杂的果面光际环境。最后表现在着色深浅上,色差分析结果显示了对照血橙的果皮红色程度较遮光处理的深,这点肉眼即可辨别(表2)。遮光后血橙果面的亮度普遍较对照高,这与套袋在甜瓜[15]、芒果[16]、柑橘[17]、油梨[18]等水果上的表现一致。血橙果面亮度与PE袋的透光率成反比,透光率越低果面亮度越高,这可能与血橙果面花色苷着色相关,因为有研究认为果实花色苷的含量与色差指标中的亮度呈反比[19]。因此,血橙果面的受光环境也是影响果面亮度的重要因素。
不同PE材料对不同波长光的透过率存在差异。在560~700 nm的波段内,按透光率可将PE袋分为3组:透明袋最高,红袋、紫袋、绿袋中等,蓝袋最低;400~550 nm的波段内,也分为3组:透明袋最高,蓝袋、紫袋、绿袋中等,红袋最低;325~400 nm的UVA波段内:透明袋最高,绿袋、紫袋、红袋中等,蓝袋最低;250~320 nm的UVB、UVC波段内:透明袋最高,紫袋、绿袋中等,蓝袋、红袋最低。而在果实转色期间,按血橙果皮总花色苷测定结果对PE袋进行排序分组:透明袋最高,绿袋、紫袋中等,蓝袋、红袋最低,这与PE袋在UVB、UVC波段内透光率一致。说明血橙果皮总花色苷合成与光射线中的UVB、UVC可能存在关系。
血橙转色期间,观察对照血橙的果皮花色苷合成相关基因的表达量发现,结构基因GST、ANS、CHS、DFR、F3H、UFGT、PAL、4CL和调节基因Ruby、MYBF1在转色期间相对表达量呈现快速增加,因此,判断这10个基因属于血橙成熟过程中果皮花色苷合成关键调控基因,这与喻最新等[20]研究血橙果肉中花色苷合成关键基因结果类似,不同的是其未将PAL基因定为关键基因,而本研究结果显示,在血橙果实转色期间果皮PAL基因无论是在自然条件下还是在各遮光条件下均呈明显上升表达。遮光造成了血橙果皮花色苷合成基因的相对表达量不及对照,尤其在花后249~264 d,显得尤为明显,差别几倍至几十倍。因此,判定这10个基因在血橙果皮花色苷合成过程中受到了光的调控。
值得注意的是,按遮光对血橙果皮花色苷合成关键基因表达的影响程度,对PE袋进行排序分组,同样将其分为3组:透明袋最高,绿袋、紫袋中等,蓝袋、红袋最低,又一次与PE袋在UVB、UVC波段内透光率完美契合。再次印证了血橙果皮花色苷合成与光射线中的UVB、UVC关系密切。这点在其他植物果实上得到了验证,低剂量的UVB处理,能增加桃的花色苷含量[21],UVC处理草莓能够促进总酚类和总花色苷的增加[22]。
血橙果皮花色苷合成关键基因均在花后234 d后开始大量表达,花后249 d后表达量骤升,因此,推测血橙果皮花色苷合成的关键时期在花后249 d以后,此时果皮花色苷开始大量合成,颜色快速增加。生产中部分果农提早采收导致血橙果面着色浅、不均匀即为此原因,因此,血橙应在花后249 d以后采摘较为适宜。由于透明袋的透光性较好,用透明PE材料遮光的血橙果皮总花色苷含量均高于其他几个遮光处理。生产中重庆地区为预防血橙冬季落果,通常采用冬季树体覆膜技术进行保果,因此,在冬季血橙覆PE膜保果时为了降低对血橙果面正常着色的影响最好选用无颜色的透明膜。

