厄贝沙坦对高血压合并2型糖尿病大鼠胰岛素抵抗IRS-1/PI3K/GLUT4信号通路的影响
刘莉, 罗鹏, 周田田, 李燕, 谢红艳, 吕德
1.攀钢集团总医院内分泌科,四川 攀枝花 617000; 2.成都中医药大学附属医院基地办公室,成都 610075 3.成都中医药大学附属医院内分泌科,成都 610075
高血压、2型糖尿病(type 2 diabetes mellitus,T2DM)作为慢性代谢性疾病是影响人类寿命的两大重要风险因素。高血压是T2DM的常见并发症,在T2DM患者中伴有高血压患者高达40%左右,由于其高发病率和高死亡率已经成为世界范围内的健康问题[1]。研究发现胰岛素抵抗(insulin resistance,IR)与多种代谢性疾病有关[2],IR可能是高血压与T2DM的共同致病因素,因此有效调控IR,是防治高血压与T2DM的重要手段之一。已有研究表明[3],IR与胰岛素受体底物家族失调,进而导致葡萄糖转运蛋白表达异常有着密切的关系。其中胰岛素受体基因-1(insulin receptor substrate-1,IRS-1)是胰岛素受体底物家族中的一员,在骨骼肌中高表达。而骨骼肌中IRS-1异常磷酸化或表达减少会造成胰岛素代谢调节的主要信号通路IRS-1/磷脂酰肌醇(-3)激酶(phosphatidylinositol 3-kinase regulatory,PI3K)/葡萄糖转运蛋白4(glucose transport protein GLUT4,GLUT4)通路受损,最终导致IR[4]。厄贝沙坦是一种常用降压药物,研究表明厄贝沙坦能够减轻胰岛素抵抗作用,而其机制尚不明确[5]。本研究通过观察厄贝沙坦对高血压合并T2DM大鼠的影响,探讨该药是否通过调节IRS-1/PI3K/GLUT4信号通路对胰岛素抵抗大鼠发挥作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 6周龄SPF级雄性自发性高血压大鼠(spontaneous hypertensive rats,SHR)30只和与SHR遗传背景相同的Wistar-Kyoto(WKY)大鼠10只购自上海莱克公司,体重为(200±2)g,饲养于本院动物实验中心,饲养室保持良好通风,饲养环境温度为(25±2)℃,湿度(50±10)%,12 h循环光照。正常饲养1周以适应环境,第2周开始进行实验。
1.1.2 主要试剂和仪器 链脲佐菌素(streptozotocin,STZ)(美国Sigma公司),厄贝沙坦片(批号:J20110026,江苏恒瑞医药股份有限公司),马来酸罗格列酮片(文迪雅)(批号:H20020475,葛兰素史克公司),罗氏活力型血糖试纸(德国Roche Diagnostics GmbH公司),胰岛素试剂盒、游离脂肪酸试剂盒(美国Cayman公司),包埋剂(optimal cutting temperature compound,OCT)购自北京普利莱基因技术有限公司,全蛋白抽提试剂盒(德国QIAGEN公司),Western blot试剂盒(美国BD公司),IRS-1、PI3Kp85、AKT、p-AKT及GLUT4抗体(美国Abcam公司)。RBP-IB型血压计(北京中日友好临床医学研究所);血糖仪(美国Jhonson医疗器械有限公司);台式离心机(北京医用离心机厂);Nikon Ti-U/Ti-s倒置荧光显微镜(日本三菱公司)。
1.2 实验方法
1.2.1 动物模型建立及取样 根据Wong等人[6]的方法对SHR大鼠建立T2DM模型,SHR大鼠高糖髙脂饲料喂养,2周后,计算稳态模型评价胰岛素抵抗指数(HOMA-IR),HOMA-IR=空腹血清胰岛素浓度(μU/ml)×空腹血浆葡萄糖浓度(mmol/L)/22.5。成功诱导出胰岛素抵抗(HOMA.IR≥3.8),随后禁食12 h,予以腹腔一次性注射STZ,注射剂量为35 mg/kg,1周后空腹12 h,取鼠尾血,检测血糖水平,血糖≥16.7 mmol/L表明T2DM造模成功。取10只WKY大鼠作为对照组给予普通饲料喂养并注射生理盐水。造模成功后将30只SHR合并T2DM大鼠随机分为模型组、厄贝沙坦低、高剂量组,每组10只;厄贝沙坦低、高剂量组每日分别按30、60 mg/kg剂量灌服[7],对照组和模型组灌服等量生理盐水,连续5周,观察摄食量及饮水量的变化,并于每周末称量大鼠体重。造模后第5周,禁食8 h,尾部取血备用,处死后取骨骼肌组织,一部分固定于4%甲醛,一部分于-80℃保存。
1.2.2 大鼠SBP、FBG、FINS检测及HOMA-IR计算分别于造模后、处死前采取套尾法测量大鼠收缩压(systolic blood pressure,SBP),取大鼠尾部血,使用快速血糖仪,采血前将血糖试纸插入仪器内,在尾静脉处滴血测空腹血糖值;取各组大鼠眼眶血,3000 rpm离心15 min,取血清为待测样本。ELISA试剂盒测定血清中FINS含量,具体操作依照试剂盒说明书进行。反应中止后,采用酶标仪测量450 nm处的OD值,计算大鼠胰岛素浓度。根据公式HOMA-IR=(FBG×FINS)/22.5计算HOMA-IR[8]。
1.2.3 HE染色检测大鼠骨骼肌组织冰冻切片 各组大鼠骨骼肌组织在4%多聚甲醛溶液中4℃固定2 h,包埋剂(optimal cutting temperaturecompound,OCT)包埋,切成4μm的切片。然后依次脱蜡、水化,进行HE染色、脱水、二甲苯充分浸泡2 h直至透明后干燥。用中性树胶封片,光学显微镜下观察组织形态并拍摄。
1.2.4 免疫荧光检测大鼠骨骼肌组织GLUT4的表达取各组大鼠骨骼肌冰冻切片用5%BSA的封闭液室温封闭1 h,将GLUT4一抗以1:100比例稀释并滴加在切片上,室温孵育2 h,PBS冲洗干净,加稀释好的荧光标记的二抗于37℃避光作用1 h,用稀释好的DAPI染细胞核,封片并置于共聚焦显微镜下观察拍照。
1.2.5 Western blot检测大鼠骨骼肌组织IRS-1、PI3Kp85、AKT及p-AKT蛋白表达 分别收集各组样本,用总蛋白提取试剂盒分别提取组织及细胞中总蛋白,BCA蛋白定量试剂盒测定蛋白含量。制备蛋白样品并进行SDS-PAGE凝胶电泳,然后转至PVDF膜,加含有5%BSA的封闭液室温下封闭2 h。加入IRS-1(1:1000)、PI3Kp85(1:1000)、AKT(1:1000)及磷酸化AKT(p-AKT)(1:1000)一抗于4℃封闭过夜。次日用缓冲液清洗PVDF膜3次,加入标记HRP的二抗,室温孵育1 h后,加入显色液曝光显影。
1.3 统计学分析
数据统计采用SPSS 19.0软件,作图工具采用Graphpad 5.01,两组间比较采用t检验,P<0.05表示具有统计学意义。
2 结果
2.1 厄贝沙坦对大鼠饮食、饮水及体重的影响
经高糖高脂饮食联合STZ造模后,大鼠先后出现饮食、饮水增加现象;在给与厄贝沙坦治疗后,随时间增加,不同剂量组大鼠均比模型组饮食、饮水量减少。分别于造模后的5个周末称量大鼠体重,结果如图1所示,对照组大鼠在实验观察期内体重持续增加;与对照组相比,模型组大鼠体重在造模后1至5周持续下降,差异具有统计学意义(P<0.05);与模型组比较,厄贝沙坦各组大鼠体重逐渐增加,差异具有统计学意义(P<0.05),厄贝沙坦高剂量组大鼠体重增加更加明显,差异具有统计学意义(P<0.05)。
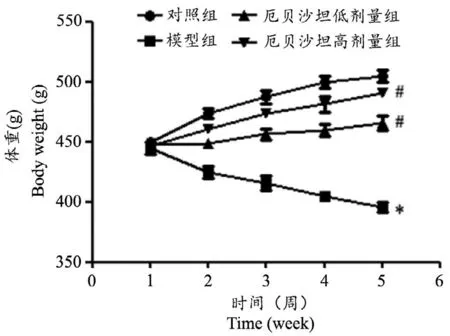
图1 厄贝沙坦对大鼠体重的影响(n=10)*P<0.05,与对照组比较#P<0.05,与模型组比较Fig.1 Effect of Irbesartan on body weight in rats(n=10)*P<0.05 vscontrol group,#P<0.05 vsmodel group
2.2 厄贝沙坦对大鼠SBP、FBG、FINS及HOMA-IR的影响
造模后,与对照组相比,其余各组大鼠SBP、FBG、FINS及HOMA-IR显著升高,差异具有统计学意义(P<0.01);处死前,与对照组相比,模型组SBP、FBG、FINS及HOMA-IR明显升高(P<0.01),与模型组相比,厄贝沙坦低、高剂量组大鼠以上指标均减少(P<0.05,P<0.01)。另外,与造模后相比,厄贝沙坦低、高剂量组在处死前SBP、FBG、FINS及HOMA-IR均下降(P<0.05),而对照组和模型组差异不显著(P>0.05),见图2。
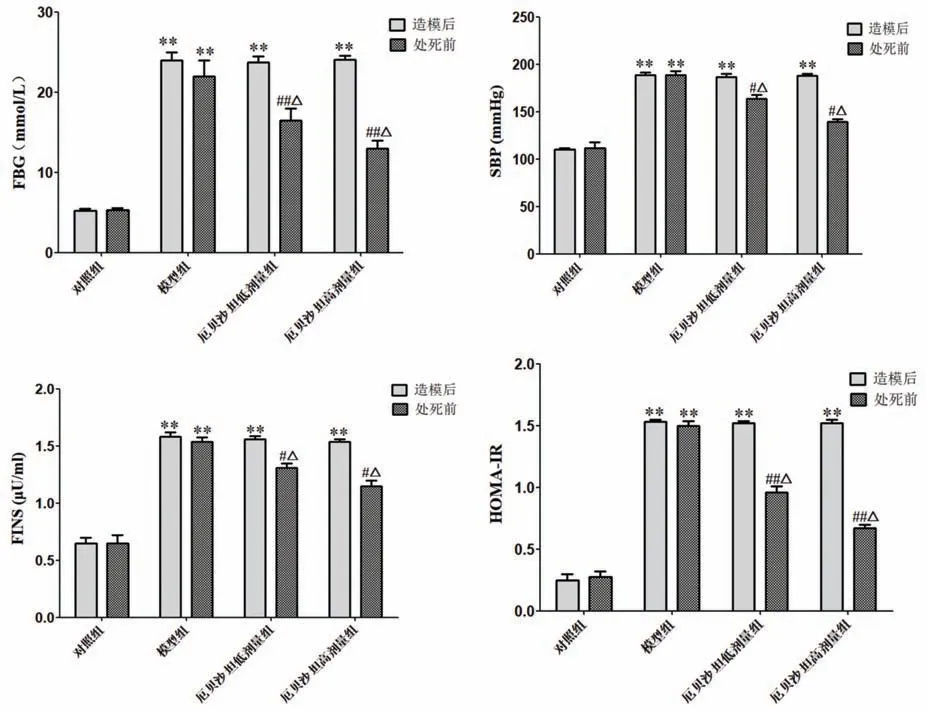
图2 厄贝沙坦对大鼠FBG、SBP、FINS及HOMA-IR的影响(n=10)**P<0.01,与对照组比较#P<0.05,##P<0.01,与模型组比较ΔP<0.05,与造模后第1周比较Fig.2 Influence of Irbesartan on rat FBG,SBP,FINSand HOMA-IR(n=10)**P<0.01 vscontrol group,#P<0.05,##P<0.01 vsmodel group,ΔP<0.05 vsafter modeling at 1 week
2.3 厄贝沙坦对大鼠骨骼肌组织的影响
结果如图3所示,对照组大鼠骨骼肌肌纤维排列正常,细胞核排列有序,未见炎性浸润;而模型组大鼠骨骼肌肌纤维排列紊乱,间隙增加,有波浪样改变,细胞核异位;与模型组相比,厄贝沙坦低、高剂量组肌纤维排列有不同程度的恢复。
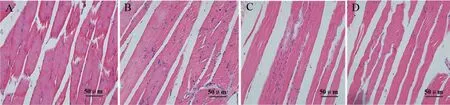
图3 厄贝沙坦对大鼠骨骼肌组织的影响 A:对照组B:模型组C:厄贝沙坦低剂量组D:厄贝沙坦高剂量组Fig.3 Effect of Irbesartan on skeletal muscle tissue of rats A:Control group;B:Model group;C:Irbesartan low-dose group;D:Irbesartan high-dosegroup
2.4 厄贝沙坦对大鼠骨骼肌组织中GLUT4表达的影响
为进一步验证厄贝沙坦是否调节IRS-1/PI3K通路下游葡萄糖转运相关的关键蛋白GLUT4的表达,采用免疫荧光检测各组大鼠骨骼肌组织中GLUT4的表达。结果如图4所示,GLUT4主要定位于细胞膜,与对照组相比,模型组中GLUT4的表达明显减少;与模型组相比,厄贝沙坦低、高剂量组大鼠骨骼肌组织中GLUT4表达均增加(P<0.05)。
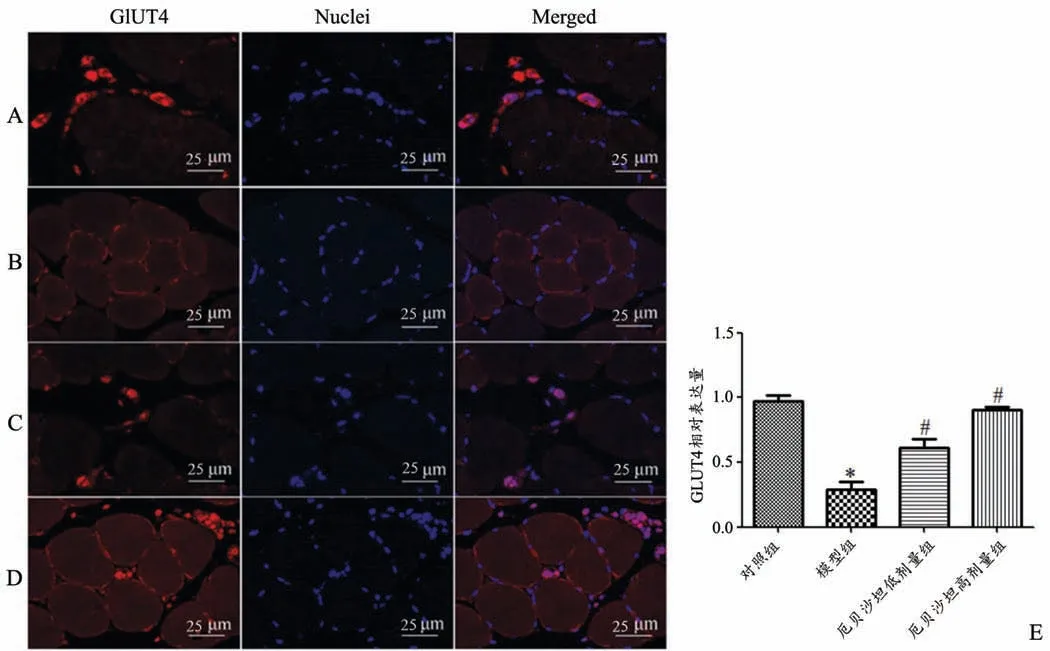
图4 厄贝沙坦对大鼠骨骼肌组织GLUT4表达的影响(n=10)A:对照组B:模型组C:厄贝沙坦低剂量组D:厄贝沙坦高剂量组;E:各组GLUT4相对表达量统计图*P<0.05,与对照组比较#P<0.05,与模型组比较Fig.4 Effect of Irbesartan on GLUT4 expression in skeletal muscletissueof rats(n=10)A:Control group;B:Model group;C:Irbesartan low-dosegroup;D:Irbesartan high-dose group;E:Statistical chart of GLUT4 relative expression level;*P<0.05 vs control group;#P<0.05 vs model group
2.5 厄贝沙坦对大鼠骨骼肌组织IRS-1及PI3K通路相关蛋白表达的影响
与对照组比较,模型组IRS-1、PI3Kp85及p-AKT的表达明显降低(P<0.05);与模型组比较,厄贝沙坦低、高剂量组大鼠IRS-1、PI3Kp85及p-AKT的表达均增多(P<0.05),见图5。
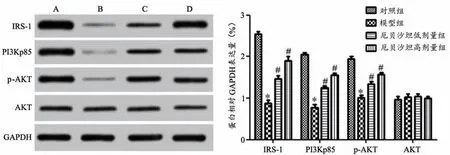
图5 厄贝沙坦对大鼠骨骼肌组织IRS-1及PI3K通路相关蛋白表达的影响(n=10)A:对照组B:模型组C:厄贝沙坦低剂量组D:厄贝沙坦高剂量组*P<0.05,与对照组比较#P<0.05,与模型组比较Fig.5 Effect of Irbesartan on theprotein expression of irS-1 and PI3K pathway in skeletal muscletissuesof rats(n=10)A:Control group;B:Model group;C:Irbesartan low-dose group;D:Irbesartan high-dose group;*P<0.05 vs Control group;#P<0.05 vs model group
3 讨论
高血压合并T2DM是一种临床常见疾病类型,其发病机制及病因不明确,严重时会引起并发症威胁患者生命。研究发现,高血压、糖代谢异常者均存在高胰岛素血症,IR也被认为是高血压与T2DM主要的共同病理机制之一[9]。IR使机体中胰岛素作用的靶组织(肝脏、骨骼肌、脂肪等)对胰岛素作用的敏感性降低,无法正常响应胰岛素,葡萄糖摄取和处理能力降低,从而导致体内血糖升高,胰岛素抵抗还可刺激交感神经系统,心排血量增加,血管收缩或血管张力增加。
厄贝沙坦是一种血管紧张肽Ⅱ受体拮抗药,能有效阻断血管紧张肽Ⅱ的血管收缩而起到平稳血压的作用。有研究发现厄贝沙坦能通过提高大鼠骨骼肌胰岛素介导的葡萄糖转运而增加对胰岛素的敏感性[10];厄贝沙坦能够促进胰岛素分泌、抑制胰高血糖素的释放从而有效改善高胰岛素血症[11]。因此本研究通过对SHR合并T2DM大鼠灌服不同剂量的厄贝沙坦,观察厄贝沙坦对大鼠的保护作用。结果显示,SHR合并T2DM大鼠给予厄贝沙坦后体重有不同程度的增加,血压、血糖等指标有不同程度的降低,通过HE染色检测大鼠骨骼肌的病理变化也发现厄贝沙坦能明显改善SHR合并T2DM大鼠骨骼肌组织中肌纤维排列紊乱,间隙增加及波浪样改变的情况,表明厄贝沙坦能够促进SHR合并T2DM大鼠的恢复。
PI3K/AKT信号通路是胰岛素在葡萄糖代谢中的经典途径[12]。胰岛素通过与靶细胞表面的胰岛素受体(Insulin receptor,InsR)结合,激活β亚基酪氨酸激酶并与胰岛素结合发生自磷酸化,进一步激发细胞内胰岛素受体底物IRS家族磷酸化,其中被激活的IRS-1可与PI3K的p85调节亚基结合并使AKT发生磷酸化。GLUT4蛋白是IRS-1/PI3K通路下游葡萄糖转运相关的关键蛋白,主要定位于细胞膜,AKT发生磷酸化后可加速GLUT4从细胞内转移至细胞膜,与细胞膜融合,增加葡萄糖的摄取[13]。大部分胰岛素代谢活动通过PI3K通路激活,而当这条信号通路上的任何一个环节被减弱或抑制后均可能抑制胰岛素生理作用进而导致IR。研究显示通过调节PI3K信号通路可影响T2DM大鼠骨骼肌中葡萄糖的摄取和利用[14]。Abdelmageed等人[15]也表明PI3K/AKT信号通路受损与糖尿病大鼠肝胰岛素抵抗密切相关。本研究通过Western blot检测各组大鼠骨骼肌中IRS-1/PI3Kp85/GLUT4通路蛋白表达,发现与对照组相比,模型组中除AKT无 明 显 变 化,IRS-1、PI3Kp85、p-AKT及GLUT4表达均明显下降,而与模型组相比,厄贝沙坦各组IRS-1、PI3Kp85、p-AKT及GLUT4表达均有不同程度的上升。提示厄贝沙坦能够通过IRS-1/PI3K/GLUT4信号通路抑制SHR合并T2DM大鼠IR,调节体内胰岛素及葡萄糖利用,进而发挥对SHR合并T2DM大鼠的保护作用。
综上所述,厄贝沙坦可通过促进IRS-1/PI3K/GLUT4信号通路对SHR合并T2DM大鼠发挥保护作用,本研究能够为临床治疗提供一定的理论依据。