MTHFR基因多态性与乳腺癌替吉奥治疗效果的关系分析
丁明明 李芸蕊 郑芝欣 袁小笋
乳腺癌是女性常见恶性肿瘤,其发病率据女性恶性肿瘤首位,近年来我国发病率逐渐上升,且呈年轻化,严重威胁女性健康[1]。化疗仍是目前治疗乳腺癌的重要方法,仍以蒽环类及紫杉类为基础化疗为主,但是常因其不良反应限制应用[2]。替吉奥是新一代氟尿嘧啶衍生物口服抗癌剂,含有替加氟(FT)和两种生化修饰剂——吉美嘧啶(CDHP)及奥替拉西(OXO),国外研究表明替吉奥对于乳腺癌具有疗效高,不良反应小的特点[3]。然而不同患者的疗效仍存在明显差别,说明患者在药物敏感性上存在个体差别,有研究表明亚甲基四氢叶酸还原酶(methylenetetrahydrofolatereductase,MTHFR)与乳腺癌的化疗敏感性有关[4]。MTHFR是一种黄素蛋白,基因定位于1p36.3,参与叶酸代谢,在DNA甲基化中起着重要作用[5]。MTHFR基因是多态的,最常见的是C677T和A1298C,这两个位点的突变都会影响该酶活性,进而影响基因组DNA的甲基化[6]。因此本文对在我院进行替吉奥治疗的乳腺癌患者进行MTHFR基因分析,探究MTHFR基因多态性与临床疗效的关系,以期为临床提高敏感性寻找预测指标,从而指导临床用药,报告如下。
1 资料与方法
1.1 研究对象
选择2016年3月至2018年3月来我院就诊的乳腺癌女性患者138例,年龄为29~76岁,平均年龄(61.31±5.84)岁,其中仅有乳腺原发灶患者84例,同时有原发灶和腋淋巴结转移患者54例,无远处转移患者。纳入标准:①经病理证实为乳腺癌;②经影像学证实具有可测量肿瘤病灶;③预计生存期>3个月,KPS>60分,且肝、肾、心功能及血常规基本正常;④1个月内未用其他化疗药物者。排除标准:①伴有其他恶性肿瘤患者;②合并其他严重疾病;③妊娠期或哺乳期患者;④出现感染患者。本研究经医学伦理委员会同意。
1.2 基因型分析
1.2.1 标本采集 所有患者化疗前抽静脉血2 ml,置乙二胺四乙酸钠抗凝管,分离白细胞层。用QIAampDNA提取试剂盒提取白细胞DNA,DNA置-30 ℃低温冰箱保存备用。
1.2.2 引物设计 针对两种不同位点进行引物设计,引物序列见表1,引物由上海杰李生物技术有限公司合成。
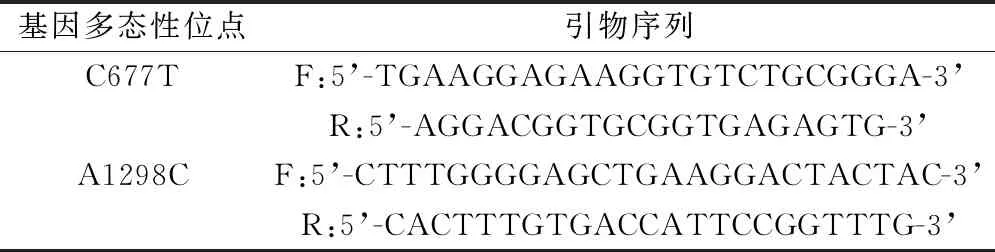
表1 RT-PCR引物序列
1.2.3 基因分型分型 应用PCR-RFLP技术检测两种基因型,PCR反应体系总体积为25 μl,含10×Buffer 2.5 μl,PCR引物各1.0 μl、dNTP mixture 2.5 μl、Taq聚合酶1IU、基因DNA 0.5 μl。反应条件:94 ℃预变性2 min,变性94 ℃ 30 s、退火30 s(MTHFR C677T为62 ℃,MTHFR A1298C为58 ℃),72 ℃ 30 s,共35个循环;72 ℃延伸7 min。采用Sequenom公司的时间飞行质谱生物芯片系统(Mass Array系统)检测基因分型。MTHFR C677T基因型分为纯合子C/C(198bp)、纯合子T/T(175bp)、杂合子C/T(198bp/175bp),MTHFR A1298C基因型分为纯合子AA(56bp)、纯合子CC(84bp)和杂合子AC(56bp/84bp)。
1.3 治疗方法
患者均采用吉他西滨(连云港杰瑞药业有限公司,国药准字 H20123362)及替吉奥(山东新时代药业有限公司,国药准字H20080803)治疗,吉他西滨1000 mg/m2,加入0.9%氯化钠注射液100 ml,静脉注射30 min,第1、8天。替吉奥剂量:<1.25 m2服用40 mg,1.25~1.5 m2服用50 mg,>1.5 m2服用60 mg,每日2次,于早晚进行服药,连续给药28 d,休息14 d,为一个治疗周期,患者均治疗3个周期。
1.4 观察指标
(1)患者治疗效果:按照实体瘤疗效评价标准(RECIST)[7]判定疗效:完全缓解(complete response,CR):病灶完全消失,短轴值<10 mm;部分缓解(partial remission,PR):未达到CR,肿瘤病灶半径之和缩小30%以上;稳定(stable disease,SD):肿瘤病灶半径之和即达不到PR也达不到PD;进展(progressive disease,PD):肿瘤病灶半径之和增加20%以上,半径总和增加绝对值大于5 mm,或出现新病灶;总有效率(overall response rate,ORR)=(CR例数+PR例数)/总例数×100%。(2)患者化疗不良反应率:依据WHO抗癌药物急性与亚急性毒性反应分级标准将化疗不良反应分为0~Ⅳ度[8],记录两组患者不良反应发生情况。(3)随访:以电话及门诊形式对所有患者进行随访,随访内容包括:患者病情进展、影像学检查,记录患者生存情况,在第1年每3个月随访1次,第2~3年,每6个月随访1次,随访截止时间。
1.5 统计学方法

2 结果
2.1 MTHFR基因型与乳腺癌替吉奥治疗疗效关系
138例患者的总有效率为71.01%,携带MTHFR C677T基因型患者中T/T基因型40例,化疗有效率87.50%,C/T基因型65例,化疗有效率73.85%,C/C基因型33例,化疗有效率45.45%。T/T基因型患者的临床有效率高于C/C基因型(P<0.05),与C/T基因型比较无统计学差异(P>0.05)。携带MTHFR A1298C基因型患者中A/A基因型99例,化疗有效率为74.75%,A/C基因型39例,化疗有效率61.54%,C/C基因型0例。A/A基因型患者的临床有效率与A/C及C/C患者比较差异无统计学意义(P>0.05),结果见表2。
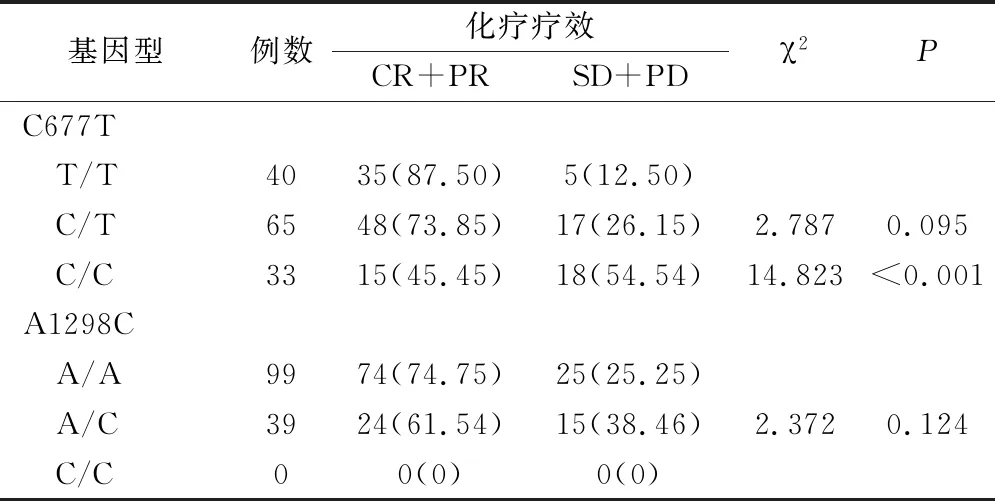
表2 MTHFR基因型与乳腺癌替吉奥治疗疗效关系(例,%)
2.2 MTHFR基因型与乳腺癌替吉奥化疗不良反应发生率的关系
138例患者中出现Ⅰ~Ⅲ级化疗不良反应发生率为63.77%,其中携带MTHFR C677T T/T基因型患者的化疗不良反应发生率为82.50%,C/T基因型为66.15%,C/C基因型为36.36%;T/T基因型化疗不良反应发生率高于C/C基因型(P<0.05),与C/T基因型无明显差异(P>0.05)。携带MTHFR A1298C A/A基因型患者的化疗不良反应发生率68.69%,A/C基因型为51.28%,A/A基因型化疗不良反应发生率与A/C及C/C患者比较差异无统计学意义(P>0.05),结果见表3。
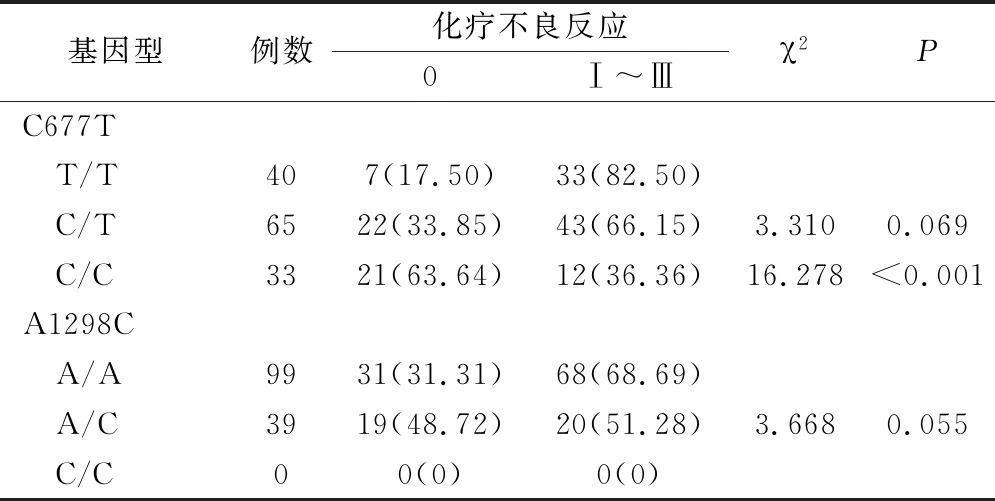
表3 MTHFR基因型与乳腺癌替吉奥化疗不良反应发生率的关系(例,%)
2.3 不同基因型患者替吉奥治疗后生存率分析
138例患者的3年无进展生存率为63.04%,其中携带MTHFR C677T T/T、C/T、C/C基因型患者的3年无进展生存率分别为80.00%、69.23%、30.30%,T/T基因型的3年无进展生存率高于C/C基因型(P<0.05),与C/T基因型比较无统计学差异(P>0.05);携带MTHFR A1298C A/A、A/C、C/C基因型3年无进展生存率分别为66.67%、53.85%、0,A/A基因型3年无进展生存率与A/C、C/C基因型比较无统计学差异(P>0.05)。138例患者的3年总生存率为81.88%,其中携带MTHFR C677T T/T、C/T、C/C基因型患者的3年总生存率分别90.00%、87.69%、60.61%,T/T基因型的3年总生存率高于C/C基因型(P<0.05),与C/T基因型比较无统计学差异(P>0.05);携带MTHFR A1298C A/A、A/C、C/C基因型3年总生存率分别为84.85%、74.36%、0,A/A基因型3年总生存率与A/C、C/C基因型比较无统计学差异(P>0.05),结果见表4、图1、图2。
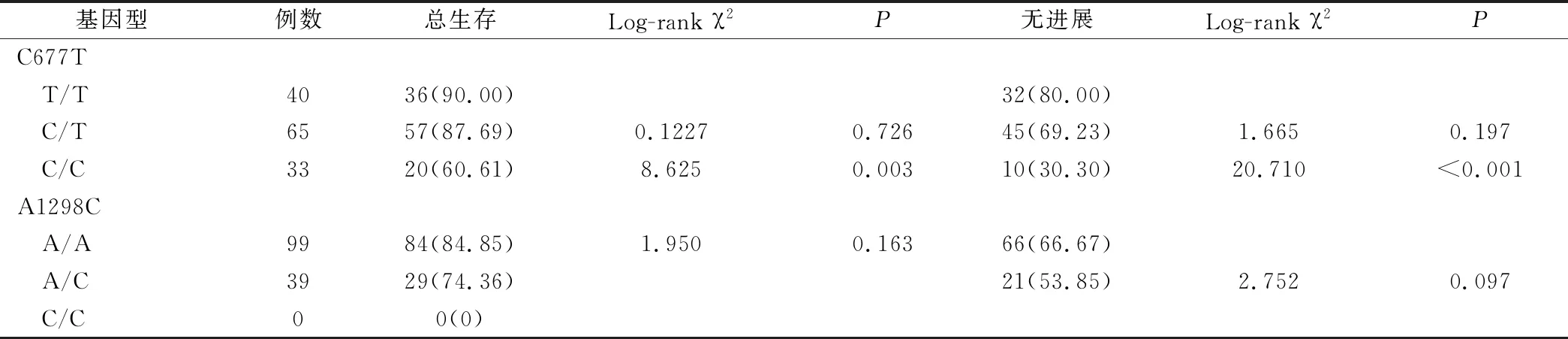
表4 不同基因型患者替吉奥治疗后生存率分析(例,%)
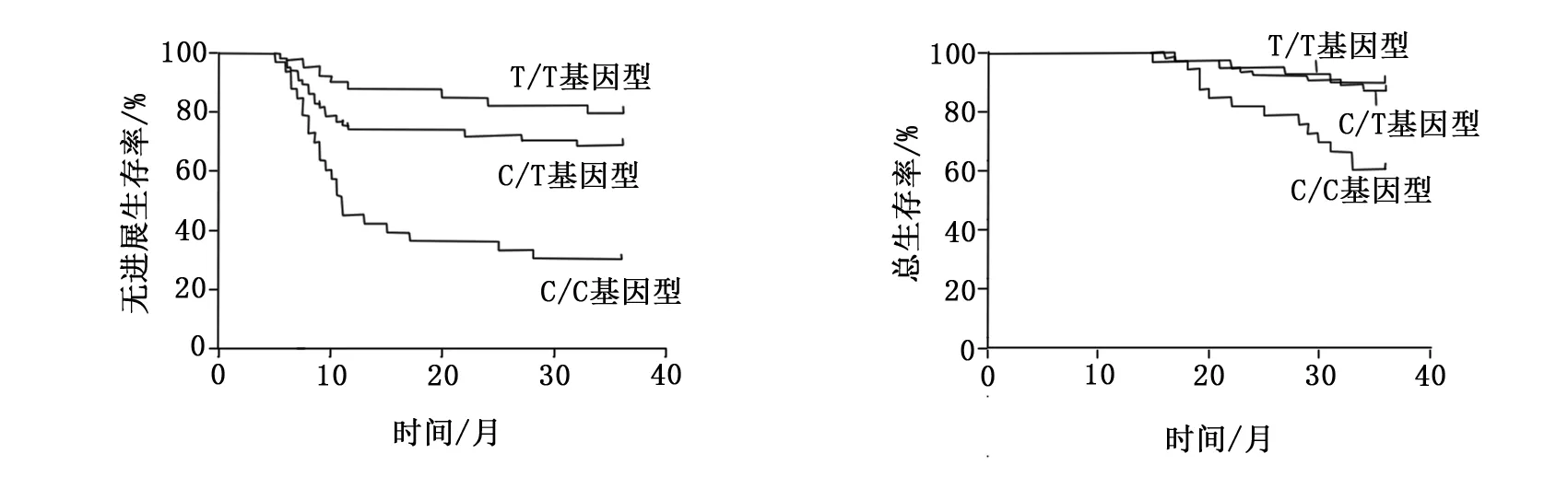
图1 Kalplan-Meier法分析MTHFR C677T基因型患者生存情况
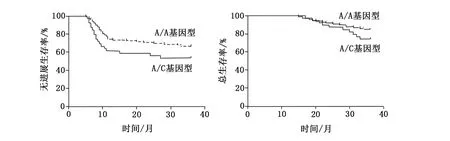
图2 Kalplan-Meier法分析A1298C基因型患者生存情况
3 讨论
MTHFR是调节叶酸和蛋氨酸代谢的酶,能够催化5,10-亚甲基四氢叶酸(5,10-MTHF)转变为5-甲基四氢叶酸,5-甲基四氢叶酸是叶酸在血液及组织中存在的主要形式,能够作为甲基供体经蛋氨酸合成酶的催化,使同型半胱氨酸转化为蛋氨酸,进而转化为S-腺苷蛋氨酸,在DNA甲基化中起重要作用,从而影响DNA的合成及修复,并导致癌症的发生[9]。若MTHFR酶活力降低,则会导致同型半胱氨酸水平的升高[10]。MTHFR基因位于1号染色体上,该基因是多态的,其中最常见的是677C→T和1298A→C多态,位于这2个位点的改变都将影响酶的活性[11]。近来已有研究表明,MTHFR基因多态性与肿瘤的易感性相关,程筱雯等[12]研究表明MTHFR C677T的多态性与消化系统恶性肿瘤发生频率相关。而叶彦军等[13]研究表明MTHFR基因多态性通过影响DNA合成及甲基化导致乳腺癌的发生,并与其发展及预后相关。
乳腺癌是常见女性恶性肿瘤,氟尿嘧啶已被证实可有效控制乳腺癌的病情进展,替吉奥是第三代氟尿嘧啶衍生物,其中的FT在线粒体内生成5-Fu,CDHP可减轻药物消化道反应,OXO为DPD酶抑制剂,可减少药物的降解,其疗效良好[14]。但不同个体对药物的敏感性还是有很大差异,若个体的DNA修复能力较强,则药物的疗效较差。从基因组学研究药物敏感性差异的原因,对于寻找可预测药物敏感性的指标,及临床指导用药具有重大意义[15]。已有部分研究表明MTHFR基因多态性与胃肠癌等化疗敏感性相关,如马丙钧等[16]纳入11项研究表明MTHFR C677T基因多态性在等位基因模型、纯合子模型、显性模型及隐形模型中,均与5-Fu治疗胃肠癌的敏感性增加有关。还有研究[17]表明MTHFR基因MTHFR C677T及A1298C的SNP对晚期结直肠癌一线化疗药物的疗效具有预测效果。而关于MTHFR基因多态性与乳腺癌化疗敏感性的研究较为少见,因此本文对MTHFR基因多态性与替吉奥治疗乳腺癌的敏感性进行研究。
本研究中,经化疗后,携带MTHFR C677T T/T基因型患者的临床有效率、化疗不良反应发生率、3年无进展生存率及3年总生存率均高于C/C基因型,而与C/T型患者无明显差异。说明MTHFR C677T的基因多态性与替吉奥治疗乳腺癌的疗效具有一定相关性,有可能成为预测其化疗敏感性的重要指标。而携带MTHFRA1298C A/A基因型患者的临床有效率、化疗不良反应发生率、3年无进展生存率及3年总生存率与A/C及C/C患者无明显差异,说明MTHFR A1298C基因多态性对替吉奥治疗乳腺癌疗效的敏感性不如MTHFR C677T。本文也存在一定不足,乳腺癌相关基因多态性很多,本文仅研究2个位点,未探究不同基因型组合之间的酶活性的差别,且本文中样本量较少,并未考虑环境与基因的交互影响,同时研究时间不够长,会对本文的研究结果的可靠性产生一定影响,因此后期将扩大样本量,联合多中心,延长时间研究。
综上,MTHFR基因多态性与乳腺癌替吉奥治疗临床疗效存在着相关性,对预测疗效有一定前景。

