乳腺导管内癌的钼靶钙化表现与其术后病理指标的相关性
魏红霞 陈 体 王良敏
早期乳腺癌因无症状,往往需要影像学检查来辅助诊断,其中钼靶的出现及普及,使得临床未触及的微钙化检出率越来越高,显著提高了乳腺癌的临床诊断率[1]。随着分子生物学的不断发展,雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体-2(HER-2)及Ki-67被认为在某种程度上会直接影响到肿瘤的生物学行为,进而改变肿瘤细胞的形态特征、生长方式、恶性程度、转移、复发,并会改变其对内分泌治疗的敏感性[2-3]。本研究通过将分子标志物与钼靶钙化情况结合起来,分析其相关性,旨在提供更多的信息来判定乳腺癌的发生、转移、复发及治疗预后。
1 资料与方法
1.1 一般资料
选取2018年1月至2020年5月我科收治的102例乳腺导管内癌患者(均经术后病理证实),年龄范围为42~77岁,平均年龄为(53.5±3.8)岁。
1.2 检查设备及方法
全数字化乳腺摄影机设备购自美国 HOLOGIC Selenia,术前对患者实施常规的双斜位(MLO位)和双侧乳腺轴位(CC位)检查,选择全自动曝光的模式,如有必要可以增加放大侧位和局部点压位置摄片。依据美国放射学会(ACR)制定的“乳腺影像报告和数据系统”(BI-RADS)的标准,让至少两名具有多年评估乳腺 X 线的放射科医生阅片,并进行相关分析。主要观察钙化情况:钙化形态分为5型:①M1,细小多形性;②M2,粗大不均质;③M3,细线或分支样;④M4,针尖样或点状;⑤M5,不定形。钙化分布分为4型:①D1,群集分布;②D2,区域样分布;③D3,段样分布;④D4,沿导管分布。
1.3 免疫组化检查方法
让病理科取患者术后标本,将其制作成切片进行诊断,对切片进行S-P法染色,观察其中的PR 、ER、Ki-67及Her-2表达情况。ER、PR阳性判定主要以癌细胞的细胞核中出现棕黄色颗粒为准;Her-2阳性则以癌细胞的细胞膜位置出现明显的棕褐色物质为准。依据所选择切片的视野中染色强度和阳性细胞数进行判定阳性:其中阴性为阳性细胞的数量占比<10%,弱阳性(+)为阳性细胞的数量占比≥10%~25%,中等阳性(++)为阳性细胞的数量占比>25%~50%之间,强阳性(+++)则为阳性细胞的数量占比>50%。Ki-67细胞核着色即为阳性。本文中 ER、PR(-)为阴性表达,(+)、(++)、(+++)为阳性表达;Her-2(-)、(+)归为阴性表达,(++)、(+++)为阳性表达。同时根据St.Gallen 国际乳腺癌会议中对于乳腺癌分子分型的共识[4]:其中 Ki-67表达<14%为阴性表达组,Ki-67表达≥14%为阳性表达组。
1.4 评估指标
①分析患者钼靶钙化形态表现及分布表现情况;②分析患者钼靶钙化形态与病理相关指标关系;③分析乳腺导管内癌钼靶钙化分布与病理相关指标关系。
1.5 统计学方法
应用SPSS19.0 软件统计分析。计数资料用例数和率表示,组间差异比较采用卡方检验或确切概率法。当P<0.05时,差异有统计学意义。
2 结果
2.1 乳腺导管内癌患者钼靶钙化形态表现情况分析
钙化形态以M1为主,占比为67.6%(69/102),其余钙化形态总占比为32.4%(33/102),分别为M2占比为8.8%(9/102)、M3占比为10.8%(11/102)、M4占比为9.8%(10/102)、M5占比为3.0%(3/102)。
2.2 乳腺导管内癌患者钼靶钙化分布表现情况分析
钙化分布以D1为主,占71.6%(73/102),其余钙化分布总占比为28.4%(29/102),分别为D2占比为8.8%(9/102),D3占比为13.7%(14/102),D4占比为7.9%(6/102)。
2.3 乳腺导管内癌钼靶钙化形态及钙化分布与相关病理指标关系
钙化形态非M1和M1组中的乳腺导管原位癌ER、PR、HER2、Ki-67表达情况和病理分级之间比较无差异 (P>0.05),乳腺导管原位癌的ER、PR、HER2、Ki-67表达情况及病理分级在钙化分布D1组与非D1组中的构成比均具有差异(P<0.05),见表1。
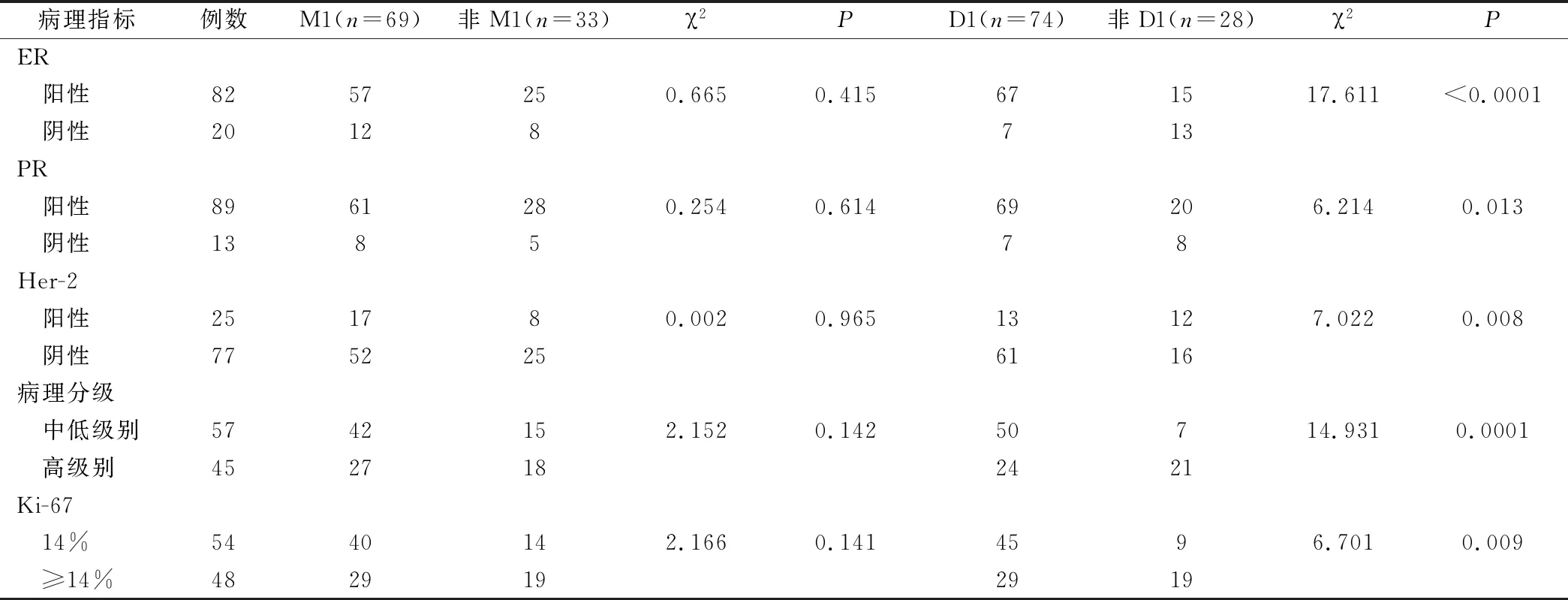
表1 乳腺导管原位癌钼靶钙化形态及钙化分布与相关病理指标关系/例
3 讨论
乳腺导管内癌大多是指范围在导管束中导管上皮细胞出现持续性的恶性增生,并不侵犯间质和基底膜,主要存在于腺泡化的小导管或终末导管小叶单位内的小导管肿,可沿邻近的导管继续生长[5-6]。该疾病被认作是浸润性乳腺癌的早期病变,部分患者可进一步发展为浸润性乳腺癌[7]。目前临床上对于导管内癌的预后评估并无定论,而有研究发现,其术后病理指标ER、PR、Ki-67联合Her-2检测,在诊断乳腺导管内癌局部切除手术后浸润性癌方面具有较好的临床价值[8]。其中当乳腺癌细胞ER及PR表达阴性时,肿瘤细胞的增殖不会被机体的内分泌激素抑制,这类低分化的肿瘤患者预后并不好[9]。而HER2是一种原癌基因,其表达的蛋白能够激活酪氨酸激酶,可以直接调节肿瘤细胞的增殖和分化,因此,过度表达则代表肿瘤的恶性程度较高,治疗预后不佳[10]。另外,大多增殖细胞表面存在Ki-67抗原,直接关系到有丝分裂过程,常常用来反映增殖细胞的关键物质且是一个负性预后因素[11]。但病理检查具有有创性,因此本研究通过将病理标志物与钼靶钙化情况结合起来,分析其相关性,从而为乳腺导管内癌诊断及预后评估进一步提供参考,并指导其临床治疗。
本研究结果证实,乳腺导管内癌阴性的患者临床触诊钙化大多呈现为群集分布,且细小多形。同时结果发现,细小和非多形性钙化肿瘤细胞的各项病理指标构成比对比,并无明显差异,提示其在评估诊乳腺导管内癌细小多形性钙化方面临床价值不高。而乳腺导管内癌表现出的群集分布钙化病理相关指标多数为ER+、PR+、HER2-、Ki-67低表达,或者以低中级别为主乳腺癌细胞核和非群集分布钙化之间对比,差异显著,根据此结果可以推测,若乳腺导管内癌呈现出群集分布钙化则预后相对更好[12]。相关研究也证明低级别乳腺导管内癌坏死不明显,不会分泌大量的粉刺性物质,肿瘤细胞分泌各种物质进一步发生钙化,因此呈沙砾体样较为局限,细小成簇,此与本文研究结果相符,同时和其他生物标志物联合检测,对于评估乳腺导管内癌呈现群集分布钙化患者的预后提供了较为可靠的理论依据[13]。
综上所述,乳腺导管内癌钙化分布特征与PR、ER、HER2、Ki-6表达及乳腺癌细胞核的级别密切相关,乳腺导管内癌群集及非群集分布钙化之间差异明显,可以为其选择合适的临床治疗方案,评估预后提供参考。

