ABCD2评分联合T2 Flair高信号血管征对TIA患者不同时期预后的预测作用
柯国秀,王国军,季立标,张军,严俊,朱银伟
TIA后易再发脑血管病,因此,对TIA患者尽早进行危险分层至关重要。目前针对TIA患者预测再发脑血管病风险普遍采用的是ABCD2评分,但该评分未包含影像学结果,其结合影像学评估是否能进一步提高其预测价值成为近来的研究热点之一。
高信号血管征(HVS)最初由1999年Cosnard等[1]首次报道,是存在于MRI Flair上,在病灶周围蛛网膜下腔的点状或条状高信号影。HVS可用于诊断血管闭塞或狭窄,也可用来评价患者临床病情及预后[2]。
ABCD2评分联合HVS对TIA患者不同时期预后的预测价值研究较少,本文旨在通过研究,对上述问题展开探讨。现报告如下。
1 对象与方法
1.1 对象 选取我科2018年4月至2019年7月符合入选标准的TIA患者。入组标准:(1)诊断标准参照2009美国AHA/ASA关于TIA的定义[3];(2)入选患者均完成头颅CT排除颅内出血,均完善头颅MRI检查,包括T1WI、T2WI、DWI、Flair序列。排除标准:(1)有癫痫、阿-斯综合征、偏头痛发作、晕厥、低血糖等发作性疾病;(2)孕妇、哺乳期妇女;(3)合并严重的心、肝、肺、肾脏系统疾病的患者;(4)病例资料不完整;(5)影像学检查证实有与临床表现相对应的急性缺血性病灶。
1.2 方法
1.2.1 临床资料采集 收集并记录患者的一般基线资料如患者性别、年龄、既往病史等资料(吸烟史、饮酒史,包括过去曾经吸烟、饮酒已戒除或未戒除者);收集患者实验室检测结果如血脂、血糖、糖化血红蛋白等。由神经内科医师采用面对面或电话随访方式,收集患者信息,记录7 d内、90 d内及1年内脑血管病事件的发生情况。
1.2.2 ABCD2评分及危险分层 入院后由经过培训的神经内科主治医师对所有入组患者进行ABCD2量表评分:总分7分。危险因素分层标准:0~3分为低危组,4~5分为中危组,6~7分为高危组。评分时血压结果以TIA后首次获得的血压数据为准,症状持续时间以多次发作中最长发作时间为准。具体评分标准如下:A-年龄(≥60岁)(1分);B-首次就诊时的血压[收缩压≥140 mmHg(1 mmHg =0.133 kPa)或者舒张压≥90 mmHg](1分);C-临床表现单侧无力(2分),言语障碍,不伴肢体无力(1分),无言语障碍或者肢体无力(0分);D-症状持续时间≥60 min(2分),10~59 min(1分),<10 min(0分);D-患有糖尿病(1分)[4]。
1.2.3 MRI检查及HVS评估 采用Philips Achieva 3.0 T MRI扫描仪和多通道头颅线圈。MRI检查包括T1WI、T2WI、Flair、DWI序列。HVS定义为在Flair序列上,有≥1个轴向或冠状层面上邻近灰质表面蛛网膜下腔的高信号影,表现为管状、点状或蛇纹状,常超过一个检查层面[1]。由2名神经科副主任/高年资主治医师及1名影像科医师共同观察评估,经讨论得出统一意见,以此确定HVS发生率。
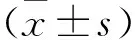
2 结 果
2.1 入选患者基线情况及分组情况 入选68例患者,无失访患者。其中男35例,女33例;年龄42~88岁,平均(66.28±9.47)岁。根据ABCD2评分及危险分层结果显示:低危组21例,中高危组47例。根据MRI检查及HVS评估结果显示:HVS阳性者29例,其中ABCD2评分低危8例,中高危21例;HVS阴性者39例,其中ABCD2评分低危13例,中高危26例。
2.2 HVS阴性组与阳性组危险因素及ABCD2评分的比较 见表1、表2。与HVS阴性组相比,HVS阳性组高血压史、糖化血红蛋白水平、低密度脂蛋白水平、卒中家族史、既往卒中史、ABCD2评分、ABCD2中高危比例显著升高,差异有统计学意义(均P<0.05)。
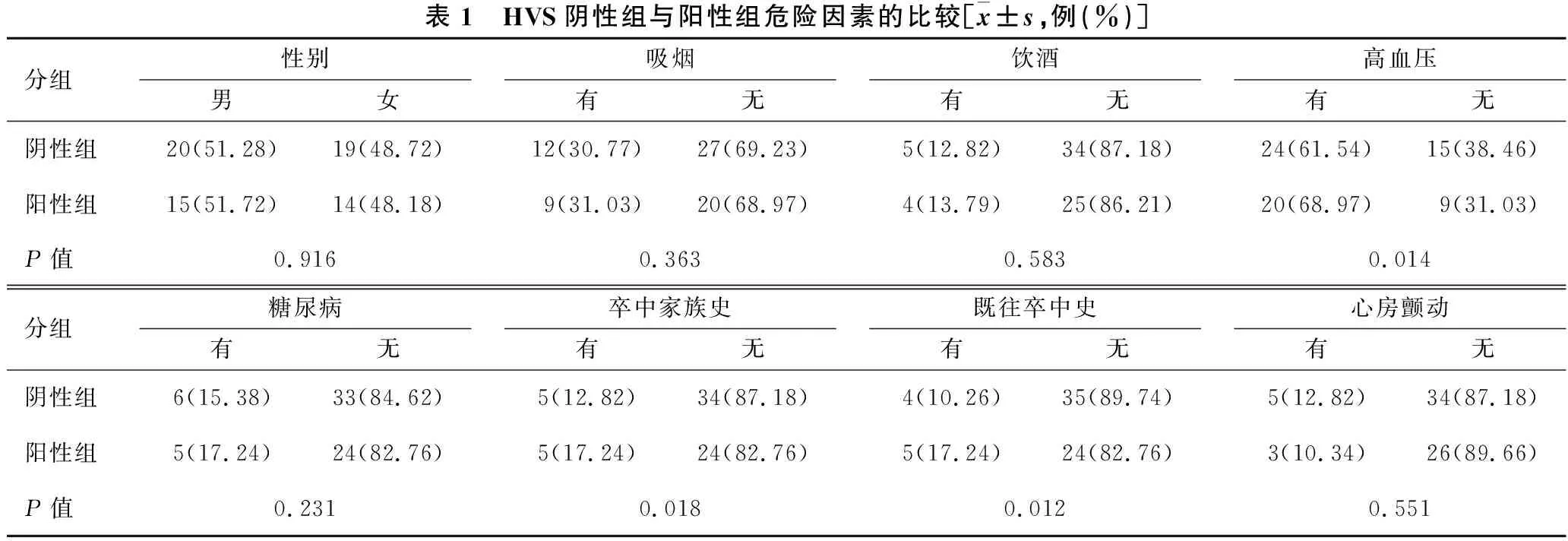
表1 HVS阴性组与阳性组危险因素的比较[x±s,例(%)]分组性别男女吸烟有无饮酒有无高血压有无阴性组20(51.28)19(48.72)12(30.77)27(69.23)5(12.82)34(87.18)24(61.54)15(38.46)阳性组15(51.72)14(48.18)9(31.03)20(68.97)4(13.79)25(86.21)20(68.97)9(31.03)P值0.9160.3630.5830.014分组糖尿病有无卒中家族史有无既往卒中史有无心房颤动有无阴性组6(15.38)33(84.62)5(12.82)34(87.18)4(10.26)35(89.74)5(12.82)34(87.18)阳性组5(17.24)24(82.76)5(17.24)24(82.76)5(17.24)24(82.76)3(10.34)26(89.66)P值0.2310.0180.0120.551

续表
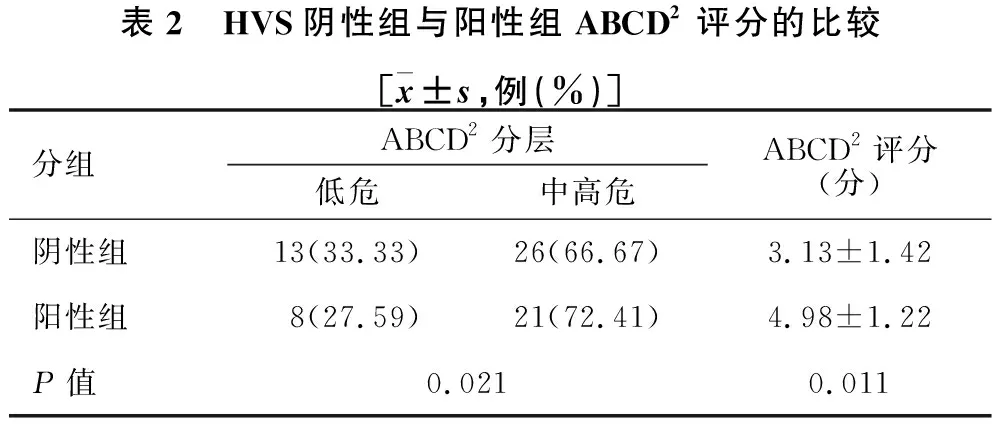
表2 HVS阴性组与阳性组ABCD2评分的比较[x±s,例(%)]分组ABCD2分层低危中高危ABCD2评分(分)阴性组13(33.33)26(66.67)3.13±1.42阳性组8(27.59)21(72.41)4.98±1.22P值0.0210.011
2.3 不同时期脑血管病发生风险的ROC曲线分析见表3、表4、表5、图1、图2、图3。预测脑血管病发生风险时,ABCD2评分分组的7 d内、90 d内、1年内的AUC值分别为0.783、0.645、0.641,表明在短期(7 d)内ABCD2的预测价值最高;二者结合的7 d内、90 d内、1年内的AUC值分别为0.902、0.739、0.786。ROC曲线显示,在预测TIA患者不同时期脑血管病发生风险方面,ABCD2评分和HVS阳性结合评分法比单一评分方法更优。
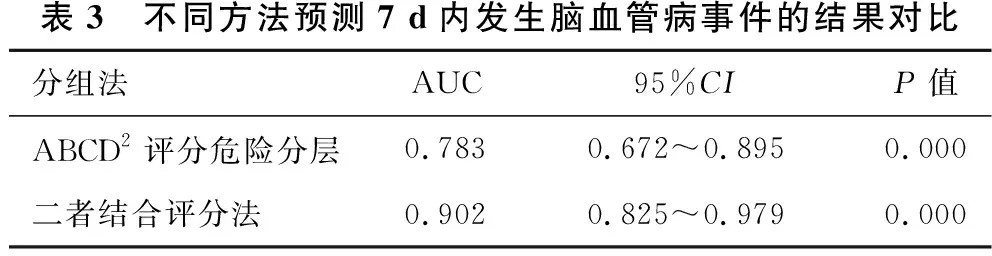
表3 不同方法预测7 d内发生脑血管病事件的结果对比分组法AUC95%CIP值ABCD2评分危险分层0.7830.672~0.8950.000二者结合评分法0.9020.825~0.9790.000
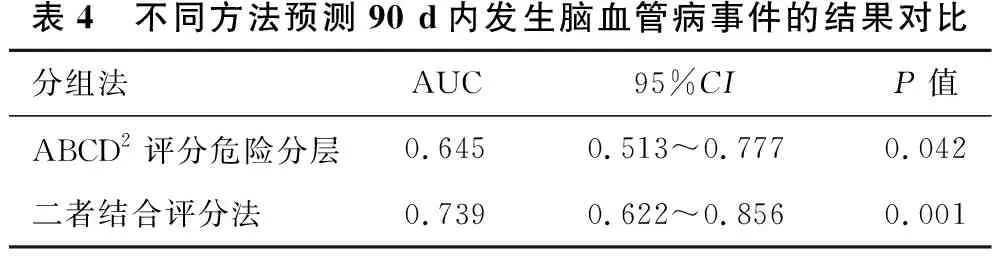
表4 不同方法预测90 d内发生脑血管病事件的结果对比分组法AUC95%CIP值ABCD2评分危险分层0.6450.513~0.7770.042二者结合评分法0.7390.622~0.8560.001
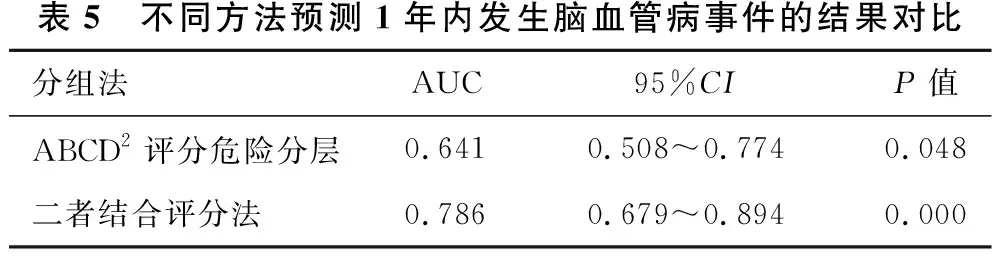
表5 不同方法预测1年内发生脑血管病事件的结果对比分组法AUC95%CIP值ABCD2评分危险分层0.6410.508~0.7740.048二者结合评分法0.7860.679~0.8940.000
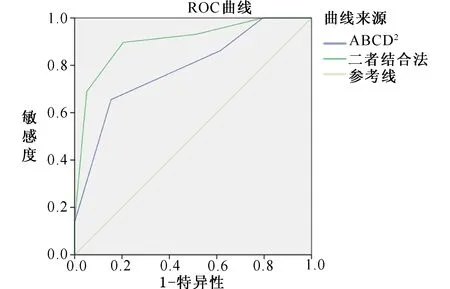
图1 两种不同方法预测7 d内发生脑血管病事件的ROC 曲线图
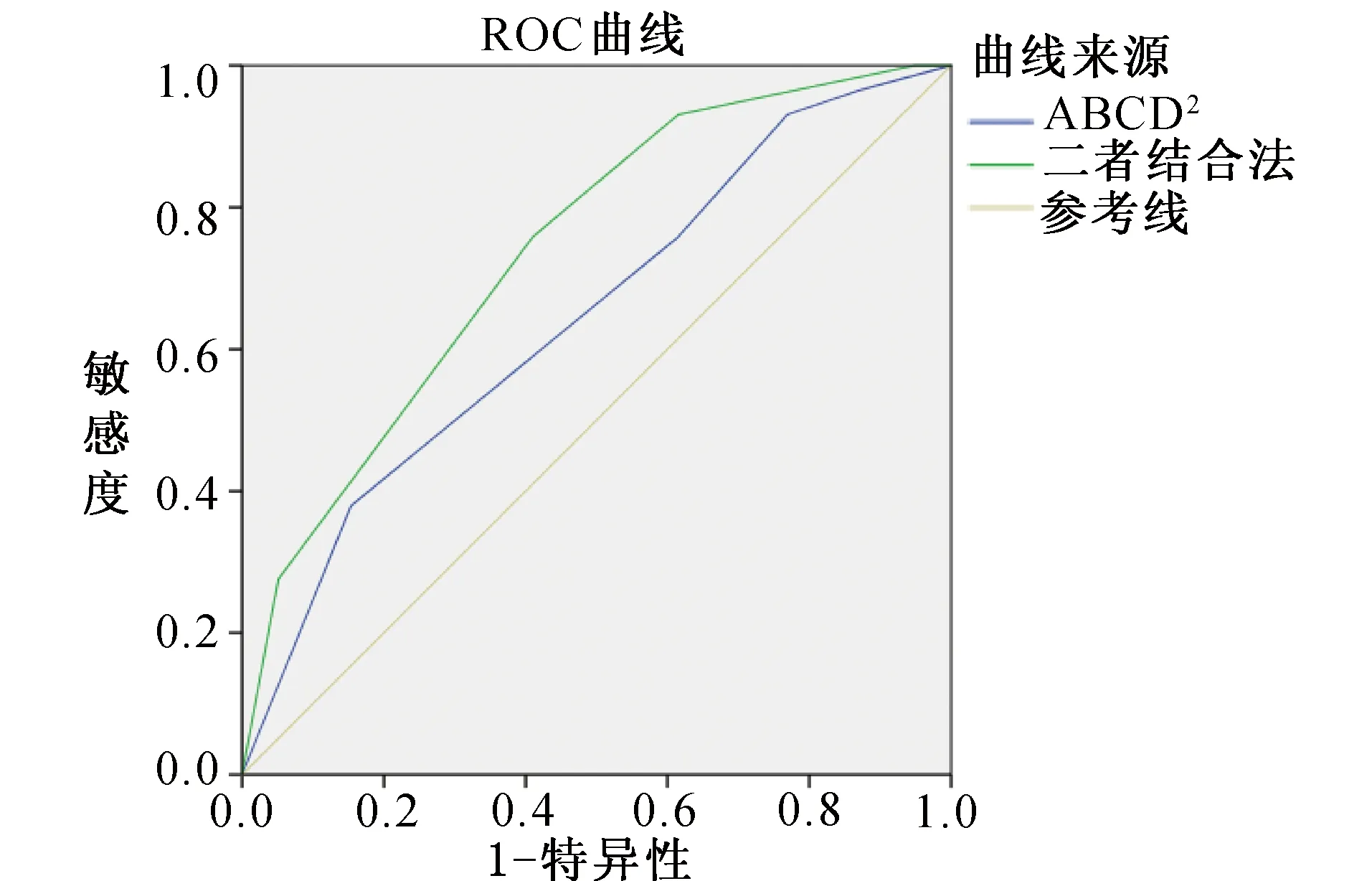
图2 两种不同方法预测90 d内发生脑血管病事件的ROC 曲线图
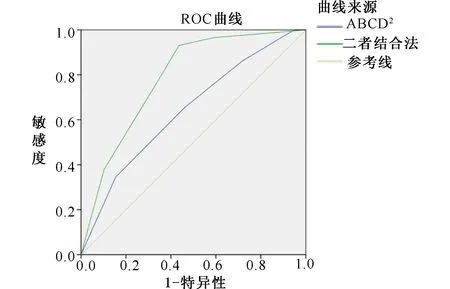
图3 两种不同方法预测1年内发生脑血管病事件的ROC 曲线图
3 讨 论
1999年Cosnard等[1]首次报道了存在于MRI Flair上,在病灶周围蛛网膜下腔的点状或条状高信号影,并命名为HVS。在本组TIA患者中,与HVS阴性组相比,HVS阳性组高血压史、糖化血红蛋白水平、低密度脂蛋白水平、卒中家族史、既往卒中史显著升高,差异有统计学意义(P<0.05),提示多种危险因素与病因共同作用可能导致了HVS的发生。而这些高危因素也已经被既往研究[5-6]证实参与了TIA的发生发展,是预测TIA预后的独立危险因素。这表明HVS与TIA的发生发展可能存在共同的病理生理基础。HVS确切的发生机制目前尚无定论,可能与血流动力学障碍及软脑膜侧支循环内缓慢逆行的血流有关。有研究[7]探讨了颈动脉系统TIA患者出现Flair序列HVS的血流动力学因素,推测HVS可作为反映TIA患者脑组织灌注不足的一种重要且便捷的影像学表现。Kamran等[8]研究发现,HVS是大血管闭塞或狭窄、侧支循环不足所致血流缓慢和早期缺血的指标。黄显军等[9]研究发现,颅内大血管严重狭窄或闭塞后形成的颅内软脑膜侧支循环是缺血性卒中或TIA患者Flair序列HVS形成的主要病理生理学基础。国内外学者对TIA患者中出现HVS征象的临床意义进行了一些研究。比如Araki等[10]研究了TIA患者中HVS的发生及其意义,发现HVS组TIA最常见的病因是动脉粥样硬化,HVS的位置与临床特征符合率高达94%,HVS可客观反映急性TIA缺血的存在。虎玉龙等[11]认为TIA患者出现HVS应被视为一种“高危”信号,此征象预示患者责任血管严重狭窄且合并易损斑块几率较大。综上,对存在危险因素特别是多种危险因素共存的TIA患者易出现HVS征象,意味着这些患者更可能存在脑血流灌注不足、出现责任血管狭窄及易损斑块等情况,因此对此类患者需要更及时、更积极的干预策略来改善TIA患者的预后,也提示应对HVS这一影像学征象是否能预测TIA预后进行探索。
TIA后复发脑卒中的风险远远高于急性脑梗死。有研究发现TIA患者7 d内发生卒中的风险为4%~10%,90 d出现卒中的风险则高达10%~20%,而急性卒中90 d内卒中复发的风险仅为2%~7%;如何提高对TIA患者再发脑血管病风险的预测至关重要,目前国内外应用最为广泛的评分系统是ABCD2评分分层[12]。在本研究中,预测脑血管病发生风险时,ABCD2评分分组的7 d内、90 d内、1年内的AUC值分别为0.783、0.645、0.641,表明在短期(7 d)内ABCD2的预测价值最高,但在中长期中的预测价值有下降趋势,这一结果证实了ABCD2评分危险分层对短期卒中风险预测的价值,对于中长期预测则提出了更进一步的要求。Amarenco等[13]随访了1 679例TIA患者,发现ABCD2评分≥4分的患者90 d卒中发生率为3.4%(24/701),而评分<4分且无急诊标准的患者90 d卒中发生率为3.9%(7/180),二者差异无统计学意义。这可能与ABCD2量表自身的缺陷有关,因为ABCD2评分系统是以“病史+临床表现”为基础的,未对病因方面进行评估。Amarenco等[14]对1 176例TIA患者采用ABCD2评分量表进行危险分层发现,在697例ABCD2评分<4分的患者中,有20%的患者需要立即考虑急诊治疗(比如,症状性颈内动脉狭窄≥50%的患者占9.1%,症状性颅内狭窄占5.0%,心房颤动占5.9%,其他主要心源性栓塞占2.1%)。ABCD2评分系统对短期发生脑血管病事件的预测价值已经得到肯定,对于中长期的风险预测则应更注重与血管因素和影像学的结合。ABCD2评分系统未结合影像学结果,患者若已存在脑动脉狭窄,单独使用ABCD2评分预测TIA后脑梗死的发生风险,则其准确性可能会降低。因此,ABCD2评分结合影像学检查将会进一步提高其预测价值[15-16]。随着神经影像特别是MRI技术的发展,越来越多的国内外研究着力于探讨ABCD2评分与影像学表现相结合的评价体系对于预测TIA预后的价值。如陈娟等[17]对92例TIA患者7 d内发生脑梗死的随访研究发现,MSCTA联合ABCD2评分对TIA患者早期进展为脑梗死具有较高的预测价值。一项对150例TIA患者进行的队列研究[18]显示,将DWI阳性和TIA病因纳入ABCD2评分可以提高TIA后6个月内预测卒中和死亡的能力。在本研究中,与HVS阴性组相比,HVS阳性组ABCD2评分显著升高, ABCD2分层为中高危者比例更高,差异有统计学意义(P<0.05),这一发现也提示HVS阳性组危险因素更多,合并症状更多,发作持续时间更长,HVS对TIA患者预后的预测具有一定的价值。
在本研究中,ROC曲线分析显示,与ABCD2评分分组相比,HVS征象与ABCD2评分结合在不同时期的预测价值均更优。HVS与经典的ABCD2评分相结合,优化了对TIA患者预后的预测能力,在不同时期的随访研究表明了这一结合方法评估的准确性。HVS不仅可评估颅内血管狭窄情况,还可反映局部侧支循环开放,其灵敏度及特异度均较高,有效性及可重复性较好[19-20]。根据TIA的新定义[3],本研究排除了DWI阳性表现的患者;而其他神经影像如CTA、DSA等手段不能与常规MRI一起完成,且对碘过敏或合并严重肝、肾、心脏等脏器功能损害的患者不能适用,DSA有创性及高费用使其具有局限性。Flair序列下HVS作为一种经济、方便的颅内软脑膜侧支循环及血管狭窄相关的影像学标志具有其独特优势,安全性好,可有效节约时间及经济成本。目前针对TIA患者预测不同时期的脑血管病发生的纵向研究较少,TIA患者的“ABCD2评分+影像”预测模式也较少涉及对HVS的研究,因此本研究具有一定的创新性。
本研究虽为单中心研究,且病例数有限,但仍存在一定的临床意义。Flair序列HVS这一影像学标志与TIA患者临床危险因素及病情发生发展紧密关联,其可能代表了颅内软脑膜侧支循环及血管狭窄情况,临床医师需对其有进一步的认识。本研究将HVS与ABCD2评分相结合的评价分层,可提高对TIA患者的预后预测,对存在HVS征象的患者,其可能合并多种危险因素,临床医师应采取更为及时积极的干预措施,从而更好的改善这类患者的预后。下一步我们仍需在严格纳入基线资料一致的基础上,进一步纳入更多的病例,在完善MRA、DSA等基础上,对HVS与血管狭窄的内在联系进行进一步的探讨,以期降低TIA患者的脑血管病再发风险。

