PD-1/PD-L1抑制剂在EGFR-TKIs治疗失败的非小细胞肺癌中的研究进展
周玉玲,张永昌,廖德华,杨农*(. 南华大学,湖南 衡阳 400;. 湖南省肿瘤医院肺胃肠内科,长沙4003;3. 湖南省肿瘤医院药学部,长沙 4003)
驱动基因突变指的是体细胞失去了原有的基因排布造成了致癌基因信号通路的活跃,使体细胞改变了原有的细胞特点从而无规则无程序的增殖。对于携带驱动基因突变的肿瘤来说,一般认为肿瘤的发生绝大部分甚至完全是由驱动基因导致的[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)作为世界上死亡率最高的恶性肿瘤[2],驱动基因突变占据总人群的69%[3],其中又以表皮生长因子(epidermal growth factor receptor,EGFR)最为常见(见图1)。对于EGFR突变阳性的NSCLC患者,EGFR酪氨酸激酶抑制剂(EGFR tyrosine kinase inhibitor,EGFR-TKIs)是一线治疗药物,但是最终仍然会发展成耐药[5-7]。
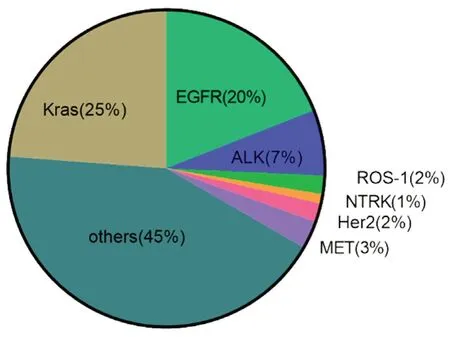
图1 NSCLC中各类驱动基因所占比例Fig 1 Frequency of mutation in driver oncogenes in NSCLC
程序性细胞死亡蛋白-1(programmed death-1,PD-1)及其配体(programmed death-ligand 1,PDL1)抑制剂是通过阻断免疫抑制信号通路,激活免疫系统达到杀伤肿瘤的作用,目前多个PD-1/PD-L1抑制剂如帕博利珠单抗(Pembrozulimab)、特瑞普利单抗、阿替丽珠单抗(Atezolizumab)等都已经相继纳入到NSCLC的治疗指南中[8-10]。鉴于驱动基因阴性肺癌患者能从PD-1/PD-L1抑制剂中获得明显的预后改善,并且PD-1/PD-L1抑制剂与TKIs发挥抗肿瘤效应作用机制的不同,因此对于驱动基因EGFR阳性且TKIs治疗失败的患者来说,PD-1/PD-L1抑制剂能否为其带来获益值得探讨。本文从这方面予以综述,并展望未来的治疗方向。
1 EGFR
EGFR属于酪氨酸激酶受体家族,其中该家族也包括人表皮生长因子受体 2 (human epidermal growth factor receptor 2,HER2)、HER3及HER4。在肺癌中,EGFR是主要的驱动突变基因,约占据全球患者人数的20%,其中在亚洲人中可高达40%[4,11]。EGFR突变主要集中在19号外显子的缺失及21号外显子L858R氨基酸分子的替换,EGFR突变的NSCLC患者会使MAPK/ERK、PI3K-AKT-mTOR等下游通路持续激活,从而导致细胞无限增殖,促进肿瘤的发生发展。EGFR-TKIs则是通过与ATP竞争性结合EGFR胞内激酶位点,阻断下游通路的激活,达到抑制肿瘤的增殖的作用[12-13]。与化疗相比,EGFR-TKIs治疗能使EGFR阳性患者的总体生存率(objective response rate,ORR)达70%、无进展生存时间(progressionfree survival,PFS)延长至18.6个月[14-16]。但是患者最终会对EGFR-TKIs发生耐药,目前对于耐药患者的后线治疗模式常选用以铂类为基础的化疗方案,其ORR在30%左右,中位无进展生存时间(median progressive free survival,mPFS)在5~6个月[17-18]。
2 PD-1/PD-L1抑制剂
PD-1/PD-L1是一对抑制性协同刺激分子。PD-1主要表达在活化的CD4+T细胞、CD8+T细胞、自然杀伤细胞、T细胞、B细胞和单核细胞中,是免疫细胞的负性免疫检查点,能够抑制细胞的程序性死亡;PD-L1在普通体细胞中通常低表达或者不表达,但是在恶性肿瘤,如在NSCLC中会呈现高表达状态,当肿瘤细胞的PD-L1与免疫细胞膜表面的PD-1结合时就会发生负性免疫应答造成肿瘤细胞的逃逸,促进肿瘤的发生、发展及转移。PD-1/PD-L1抑制剂是通过阻断PD-1/PD-L1通路的结合,解除免疫细胞的负性调控,阻止免疫逃逸达到杀死肿瘤细胞的作 用[19]。在KEYNOTE010[20]、CheckMate057[21]及OAK[22]研究中,对于多线耐药的NSCLC患者,PD-1/PD-L1抑制剂与多西他赛相比能延长患者的中位总体生存期(median overall survival,mOS)至12.2~13.8个月,其中当对肿瘤组织中的PD-L1进行分层分析时,发现PD-1/PD-L1抑制剂对PD-L1阳性的患者疗效更好。并且PD-1/PD-L1抑制剂也被纳入NSCLC的NCCN指南的一类推荐[10,23-25]。
3 PD-1/PD-L1抑制剂在EGFR-TKIs治疗失败患者中的疗效
EGFR-TKIs耐药机制多种多样,其中常见的有继发T790M突变,旁路激活和小细胞的转化等。近期,Peng等[26]研究指出对EGFR-TKIs耐药的肺癌细胞系往往会高表达PD-L1。此外,在临床回顾性分析中发现,PD-L1高表达的EGFR突变阳性的肺癌患者使用EGFR-TKIs治疗时,其mPFS明显短于PD-L1低表达的患者[27-28]。因此,基于PD-1/PD-L1抑制剂对于PD-L1高表达的NSCLC具有很好的疗效,同时EGFR-TKIs治疗失败的极大部分患者可能会存在PD-L1高表达,故而PD-1/PD-L1抑制剂治疗EGFR-TKIs耐药的肺癌患者可能是一种潜在的治疗模式。
3.1 PD-1/PD-L1抑制剂联合EGFR-TKIs
CAURAL研究把29名EGFR-TKIs失败的T790M阳性的NSCLC患者1∶1随机分配到奥希替尼联合度伐利尤单抗(durvalumab)治疗与奥希替尼单药治疗组,最终联合治疗组vs单药治疗组的ORR为64.00%vs80.00%,mPFS为还未达到(not achieved,NA)vs19.3个月,但该研究由于G3级以上的间质性肺炎不良反应持续发生而提前终止[29]。CheckMate021研究公布了纳武利尤单抗(Nivolumab)联合厄洛替尼治疗EGFR突变晚期非鳞NSCLC 患者的数据,该研究共纳入21名厄洛替尼耐药患者,给予厄洛替尼联合Nivolumab进行再次挑战,最终21名厄洛替尼耐药的患者ORR为15.00%,mPFS为5.1个月,5(24%)名患者出现G3级不良反应事件[30](见表1)。吉非替尼联合PD-1/PD-L1抑制剂也开展了多项临床研究,但是相关临床试验都由于安全性差而提前终止[31-32]。从目前的临床研究来看,吉非替尼及奥希替尼联合PD-1/PD-L1抑制剂由于毒性大导致临床试验的提前终止,因此即使患者能从中获益但仍然不倾向于作为联合方案;厄洛替尼联合PD-1/PD-L1抑制剂仍然会对厄洛替尼耐药的15%的人群带来生存获益并且未出现因不良反应事件而终止试验的情况。因此,对于EGFR-TKIs治疗失败的患者可以考虑厄洛替尼联合PD-1/PD-L1抑制剂,但是由于目前临床试验较少且多为Ⅰ期,因此有关厄洛替尼联合PD-1/PD-L1抑制剂的安全性及疗效需要进一步的研究。
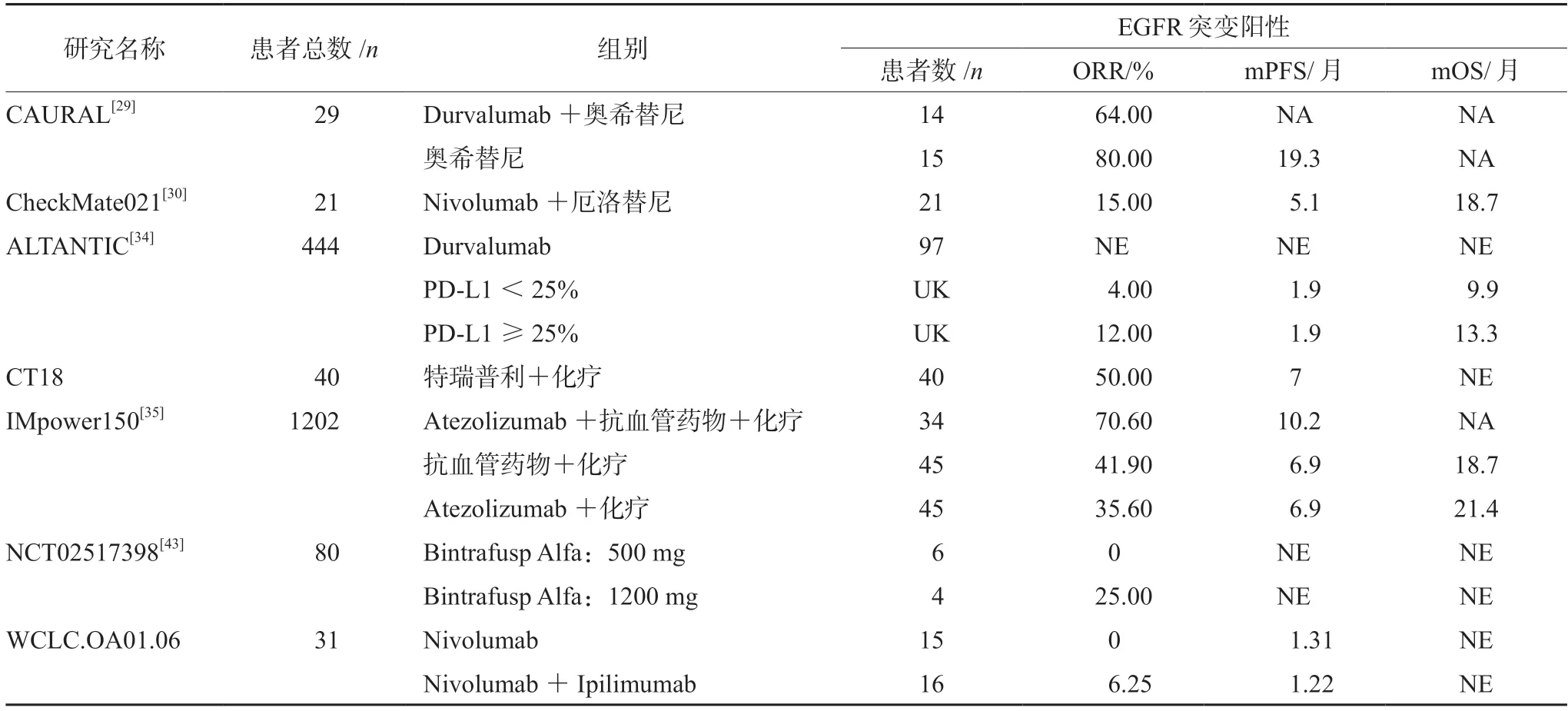
表1 免疫检查点抑制剂在EGFR-TKIs治疗失败患者中疗效比较Tab 1 Efficacy of immune checkpoint inhibitors after EGFR-TKIs failure in patients with EGFR-mutant NSCLC
3.2 PD-1/PD-L1单药、联合化疗或者抗血管药物
在KEYNOTE010、CheckMate057,OAK及IMpower130临床试验中,对EGFR-TKIs治疗失败的EGFR突变阳性的患者进行亚组分析时发现:该亚组患者无论是在Pembrozulimab、Nivolumab、Atezolizumab单药还是Atezolizumab联合化疗治疗方案中均不会有生存获益[20-22,33]。目前一些其他的临床研究显示,PD-1/PD-L1抑制剂能对EGFR-TKIs耐药的EGFR突变阳性的患者发挥抗肿瘤效应。
ATLANTIC[34]是一项单臂Ⅱ期临床研究,分析了在有无EGFR/ALK驱动基因的晚期NSCLC中,Durvalumab作为后线方案的治疗疗效。该研究共纳入444名2线或多线治疗失败的患者并将他们分成A、B、C 3组,其中A及B组又分成两个亚组,A组为111名EGFR+/ALK+的患者,按照肿瘤细胞中PD-L1的表达(<25%,≥25%)分成两个亚组;B组为265名EGFR-/ALK-的患者,同样以25%为界分成亚组;C组为68名EGFR-/ALK-且PD-L1≥90%患者。当PD-L1≥25%,AvsBvsC的ORR分 别 为12.2%vs16.4%vs30.9%,mPFS分别为1.9个月vs3.3个月vs2.4个月,mOS分别为13.3个月vs10.9个月vs13.2个月;当PD-L1<25%时,AvsB的ORR为4%vs8%,mPFS均为1.9个月,mOS分别为9.9个月vs9.3个月;G3~G4级以上不良反应发生率分别为5%、8%及18%。从ATLANTIC研究发现,当PD-L1≥25%时,PD-L1抑 制 剂Durvalumab能在EGFR-TKIs治疗失败的患者中改善预后,并与Durvalumab在驱动基因阴性患者中预后改善相当。因此尽管该临床试验受限于小样本人口,但是为EGFR-TKIs治疗失败的EGFR突变阳性患者提供了一个可能治疗方向:PD-L1≥25%时,Durvalumab可以考虑作为后续的治疗选择。
美国临床肿瘤学会(ASCO)展示了CT18研究的结果,CT18研究是特瑞普利单抗联合化疗用于EGFR-TKI治疗失败的EGFR突变阳性T790M阴性晚期NSCLC患者Ⅱ期研究。该研究对40名入组患者给予特瑞普利单抗联合培美曲塞和卡铂,最终ORR为50.0%(95%CI:33.8%~66.2%),DCR为87.5%(95%CI:73.2%~95.8%),mPFS为7.0个月(95%CI:4.8~0.3个月),其中G3~G4级不良事件的发生率为7.5%,未出现任何G5级不良事件。对PD-L1进行分层分析发现:PD-L1≥1%相对PD-L1<1%的患者预后更好(mPFS:8.3个月vs5.7个月);同样该研究也受限于小样本,但提示对于PD-L1≥1%的EGFR-TKIs治疗失败患者,特瑞普利单抗联合化疗可能是一个安全可行的后线治疗方案。
IMpower150[35]是一项PD-1/PD-L1抑制剂与化疗和VEGF-TKIs联合的开放标签的Ⅲ期、多中心随机对照试验,入组患者是多线耐药的晚期非鳞NSCLC,随机分配至A组(Atezolizumab联合贝伐珠单抗和化疗)、B组(贝伐珠单抗联合化疗)及C组(Atezolizumab联合化疗)3组。在对124名EGFR突变患者进行亚组分析时,A组的ORR和mPFS分别为70.6%(95%CI:52.2~84.9)、10.2个月(95%CI:7.9~15.2),mOS未评估;B组ORR和mPFS分别为41.9%(95%CI:27.0~57.9)、6.9个月(95%CI:5.7~8.5),mOS是18.7个月;C组的ORR和mPFS分别为35.6%(95%CI:21.9~51.2)、6.9个月(95%CI:5.7~8.2),mOS是21.4个月;AvsB组mPFS及mOS的风险比分别为0.41(0.23~0.75)及0.31(0.11~0.83)。3个方案的EGFR亚组患者发生了G3~G4级不良反应,其中贝伐珠单抗联合化疗组的患者出现了1例G5级不良反应事件,其余两组未出现G5级的不良反应事件。该研究与以往的ATLANTIC及CT18研究不同的是,PD-L1的表达并不会影响PD-1/PD-L1抑制剂联合化疗和VEGF-TKIs的治疗疗效。这可能是与加入的抗血管生成药物贝伐珠单抗相关,血管内皮生长因子(vascular endothelial growth factor,VEGF)能抑制造血干细胞向树突细胞的分化、抑制T细胞向肿瘤的浸润以及通过Fas配体介导T细胞的凋亡,因而抗血管生成药物能促进树突细胞的成熟以及增加T细胞对肿瘤的浸润,改变肿瘤的免疫微环境[36-39]。EGFRTKIs耐药的患者肿瘤免疫微环境会发生改变[40]。因此,抗血管生成药物可能通过改变EGFR-TKIs耐药患者的肿瘤免疫微环境增加T淋巴细胞浸润,使PD-1/PD-L1抑制剂发挥效应,并且其抗肿瘤效应不受患者PD-L1表达的限制。IMpower150提示,在 EGFR-TKI治疗失败的NSCLC患者中,Atezolizumab联合化疗和抗血管生成药物抗肿瘤效应不会受到PD-L1表达的影响,这种联合模式是未来PD-L1低表达或者不表达的EGFR-TKIs治疗失败的EGFR突变阳性肺癌患者潜在的后线治疗选择,但是临床医师尤其需要注意到其高达60%的不良事件发生率。
3.3 双免疫靶点治疗
免疫治疗不仅包括了PD-1/PD-L1抑制剂,也包括针对其他免疫检查点如TGF-β及CTLA-4抑制剂等,但是其他免疫检查点抑制剂单药治疗 并不会发挥很好的疗效,因而多与PD-1/PD-L1抑制剂进行联合或者设计成特异性双靶点药物[41-42]。NCT02517398研究了TGF-β和PD-L1双特异性靶点抑制剂Bintrafusp Alfa在NSCLC中疗效和安全性的Ⅰ期研究,该研究入组了80例疾病进展的NSCLC患者,并按照1∶1分成500 mg及1200 mg两组,最后500 mgvs1200 mg的总体患者ORR、mPFS及mOS分别为17.5%vs25%,1.4个月vs4.0个月,13.6个月vs17.1个月。在10例EGFR突变阳性的患者中,有6例EGFR突变阳性的患者分到500 mg组,4例患者分至1200 mg组进行,有1名在1200 mg组的患者获得临床疗效,ORR为25%[43]。WCLC报道了一项31例一线EGFR TKI标准治疗失败的晚期EGFR突变NSCLC患者中Nivolumab与Nivolumab联合CTLA-4抑制剂伊匹单抗(Ipilimumab)(允许交叉)的Ⅱ期临床研究,其中NivolumabvsNivolumab联合Ipilimumab的ORR为0vs6.25%,mPFS为1.31个月vs1.22个月,两组中未有任何患者发生G3级及以上的不良反应,该研究也由于方案无效而提前终止。双免疫靶点治疗方案在驱动基因阴性的患者展示了可观的疗效并且相对单个PD-1/PD-L1抑制剂其疗效会更好[44-45],但是在EGFR-TKIs治疗失败的EGFR突变阳性的患者中并没有展示生存获益,这可能与入组患者数量以及EGFR-TKIs治疗后肿瘤免疫微环境的改变相关,因此双免疫治疗联合抗血管药物可能是未来的研究方向。
4 总结与展望
EGFR-TKIs联合PD-1/PD-L1抑制剂尽管在EGFR-TKIs治疗失败的部分患者中展示出一定的疗效,但是因其安全性差导致临床试验提前终止的事件也不容忽视,从患者安全及获益角度出发,不优先考虑这种联合模式;如果要选择这种联合模式时,临床医师必须要慎重考虑EGFR-TKIs与PD-1/PD-L1抑制剂药物搭配。在单个PD-1/PD-L1抑制剂或者联合化疗的研究结果中,大部分治疗方案的疗效与患者的PD-L1的表达密切相关:对于PD-L1高表达的患者,Durvalumab、特瑞普利单抗联合化疗还是Atezolizumab联合化疗和VEGF-TKIs是潜在的方案;对于PD-L1低表达或者不表达的患者,Atezolizumab联合VEGF-TKIs应该考虑成为一个捆绑联合治疗选择,但是临床医师在选择Atezolizumab捆绑联合抗血管药物时,需要密切关注患者的不良反应,尽早对患者进行干预处理。在双免疫靶点治疗模式中,暂时未见到可观的疗效,可能与患者例数过少相关,此外EGFRTKIs治疗失败的患者单独使用双免疫靶点可能不会发挥很好的疗效,联合抗血管生成药物是未来需要考虑的联合治疗方案。总之,尽管在有些临床试验中,PD-1/PD-L1抑制剂相对后线选用化疗并未增加EGFR-TKIs治疗失败的患者生存获益,但是在有些临床试验中,PD-1/PD-L1抑制剂在该类患者中仍然获得了不错的结果,造成这种差异的原因可能与选取的PD-/PD-L1抑制剂及联合治疗方案不同相关,挑选合适的抑制剂及联合方案是未来需要解决的问题。PD-1/PD-L1抑制剂仍然是EGFR-TKIs耐药患者后线方案的潜在选择,值得进一步的研究与探索,同时免疫治疗联合抗血管药物治疗方案可能是可行的联合治疗模式。

