新疆鼠李果实提取物对高脂血症大鼠调脂及抗氧化作用的研究
叶静,陆春晖,沈静*,张露(. 新疆医科大学第五附属医院,乌鲁木齐 8300;. 新疆医科大学药学院,乌鲁木齐 8300)
由于脂肪代谢或运转异常使血浆中一种或几种脂质高于正常称为高脂血症(hyperlipidemia,HLP)[1],高脂血症是动脉粥样硬化等心血管疾病及脂肪肝病的主要发病原因[2-3]。新疆地区哈萨克常用药新疆鼠李果实,民间常将其用于高脂血症的治疗中。新疆鼠李果实系鼠李科(Rhamnaceae)鼠李属(Rhamnus)植物新疆鼠李果实(Rhamnus songoricaG.)产自中国新疆西部伊宁、新源、巩留、特克斯、尼勒克、玛纳斯等地区,在中亚地区也有分布,为当地较为普遍的灌丛植物。新疆鼠李果实在新疆地区种质资源非常丰富,在哈萨克医学中是具有一定药用历史的常用民间药材,具有助消化、调节脂质代谢等功效。迄今对新疆鼠李果实化学成分与作用于高脂血症药理作用的相关研究均罕见报道,国外也仅限于生物及生态学等方面。基于民间应用基础及前期相关药材研究,新疆伊犁哈萨克自治州中医院将其应用于临床治疗中,高脂血症患者给予新疆鼠李果实后,血脂均得到改善。
本文选用体外抗氧化活性较强的新疆鼠李果实,通过建立大鼠高脂血症模型,初步探讨新疆鼠李果实提取物(RSFE)调脂作用及其体内抗氧化作用,为后续新疆鼠李果实对高脂血症作用机制研究奠定基础。
1 材料
1.1 试药
新疆鼠李果实于2017年8月采自新疆伊犁州伊宁县山区,经新疆医科大学药学院天然药物分析教研室认定。脂必妥片(成分:红曲,规格:0.35 g/片,成都地奥九泓制药厂,批号:Z20178011)。
胆固醇(Klontech公司,批号:C27H460),猪胆盐(上海兰基科技发展有限公司,批号:160318),丙硫氧嘧啶片(德国Lomapham Rudolf Lohmann GmbH KG公司,批号:004000),蛋黄粉(安徽毫州蛋业有限公司,批号:20160120),香油(新疆泰星实业投资有限公司,批号:20160203),白糖、猪油(市售),总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)测试盒(Biosino生物科技有限公司),谷丙转氨酶(ALT)、谷草转氨酶(AST)、丙二醛(MDA)及一氧化氮(NO)、总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-PX)、肝脂酶(HL)、脂蛋白脂肪酶(LPL)及总脂酶(LA)测试盒及蛋白定量测试盒(南京建成生物工程研究所)。
1.2 实验动物
SPF级健康成年昆明种小鼠40只,雌雄各半,体质量18~22 g;SPF级健康成年雄性SD大鼠90只,体质量(200±20)g [新疆医科大学医学实验动物中心,实验动物许可SYXK(新)2016-0001]。
高脂饲料含10%猪油、2%胆固醇、7%白糖、1%猪胆盐、0.3%丙硫氧嘧啶、8%蛋黄粉、0.5%香油、71.2%基础饲料,其中猪油为市售猪油加热,滤过,去渣而成,饲料的混匀压制由新疆医科大学医学实验动物中心代为加工。
1.3 仪器
真空泵(郑州长城科菲工贸有限公司),电子称(成都普锐斯电子有限公司),冰箱(博世西门子家电集团),冷冻离心机(长沙湘仪离心机仪器有限公司),高速离心机(上海安亭科学仪器厂),海尔-80℃冰箱(海尔医疗实验室用品有限公司),匀浆机(金坛医疗器械厂),涡旋器(上海第一医学院仪器厂),UV-1800型紫外分光光度计(日本岛津公司),卓越310型全自动生化分析仪(武汉精诚伟业医疗设备有限公司),石蜡切片机(德国SLEE公司),倒置光学显微镜(日本Olympus公司)。
2 方法
2.1 新疆鼠李果实提取物的制备
取新疆鼠李新鲜果实于通风干燥条件下阴干、粉碎,共得药材细粉1530 g,按料液比1∶10加70%乙醇加热回流分批次提取3次,每次1 h,过滤、浓缩、冷冻干燥后得干粉共计120.87 g,计算平均出膏率约为7.9%。
2.2 RSFE急性毒性的测定
最大耐受量实验:小鼠20只,以4.5 g·kg-1剂量一次灌胃给药后,观察7 d。期间未发现小鼠异常或死亡现象,平均每只增加2.5 g,为正常增长,故得出最大耐受量>4.5 g·kg-1。
2.3 大鼠高脂血症模型的建立
SD雄性大鼠常规适应性喂养1周后进行实验,禁食12 h后,眼眶静脉丛采血,测定TC、TG等血脂指标,根据血脂水平及体质量,使用完全随机分组法将大鼠分为正常对照组(15只)和高脂血症模型组(75只)。正常对照组给予基础饲料喂养,高脂血症模型组给予高脂饲料喂养。高脂血症模型造模成功后,随机分为5组,即模型组、阳性对照组、RSFE低剂量组、RSFE中剂量组、RSFE高剂量组。
第10周高脂饲料喂养结束后,每组大鼠眼眶取血测定血清TC、TG、LDL-C及HDL-C水平,再每组随机取2只大鼠处死,取肝脏进行肝组织病理学检查,血脂四项测定辅以肝组织病理学检查以判断高脂血症模型造模是否成功。
2.4 给药
正常对照组每日给予普通饲料喂养,模型组及各给药组每日给予高脂饲料喂养。正常对照组:给予生理盐水10 mL·kg-1灌胃,阳性对照组:给予脂必妥187.5 mg·kg-1灌胃,RSFE低、中、高剂量组分别给予RSFE 75、150、300 mg·kg-1灌胃。以上各组大鼠每日1次灌胃给药。灌胃4周后检测各组大鼠血清中TC、TG、LDL-C及HDL-C水平。
2.5 大鼠血清生化指标的测定
分离大鼠血清,采用对应试剂盒测定TC、TG、LDL-C、HDL-C、ALT、AST、NO、T-SOD、MDA。
2.6 大鼠肝脏组织指标的检测
等重量称取肝组织后,加9倍体积生理盐水进行匀浆,3000 r·min-1、4℃下离心15 min,得10%肝匀浆,取上清分装保存于-80℃冰箱。
2.7 肝脏组织和心肌组织病理学检查
开腹取肝脏组织、开胸取心脏组织,置于4%多聚甲醛溶液中进行固定,经石蜡包埋、切片(厚度为5 μm),行常规HE染色,于光学显微镜下观察大鼠肝脏组织和大鼠主动脉组织病理形态学变化。
2.8 统计学方法
运用统计学软件SPSS 17.0进行分析,实验数据以x±s表示,多组间均数比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
3 结果
3.1 大鼠高脂血症模型造模检测结果
3.1.1 血脂四项检测 结果表明,高脂饲料喂养10周后,高脂血症模型组大鼠血清TC、TG与LDL-C水平显著升高,HDL-C水平显著降低,与正常对照组比较差异有统计学意义(P<0.05),结果见表1。
表1 高脂饲料喂养10周大鼠血清TC、TG、LDL-C及HDL-C的分析(±s)Tab 1 TC,TG,LDL-C and HDL-C in the serum of rats after 10 weeks of high-fat diet (±s)

表1 高脂饲料喂养10周大鼠血清TC、TG、LDL-C及HDL-C的分析(±s)Tab 1 TC,TG,LDL-C and HDL-C in the serum of rats after 10 weeks of high-fat diet (±s)
注(Note):与正常对照组比较,*P<0.01(Compared with the normal control group,*P<0.01)。
组别 n TC/(mmol·L-1) TG/(mmol·L-1) LDL-C/(mmol·L-1) HDL-C/(mmol·L-1)正常对照组 15 1.79±0.14 0.59±0.06 0.47±0.21 1.40±0.09高脂血症模型组 75 5.10±0.16* 1.13±0.10* 4.19±0.23* 0.63±0.08*
3.1.2 肝脏组织病理检查结果 高脂饲料喂养10周后,正常对照组随机取2只大鼠处死,高脂血症模型组随机取20只大鼠处死,取肝脏进行病理学检查,检测结果显示高脂血症模型组90%(18/20)大鼠出现肝细胞变性,可见大小不等的脂肪滴空泡散在,肝细胞排列疏松,符合高脂血症性脂肪肝病理诊断标准(见图1)。血清生化及肝脏组织病理学检查结果表明,经过10周高脂饲料喂养成功建立大鼠高脂血症模型。
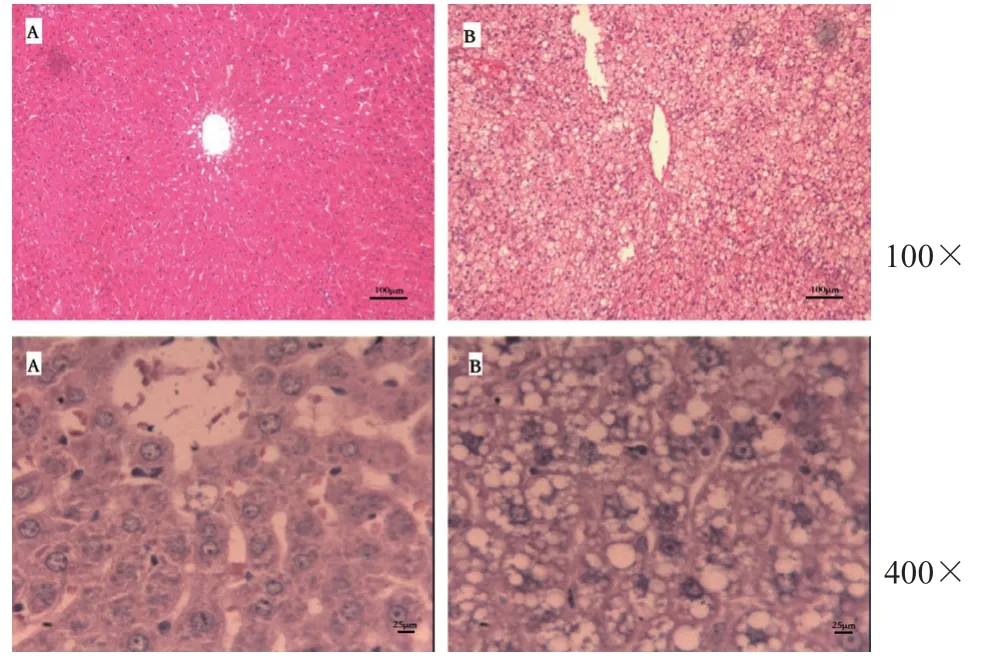
图1 正常对照组(A)及模型组(B)大鼠肝组织病理切片(HE)Fig 1 Pathological sections of the liver tissue in the normal control group (A)and the model group(B)(HE)
3.2 RSFE对高脂血症大鼠血清TC、TG、LDL-C及HDL-C水平的影响
结果表明,与正常对照组比较,模型组的TC、TG及LDL-C升高,HDL-C降低。给药4周后,各给药组TC、TG及LDL-C降低,HDL-C升高(P<0.01)(见表2)。
表2 新疆鼠李果实提取物对大鼠血清TC、TG、LDL-C及HDL-C水平的影响(±s,n=8)Tab 2 Effect of RSFE on the level of TC,TG,LDL-C and HDL-C in the serum of rats (±s,n=8)

表2 新疆鼠李果实提取物对大鼠血清TC、TG、LDL-C及HDL-C水平的影响(±s,n=8)Tab 2 Effect of RSFE on the level of TC,TG,LDL-C and HDL-C in the serum of rats (±s,n=8)
注(Note):与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,##P<0.01(Compared with the normal control group,*P<0.05,**P<0.01;compared with the model group,##P<0.01)。
组别 TC/(mmol·L-1) TG/(mmol·L-1) LDL-C/(mmol·L-1) HDL-C/(mmol·L-1)正常对照组 1.93±0.50 0.74±0.09 0.59±0.17 1.37±0.15模型组 8.73±0.56** 1.71±0.16** 5.32±0.84** 0.69±0.08**阳性对照组 2.36±0.39## 0.64±0.21## 0.71±0.14## 1.10±0.11**##RSFE低剂量组 3.28±0.66**## 1.47±0.16**## 2.38±0.18**## 0.74±0.05**RSFE中剂量组 2.53±0.28*## 1.04±0.11**## 2.15±0.22**## 0.82±0.11**RSFE高剂量组 2.13±0.37## 0.65±0.13## 1.59±0.18**## 1.05±0.18*##
3.3 RSFE对高脂血症大鼠血清抗氧化指标的影响
肝脏是脂质代谢的重要场所,血清中ALT与AST水平的升高可反映肝损伤程度。结果表明,高脂饲料喂养14周后,模型组的ALT、AST水平升高,各给药组的ALT、AST水平均下降(P<0.05,P<0.01)(见表3)。
表3 RSFE对大鼠血清ALT和AST水平的影响(±s,n=8)Tab 3 Effect of RSFE on the level of ALT and AST in the serum of rats (±s,n=8)

表3 RSFE对大鼠血清ALT和AST水平的影响(±s,n=8)Tab 3 Effect of RSFE on the level of ALT and AST in the serum of rats (±s,n=8)
注(Note):与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01(Compared with the normal control group,**P<0.01;compared with the model group,#P<0.05,##P<0.01)。
组别 ALT/(U·L-1) AST/(U·L-1)正常对照组 45.47±9.38 68.51±13.10模型组 140.25±10.81** 174.75±18.84**阳性对照组 64.40±17.05## 108.67±11.20##RSFE低剂量组 80.33±10.69## 140.67±9.29##RSFE中剂量组 77.00±17.29## 96.43±26.49##RSFE高剂量组 76.71±8.24## 87.25±14.39#
3.4 RSFE对高脂血症大鼠血清抗氧化指标的影响
模型组血清T-SOD、MDA、NO均有显著性变化,提示长期高脂饮食降低机体的抗氧化能力从而对机体造成氧化损伤。RSFE可提高大鼠血清T-SOD水平,降低血清MDA及NO含量,改善机体受自由基攻击程度(见表4)。
表4 RSFE对大鼠血清抗氧化指标的影响(±s,n=8)Tab 4 Effect of RSFE on the antioxidative index in the serum of rats (±s,n=8)
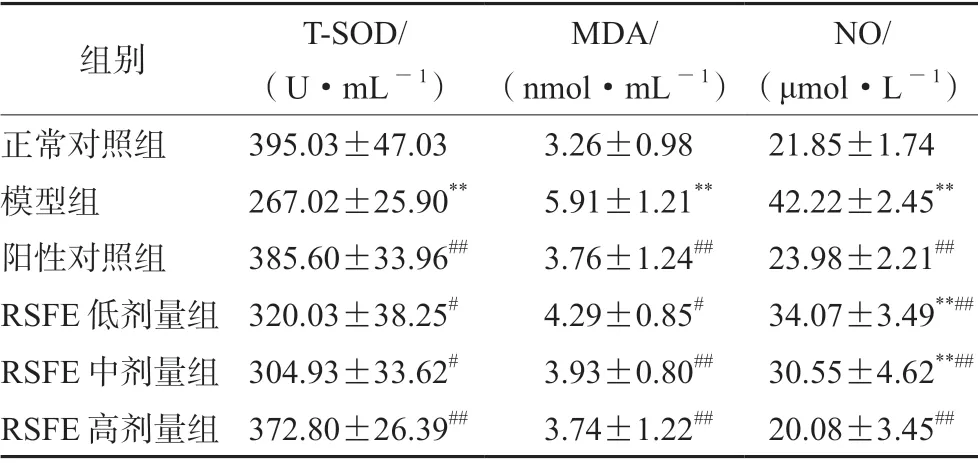
表4 RSFE对大鼠血清抗氧化指标的影响(±s,n=8)Tab 4 Effect of RSFE on the antioxidative index in the serum of rats (±s,n=8)
注(Note):与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01(Compared with the normal control group,**P<0.01;compared with the model group,#P<0.05,##P<0.01)。
NO/(μmol·L-1)正常对照组 395.03±47.03 3.26±0.98 21.85±1.74模型组 267.02±25.90** 5.91±1.21** 42.22±2.45**阳性对照组 385.60±33.96## 3.76±1.24## 23.98±2.21##RSFE低剂量组 320.03±38.25# 4.29±0.85# 34.07±3.49**##RSFE中剂量组 304.93±33.62# 3.93±0.80## 30.55±4.62**##RSFE高剂量组 372.80±26.39## 3.74±1.22## 20.08±3.45##组别 T-SOD/(U·mL-1)MDA/(nmol·mL-1)
3.5 RSFE对高脂血症大鼠肝组织抗氧化指标的影响
3.5.1 RSFE对高脂血症大鼠肝组织T-SOD和MDA的影响 结果与正常对照组比较,模型组肝组织T-SOD、MDA有显著性变化(P<0.01),长期高脂饮食可降低肝脏的抗氧化能力从而对肝脏造成氧化损伤。RSFE可提高大鼠肝组织T-SOD水平,降低肝组织MDA含量,改善机体受自由基攻击程度(P<0.01)(见表5)。
表5 RSFE对高脂血症大鼠肝组织各指标的影响(±s,n=8)Tab 5 Effect of RSFE on the index in the hepatic tissue of rats (±s,n=8)
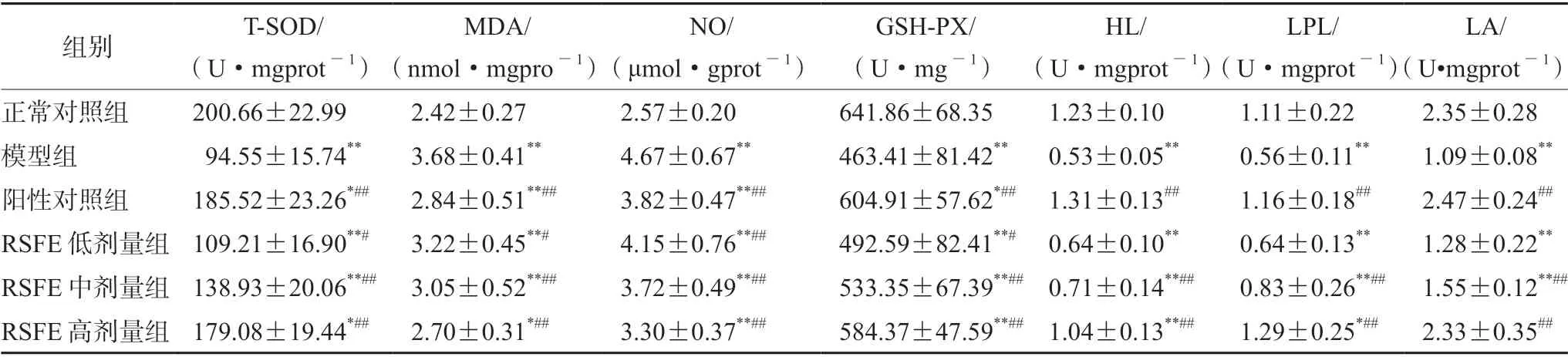
表5 RSFE对高脂血症大鼠肝组织各指标的影响(±s,n=8)Tab 5 Effect of RSFE on the index in the hepatic tissue of rats (±s,n=8)
注(Note):与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01(Compared with the normal control group,*P<0.05,**P<0.01;compared with the model group,#P<0.05,##P<0.01)。
LA/(U•mgprot-1)正常对照组 200.66±22.99 2.42±0.27 2.57±0.20 641.86±68.35 1.23±0.10 1.11±0.22 2.35±0.28模型组 94.55±15.74** 3.68±0.41** 4.67±0.67** 463.41±81.42** 0.53±0.05** 0.56±0.11** 1.09±0.08**阳性对照组 185.52±23.26*## 2.84±0.51**## 3.82±0.47**## 604.91±57.62*## 1.31±0.13## 1.16±0.18## 2.47±0.24##RSFE低剂量组 109.21±16.90**# 3.22±0.45**# 4.15±0.76**## 492.59±82.41**# 0.64±0.10** 0.64±0.13** 1.28±0.22**RSFE中剂量组 138.93±20.06**## 3.05±0.52**## 3.72±0.49**## 533.35±67.39**## 0.71±0.14**## 0.83±0.26**## 1.55±0.12**##RSFE高剂量组 179.08±19.44*## 2.70±0.31*## 3.30±0.37**## 584.37±47.59**## 1.04±0.13**## 1.29±0.25*## 2.33±0.35##组别 T-SOD/(U·mgprot-1)MDA/(nmol·mgpro-1)NO/(μmol·gprot-1)GSH-PX/(U·mg-1)HL/(U·mgprot-1)LPL/(U·mgprot-1)
3.5.2 新疆鼠李果实提取物对高脂血症大鼠肝组织NO和GSH-PX的影响 结果表明,模型组NO、GSH-PX均有显著升高,提示HLP发生过程中NO和GSH-PX含量升高,伴随着氧化应激反应的发生。给予RSFE灌胃4周后,可降低大鼠肝组织NO和GSH-PX水平,改善肝脏组织氧化应激反应状态(见表5)。
3.5.3 新疆鼠李果实提取物对高脂血症大鼠HL、LPL及LA的影响 结果表明,正常对照组,模型组HL、LPL、LA均显著下降比较(P<0.01)。提示长期进食高脂饲料使外源性脂质不能排出体外,降低肝脏调控HL和LPL等脂蛋白代谢酶生物活性的能力,引发体内脂质代谢紊乱。给予RSFE灌胃4周后,RSFE可能通过肝脏调节脂蛋白代谢酶的生物活性,升高大鼠肝组织中HL、LPL及LA的活性,减轻肝组织脂肪变性,达到调脂的目的(见表5)。
3.6 大鼠肝组织病理学检查结果
各组大鼠肝组织病理学检查结果如下:正常对照组大鼠肝组织无异常变化,肝细胞形态和排列正常且无脂肪变性,肝小叶结构清晰,肝细胞围绕小叶中央静脉呈放射状。模型组大鼠发生肝脂肪变性,病变程度主要是中重度脂肪变性,并且肝细胞排列疏松,体积变大变圆,胞浆内有大小、多少不等的脂滴,以致细胞核被挤压至一边。各给药组脂肪变性不同程度减轻。其中,阳性对照组与RSFE高剂量组脂变和空泡变数量明显减少,个别出现灶性坏死;RSFE低剂量组肝细胞脂变较明显,肝小叶中央区肝细胞有大小、多少不等的脂滴,病变以中央静脉向周围递减,部分肝细胞胞浆疏松化;RSFE中剂量组肝细胞存在脂变和空泡变,但数量较少,亦见部分肝细胞胞浆呈现疏松化(见图2)。参照高脂血症性脂肪肝的病理分级,RSFE给药组脂肪变性较模型组明显减轻,并接近于阳性对照组,表明新疆鼠李果实有减轻高脂血症所引起的肝细胞脂肪变性程度的作用。
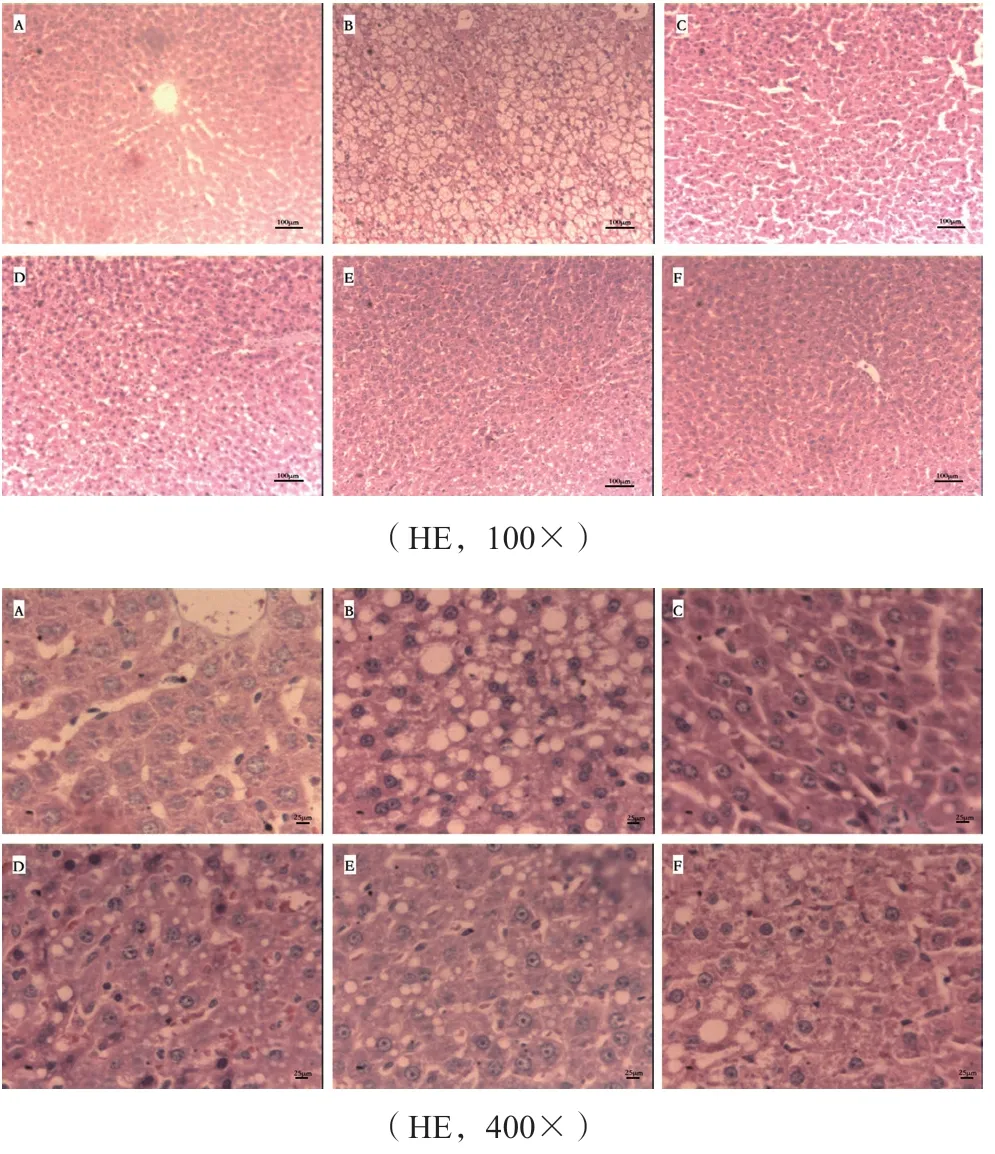
图2 大鼠肝组织病理切片Fig 2 Pathological sections of liver tissue
3.7 大鼠主动脉组织病理学检查结果
正常对照组大鼠主动脉组织无异常变化,内膜表面完整光滑无损伤,中膜平滑肌排列整齐、厚薄均匀,内皮细胞排列紧密无脱落。模型组大鼠主动脉组织脂质沉着,内膜灶性增厚,中膜平滑肌细胞排列紊乱,厚薄不均匀,与正常对照组相比,内膜、中膜厚度明显增大,内皮细胞排列紊乱。给药组大鼠主动脉组织脂质沉着现象较模型组有不同程度减轻。其中,阳性对照组及RSFE高剂量组脂质沉着明显减少,内膜表面较完整平滑且中膜平滑肌排列整齐且厚薄均匀;RSFE低剂量组脂质沉着较明显,中膜平滑肌细胞排列排列紊乱,厚薄不均匀,散见炎性细胞浸润;RSFE中剂量组脂质沉着有所减轻,内膜灶性增厚,中膜平滑肌基本排列整齐,部分平滑肌有细胞水肿的现象(见图3)。
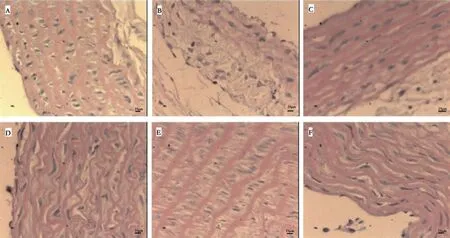
图3 大鼠主动脉组织病理切片(HE,400×)Fig 3 Pathological sections of aortic tissue(HE,400×)
4 讨论
体内氧化平衡与高血脂症之间的关系密切,高血脂促进动脉壁细胞中自由基的释放活性,活性氧成分或氧自由基又进而导致LDL的氧化。而脂质过氧化作用的增强,使T-SOD水平降低后生成大量脂质过氧化物,反映在MDA水平的增多上[4]。脂质过氧化物氧化LDL-C后使其黏附于血管上,经历吞噬、凋亡等过程后转化为脂肪,进一步加重高脂血症的发展[5-6]。因此,对抗脂质过氧化反应的发生,清除自由基是目前治疗高脂血症的关键。
在机体的各类氧化还原反应过程中所产生的O2-,而后产生脂质过氧化物及终极产物MDA,进而导致生物分子的结构或功能障碍,成为高脂血症的基础[7-9]。机体通过保护性酶系统-抗脂质过氧化酶终止自由基反应。T-SOD是一种有效的抗氧化剂,具有清除O2-与减少MDA生成的作用,从而阻断脂质过氧化物的生成,进而减轻其对机体的损伤。NO是由内皮细胞释放,具有舒张血管并逆转其脂质过氧化状态的作用[10-12]。而GSH-PX通过将胞浆、线粒体及脂类中的H2O2转化为H2O和O,从而阻断OH并且达到稳定细胞膜的作用[13],清除脂质过氧化物,从而治疗高脂血症[14]。而肝细胞的抗氧化作用是通过提高GSH-PX活性而发挥其保护与解毒等功能的[15-16]。
本文研究表明,高脂饮食诱导的高脂血症大鼠组的MDA水平显著升高,说明其脂质氧化水平升高、作用增强,这种升高的MDA能被不同浓度的RSFE处理后得到改善,并且RSFE能降低高脂血症大鼠TC、TG、LDL-C、ALT与AST水平,升高HDL-C、HL、LPL及LA水平,说明RSFE具有降低血脂的作用。其次,高脂血症能直接损伤动脉壁的抗氧化机能,使动脉壁内的T-SOD活性降低,导致其清除自由基的作用受到影响,加重所在区域的动脉血管的病理损伤和机能的异常。本文中不同浓度的RSFE处理高脂血症大鼠后,能不同程度地提升由高脂饮食诱导的大鼠血清与肝组织中的T-SOD的降低水平,并降低其NO、GSH-PX水平,也说明了RSFE具有增强抗氧化酶活性、清除氧自由基和其他活性氧成分的作用。

