苯甲酸利扎曲普坦口腔崩解片的制备及相关评价
孙钦勇,冯中,咸鑫,杜丽平,高帆俐,张朝,禹珊珊,张贵民(鲁南制药集团股份有限公司,国家手性制药工程技术研究中心,山东 临沂 273400)
苯甲酸利扎曲普坦对5-羟色胺受体1B(5-HT1B)和1D(5-HT1D)亚型具有高度的亲和力,可抑制三叉神经疼痛通路中神经肽的释放和传递,是第2代曲普坦类治疗偏头痛药物[1]。苯甲酸利扎曲普坦为白色至类白色结晶固体,水中易溶,苦味强烈,其口腔崩解片由Merck公司研制,1998年在荷兰上市,临床用于治疗急性偏头痛发作,具有起效快、疗效好、安全方便的优点。
口腔崩解片(orally disintegrating tablet,ODT)在口腔中能快速崩解,随吞咽动作进入消化道,对不能吞咽的昏迷患者、吞咽功能发育不全的儿童及吞咽功能减退的老人具有较好的依从性。口腔崩解片还具有服用方便、起效快、生物利用度高、对消化道黏膜刺激性小等特点[2]。羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin,HP-β-CD),为略呈锥形的中空圆筒立体环状结构,能够包络各种客体分子,药物进入环糊精空腔后,其构象发生改变,使药物附着于包合物中,掩盖药物的不良气味,提高药物稳定性和生物利用度[3-6]。本研究通过HP-β-CD包合苯甲酸利扎曲普坦来掩盖其苦味,同时优化其口腔崩解片的处方,加快起效速度。
1 仪器与试药
CPR-18型8冲旋转压片机(意大利BONAPACE);TMG 1/6型混合制粒机(德国Glatt);Quadro Comil U5型锥式整粒机(IDEX Corperation,USA);UV分光光度计(V-630,Jasco,Japan);粉末流动性检测仪、振实密度测定仪、脆碎度仪、System 860DL型溶出仪、HDT-400C硬度仪(美国Logan);游标卡尺(美国SATA);DT50型自动崩解仪(瑞士Sotax)。
苯甲酸利扎曲普坦对照品(上海一研生物科技有限公司,含量:99.9%,批号:17321301);苯甲酸利扎曲普坦原料药(鲁南制药集团股份有限公司);羟丙基-β-环糊精(河南瑞仁生物工程有限公司);甘露醇(江苏倍达医药科技有限公司);交联聚维酮(PVPP,美国阿施兰德,批号:0002230813);羧甲基纤维素钠(CMC-Na,明台化工股份有限公司,批号:5190800005267);乳糖(DFE,批号:104BX94);滑石粉、硬脂酸镁(Peter Greven,批号:518022299);其余试剂均为分析纯,水为纯化水。
2 方法与结果
2.1 苯甲酸利扎曲普坦含量测定
2.1.1 供试品溶液的配制 取10片苯甲酸利扎曲普坦口崩片,研细,精密称取细粉适量(约相当于苯甲酸利扎曲普坦5 mg),加0.1 mol·L-1盐酸溶液制成含苯甲酸利扎曲普坦20 μg·mL-1的溶液,经0.45 μm微孔滤膜过滤,取续滤液,即得。
2.1.2 对照品储备液的配制 取适量苯甲酸利扎曲普坦对照品,加0.1 mol·L-1盐酸溶液制成含苯甲酸利扎曲普坦29 μg·mL-1的溶液,即得对照品储备液。
2.1.3 空白溶液的配制 按照处方量制备不含苯甲酸利扎曲普坦的空白片剂,照“2.1.1”项下方法制备空白溶液。
2.1.4 专属性试验 取空白溶液(0.1 mol·L-1盐酸溶液)、对照品溶液、供试品溶液,分别在260~300 nm波长处扫描,结果在281 nm处出现最大吸收峰,且空白溶液在(281±5)nm处未出现相同的吸收峰,故选择281 nm为测定波长[7]。
2.1.5 线性关系考察 取“2.1.2”项下对照品储备液适量,滤膜过滤,加0.1 mol·L-1盐酸溶液制成5.80、11.60、23.20、29.00、34.80 μg·mL-1系列质量浓度线性溶液,在281 nm处测定吸光度,进行线性回归分析,结果苯甲酸利扎普坦质量浓度在5.80~34.80 μg·mL-1与峰面积呈良好的线性关系,回归方程为Y=0.014 87X+0.001 47,r=0.9999。
2.1.6 精密度考察 取“2.1.2”项下对照品储备液适量,滤膜过滤,连续测定6次,吸光度的RSD为0.34%,表明本方法仪器精密度良好。
2.1.7 回收试验 称取阴性空白片剂粉未适量,置于量瓶中,精密加入苯甲酸利扎曲普坦对照品适量,制成质量浓度相当于80%、100%、120%样品溶液,测定吸光度,结果平均回收率均<100.3%,RSD均<0.60%(n=3)。
2.2 苯甲酸利扎曲普坦口腔崩解片的制备
2.2.1 苯甲酸利扎曲普坦的HP-β-CD包合物的制备 苯甲酸利扎曲普坦与舌头上的味蕾受体结合从而产生苦味,HP-β-CD可以阻止苯甲酸利扎曲普坦与苦味受体结合,从而切断信号传导掩盖苦味。通过研磨法制备苯甲酸利扎曲普坦HP-β-CD包合物,在室温条件下,称取苯甲酸利扎曲普坦原料药和HP-β-CD,按照1∶1、1∶2、1∶3的摩尔比混合,加入少量水(使苯甲酸利扎曲普坦与HP-β-CD更好地混合)置于研钵中研磨15 min,烘箱40℃干燥12 h。将物料粉碎后过200目筛网,备用。包合物收率(%)=包合物收得量/(HP-β-CD投入量+苯甲酸利扎曲普坦投入量)×100%。
2.2.2 苯甲酸利扎曲普坦HP-β-CD包合物的评价照紫外-可见分光光度法在281 nm处测定吸光度,计算苯甲酸利扎曲普坦的包封率,包封率(%)=(包合物苯甲酸利扎曲普坦含量×包合物收得量)/苯甲酸利扎曲普坦投入量×100%,结果见表1。
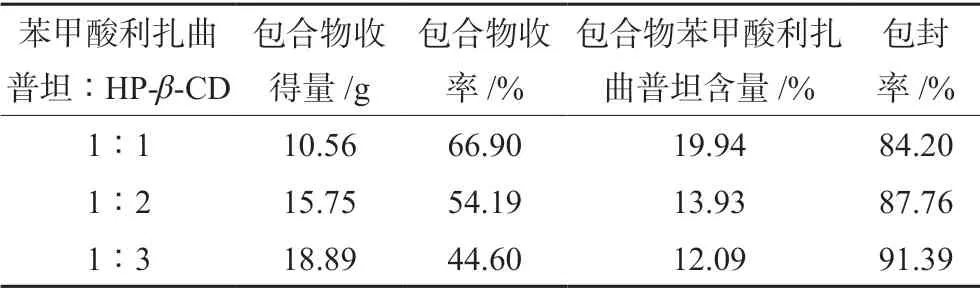
表1 苯甲酸利扎曲普坦与HP-β-CD不同配比的包封率Tab 1 Entrapment rate of rizatriptan benzoate and HP-β-CD at different ratios
选择22~28岁的6名健康男性志愿者进行口味测评,每个志愿者口含苯甲酸利扎曲普坦原料药约2 mg,包合比分别为1∶1、1∶2、1∶3的包合物各30 s,记录苦味水平。测试前用水冲洗口腔两次以免产生偏差,测试不同样品的时间间隔不少于30 min。苦味水平评分:0=强烈苦味,1=中等苦味,2=轻微苦味,3=无苦味,6位志愿者分别以ABCDEF表示,评价结果见表2。
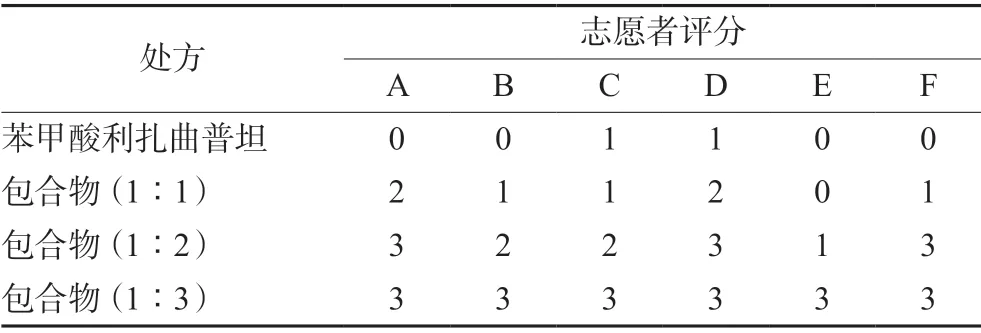
表2 苯甲酸利扎曲普坦与HP-β-CD不同配比苦味评估结果Tab 2 Evaluation of bitterness of rizatriptan benzoate and HP-β-CD at different ratios
结果显示,苯甲酸利扎曲普坦与HP-β-CD按1∶3混合时,包合物的包封率高,所得包合物无味,掩味效果好。按照其他包合比例所制包合物均有不同程度的苦味、包封率低。因此选择苯甲酸利扎曲普坦与HP-β-CD的包合比为1∶3。
2.2.3 口腔崩解片的处方优化 口腔崩解片的特点是能够迅速崩解,溶出速度快。口腔崩解片的硬度与崩解时限常成负相关,所以在满足口腔崩解片崩解时限尽可能小的同时要保证其硬度尽可能大。片剂的硬度过小,会导致生产难度大,同时口腔崩解片的脆碎度容易不合格[8]。因此根据口腔崩解片的崩解时限和硬度结果,对处方进行优化。本实验以CMC-Na、甘露醇、乳糖、PVPP、滑石粉、硬脂酸镁为辅料直接压片,其中甘露醇为填充剂,PVPP为超级崩解剂,CMC-Na为黏合剂,根据预实验结果这3个因素对口腔崩解片的外观、片重、厚度、脆碎度、含量等影响偏小,对硬度及崩解时限影响较大。采用BBD设计法以甘露醇(A)、CMC-Na(B)和PVPP(C)的用量百分比3个因素作为考察因素,分别用代码-1、0、1表示3个因素的低、中、高3个水平,以口腔崩解片的硬度(Y1)和崩解时限(Y2)为主要考察指标,对该口腔崩解片的处方进行优化,3个影响因素及其水平见表3。

表3 BBD设计因素水平表Tab 3 Factor and level for BBD design
根据BBD设计的处方制备苯甲酸利扎曲普坦口腔崩解片,除硬脂酸镁外,所有物料过60目筛后以50 r·min-1混合10 min,再加入过80目筛的硬脂酸镁50 r·min-1混合5 min。使用8 mm平冲头以10 kN的压力直接压片,目标片重为150 mg。结果见表4。
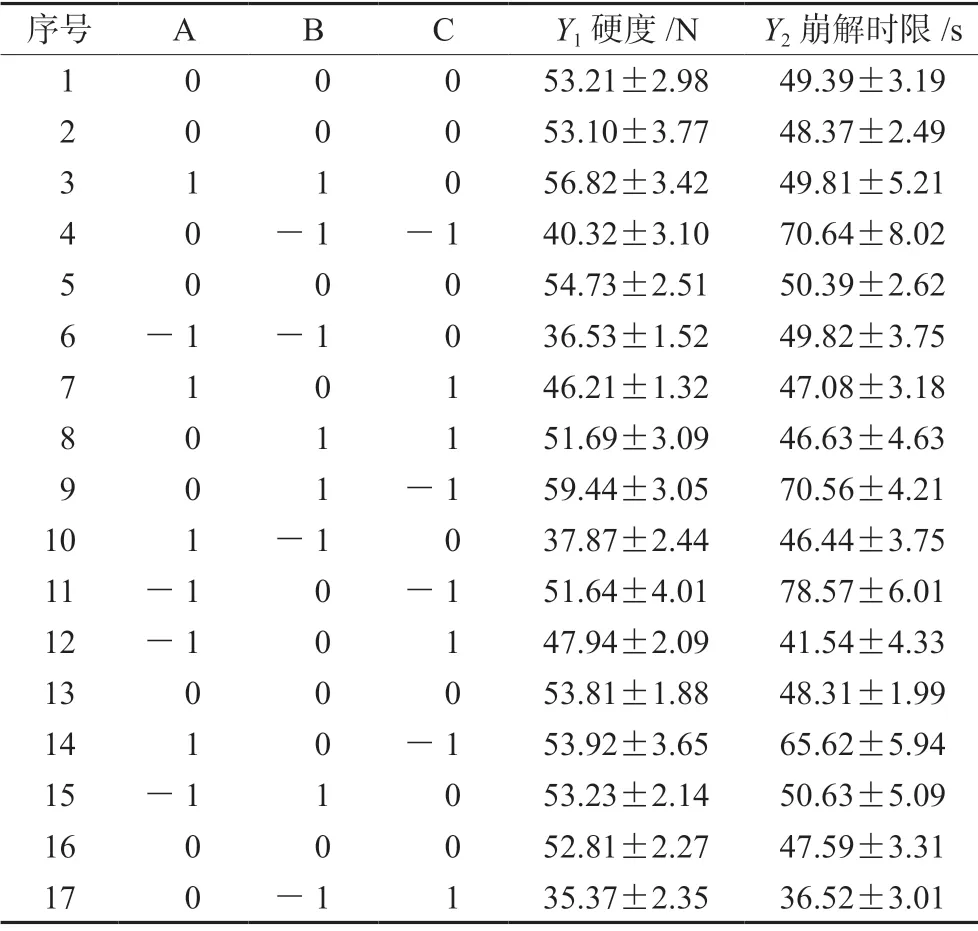
表4 各因素对苯甲酸利扎曲普坦口腔崩解片的影响Tab 4 Influence of various factors on rizatriptan benzoate orally disintegrating tablet
将硬度和崩解时限作为优化因素,使其具有最大硬度和最小崩解时限,得到的响应面见图1,崩解时限和硬度的拟合方程为Y1和Y2,Y1=53.53+0.69A-3.01B+8.89C-1.00AB+0.56AC-0.70BC-2.10A2-1.51B2-5.32C2,Y2=48.81-1.45A-14.20B+1.78C+4.62AB+0.64AC+2.55BC+1.24A2+8.15B2-0.87C2。
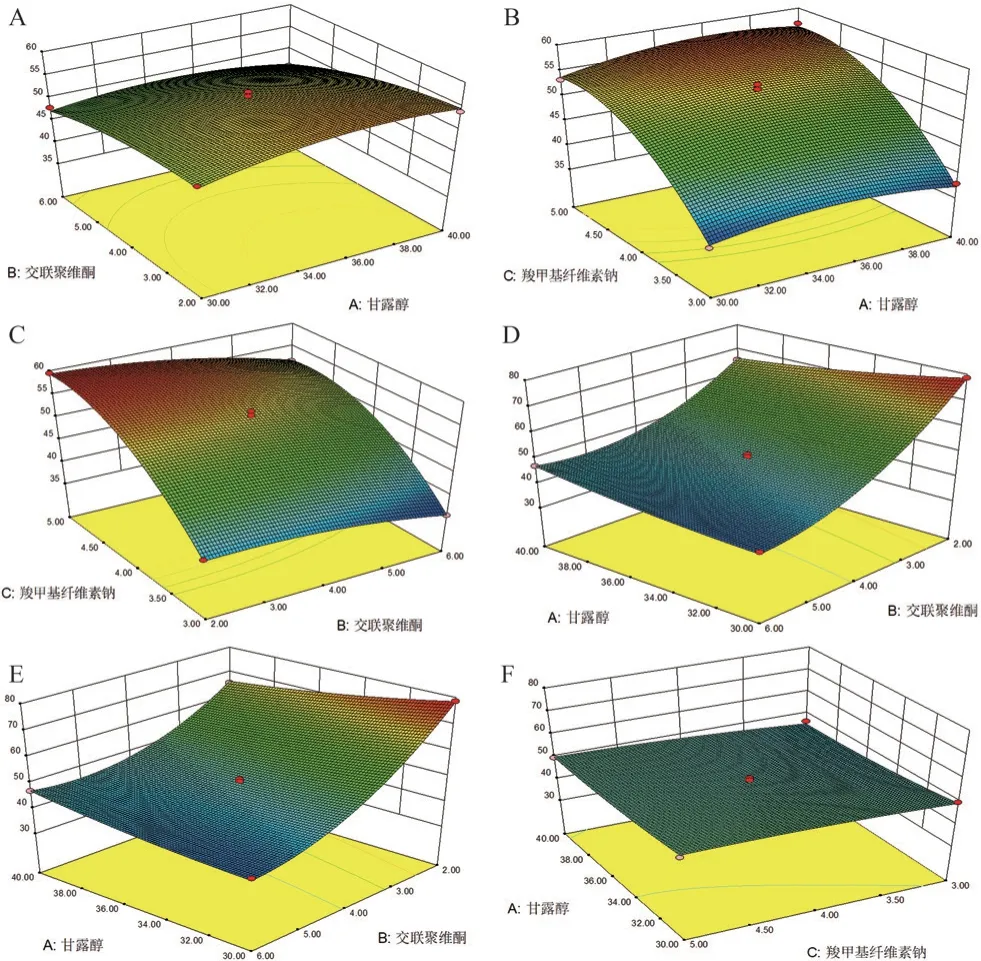
图1 硬度和崩解时限响应面图Fig 1 Response surface diagram of hardness and disintegration time limit
通过双侧方差分析(ANOVA)对硬度(Y1)和崩解时限(Y2)的F值和P值进行评估,结果见表5。2个模型的P值均小于0.05(显著);失拟项值均大于0.05(不显著),说明模型的预测结果与实际结果有较好的拟合度,能用于自制口腔崩解片的处方筛选。因素B、C对片剂的度有显著性影响;因素A、B和C对崩解时限有显著性影响。因素C对硬度的影响最大(F值895.94),因素B对崩解时限的影响最大(F值1017.69)。AB的相互作用对硬度具有协同作用(P=0.0483),AB、BC的相互作用对崩解时限具有协同作用(P分别为0.0002,0.0049)。
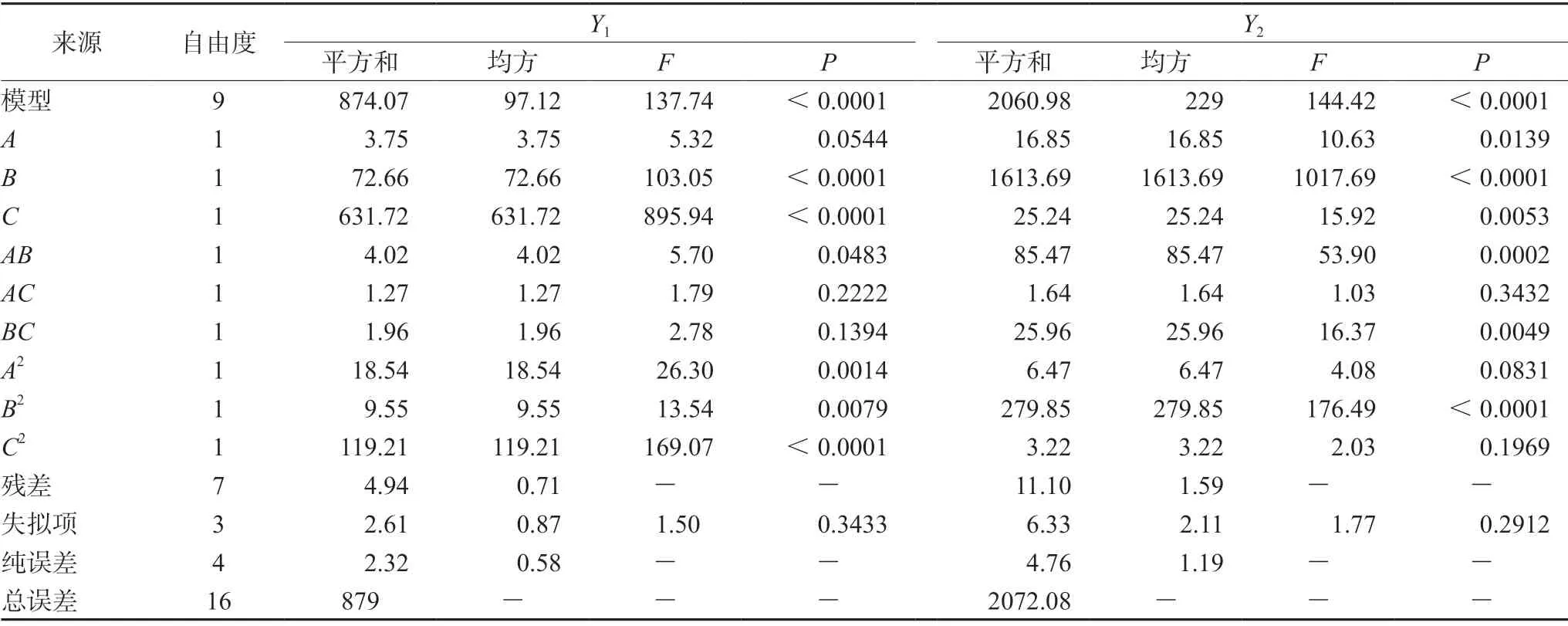
表5 BBD实验回归模型的方差分析Tab 5 Variance analysis in regression models with BBD test
根据实验结果模拟苯甲酸利扎曲普坦口腔崩解片的最优配方,实验函数的最大期望值为0.807%。当获得最优的结果时,甘露醇为35.46%,PVPP为4.60%,CMC-Na为4.74%,硬度为56.0526 N,崩解时限为46.73 s,这一实验模型适用于直压法制备苯甲酸利扎曲普坦口腔崩解片硬度最大化和崩解时限最小化的要求。最终确定苯甲酸利扎曲普坦的处方为:苯甲酸利扎曲普坦包合物41.35 mg、甘露醇53.19 mg、PVPP 6.9 mg、CMC-Na 7.11 mg、乳糖36.95 mg、滑石粉3.00 mg、硬脂酸镁1.50 mg。
2.3 最佳处方工艺验证
2.3.1 粉末流动性 生产片剂时,需要确定混粉从进料斗到达模冲过程中是否具有连续且均匀的流动性,即需要表征混粉的流动性[9]。根据最优处方称取苯甲酸利扎曲普坦和其他辅料,按照“2.2.3”中方法混合。从混粉中准确称取重量(W),缓慢的地将其转移到量筒中,测量初始体积(V1),设置振动频率100次·min-1,振动次数500次,测量体积(V2)。计算堆密度(ρb)和振实密度(ρbt):ρb=W/V1;ρbt=W/V2。
休止角反映粉粒间动态的摩擦系数大小,休止角越大,摩擦系数越大,粉末的流动性越差。Tanθ=H/R,其中为θ为休止角,R为圆锥形桩的半径,H为圆椎形桩的高度。结果如表6所示,3批自制批的混粉均具有良好的流动性(休止角<30°,卡尔指数≤12)。
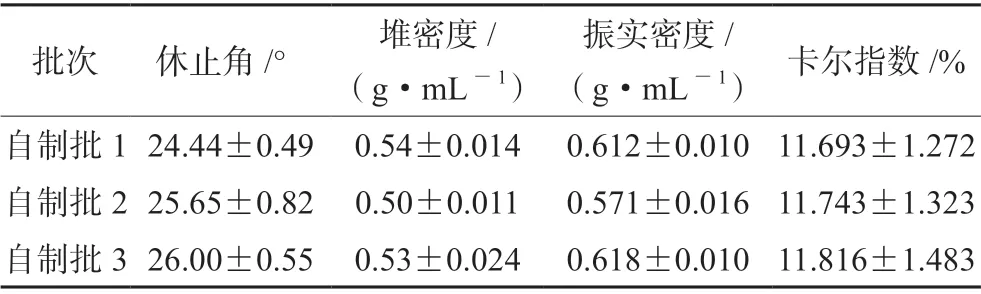
表6 粉末流动性评价结果Tab 6 Powder blending
2.3.2 物理特性检测 按照“2.2.3”项下处方优化工艺,自制3批苯甲酸利扎曲普坦口腔崩解片,对该口腔崩解片的崩解时限、硬度、脆碎度、含量等特性进行考察,同时对苦味水平进行评价,结果见表7。结果显示口腔崩解片外观光滑、平整,3批自制片批间差异较小,无苦味,各参数均在范围内,能够达到苯甲酸利扎曲普坦口腔崩解片的制备要求。
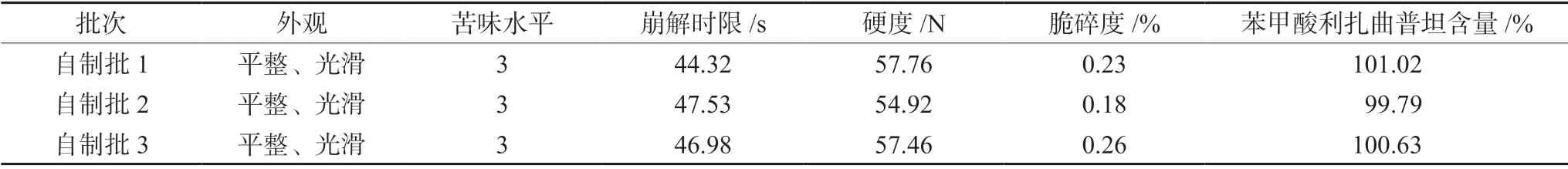
表7 自制苯甲酸利扎曲普坦口腔崩解片的物理特性及含量测定结果Tab 7 Physical property and content of rizatriptan benzoate orally disintegrating tablet
2.3.3 体外溶出检测 采用溶出测定第二法(桨法),分别以0.1 mol·L-1盐酸溶液、pH 4.5醋酸盐缓冲溶液、pH 6.8磷酸盐缓冲溶液、水为溶出介质,温度(37±2)℃,搅拌浆转速75 r·min-1,分别于2、5、10、15、30 min取样5 mL,同时补充等量同温的溶出介质,测定自制批口腔崩解片溶出度,结果如图2所示。3批自制批药物的溶出率均大于85%,且批间差异较小,药物溶出快。
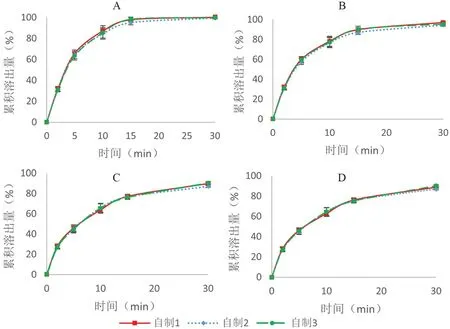
图2 不同介质中体外溶出曲线对比(n=6)Fig 2 In vitro dissolution profiles in different media(n=6)
2.4 初步稳定性研究
将片剂包装在玻璃小瓶中,在温度(40.0±2)℃、湿度(75±5)%恒温恒湿箱中考察3个月,分别于0、1、2、3个月取样检测片剂外观性状、崩解时限、含量和体外药物溶出度等,结果见表8。在储存过程中,片剂的外观性状、体外崩解时限、药物含量和药物溶出度均无显著性差异,表明该口腔崩解片的稳定性良好。
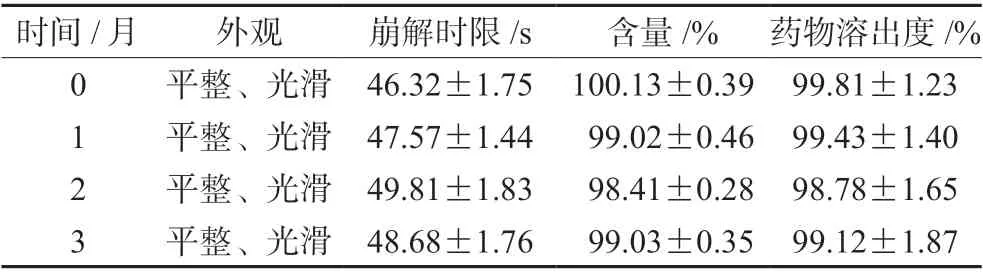
表8 加速条件下的稳定性考察结果Tab 8 Stability under accelerated conditions
3 结论
本研究通过研磨法制备苯甲酸利扎曲普坦包合物,结果表明苯甲酸利扎曲普坦与HP-β-CD的摩尔比为1∶3时所制的包合物无苦味,证明包合能遮盖苯甲酸利扎曲普坦的不良味道。苯甲酸利扎曲普坦用于治疗急性偏头痛,吸收速率越快越有利于发挥其功效,自制苯甲酸利扎曲普坦口腔崩解片的崩解速度快、掩味效果好、服用方便,能更快地发挥药效。硬度是影响崩解速度和溶出度的重要因素,而崩解速度和溶出度会对生物利用度产生影响,崩解时限与片剂的机械强度成正比,为加快口腔崩解片的崩解,通常将硬度设计较低。口腔崩解片的理想崩解时限通常不大于1 min,因此需要降低生产的硬度,但硬度过小在生产中会遇到一些挑战,因此口腔崩解片的制备工艺须在机械强度和崩解时限之间进行平衡。本实验通过BBD实验设计,选择填充剂、崩解剂和黏合剂为影响因素对口腔崩解片的硬度和崩解时限进行优化,选择最优的处方。根据优化处方制备的苯甲酸利扎曲普坦口腔崩解片,粉末流动性良好,工艺稳定,所得崩解片的溶出度高,稳定性良好,可为苯甲酸利扎曲普坦口腔崩解片制备提供参考。

