血清α-MSH水平与颅脑损伤患者病情严重程度及预后的关系
马小强,刘佰林,林 琳,罗 谊
颅脑损伤属临床常见创伤外科疾病,大量炎性介质的产生可介导脑组织水肿、脑细胞坏死及继发性再出血,加重疾病进展,致残率、病死率高[1-2]。据统计,我国颅脑损伤每年患病人数达60万,其中约10万人死亡[3]。α-促黑细胞刺激素(α-MSH)是一种具有较强抗炎及神经保护作用的神经内分泌肽,在体内发挥广泛生理作用[4]。目前关于颅脑损伤患者α-MSH水平的研究并不多见,本研究探究了颅脑损伤患者血清α-MSH水平的变化,以及与颅脑损伤患者病情严重程度及预后的关系,为α-MSH及其类似物的临床应用提供依据。现报告如下。
1 资料与方法
1.1一般资料 回顾性分析我院2017年6月—2018年6月收治的52例急性颅脑损伤的临床资料。纳入标准:均于伤后24 h内收治入院,经CT、MRI等影像学检查确诊;均于颅脑损伤后24 h、3、5、7 d抽取静脉血检测α-MSH水平;患者家属均自愿签署知情同意书。排除标准:合并其他脏器损伤、慢性器质性损伤、感染病史、神经系统损伤病史及血液病、肿瘤者。男39例,女13例,年龄18~71(43.25±6.84)岁。根据格拉斯哥昏迷(GCS)评分分为轻度组(GCS评分13~15分)22例,中度组(GCS评分9~12分)17例,重度组(GCS评分3~8分)13例。根据样本量估算公式,按照1∶1配比原则,每例病例配一个对照,配比变量为同性别、同年龄、同民族、同居住地,选取同期本院体检正常志愿者52例为对照组,男34例,女18例,年龄20~73(44.71±5.26)岁。4组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
1.2α-MSH水平检测 急性脑损伤各组患者入院后给予临床常规监测,分别于颅脑损伤后24 h、3、5、7 d抽取静脉血5 ml,对照组取一次空腹状态静脉血5 ml,室温下静置30 min,3000 r/min离心15 min获取上层血清,置于-70 ℃冰箱保存。采用酶联免疫吸附试验(ELISA)检测,试剂盒由江苏江莱生物科技有限公司提供,具体操作严格参照说明书进行。
1.3预后评价 ①根据颅脑损伤患者预后存活情况分为存活组42例与死亡组10例。②根据颅脑损伤患者是否发生全身炎症反应综合征(SIRS)分为SIRS组20例与非 SIRS组32例。

2 结果
2.1不同时间点血清α-MSH水平比较 各组伤后不同时间点血清α-MSH水平比较差异均有统计学意义(P<0.01)。与对照组比较,颅脑损伤轻、中、重度组各时间点血清α-MSH水平均显著降低(P<0.05)。伤后24 h及第3天,轻度组血清α-MSH水平高于中度组和重度组,且中度组高于重度组(P<0.05)。伤后第5天,轻度组血清α-MSH水平高于中度组和重度组(P<0.05),但中度组和重度组比较差异无统计学意义(P>0.05)。伤后第7天,轻、中、重度组血清α-MSH水平比较差异无统计学意义(P>0.05)。轻度组和中度组第5天血清α-MSH水平显著低于其他时间点,重度组第3 天血清α-MSH水平显著低于其他时间点(P<0.05)。见表1。

表1 4组纳入者不同时间点血清中α-MSH水平比较
2.2存活组与死亡组颅脑损伤后血清α-MSH水平比较 存活组伤后不同时间点血清α-MSH水平均高于死亡组,差异有统计学意义(P<0.01)。见表2。

表2 存活组与死亡组颅脑损伤后不同时间血清α-MSH水平比较
2.3SIRS组与非 SIRS组伤后24 h血清α-MSH水平比较 颅脑损伤后24 h血清α-MSH水平SIRS组与非 SIRS组分别为(18.43±4.90)pg/ml、(23.22±6.15)pg/ml。SIRS组血清α-MSH水平低于非SIRS组,差异有统计学意义(P<0.01)。ROC曲线显示,颅脑损伤后24 h血清α-MSH水平截断值为19.35 pg/ml,预测SIRS的敏感度、特异度分别为82.50%、80.00%。见图1。
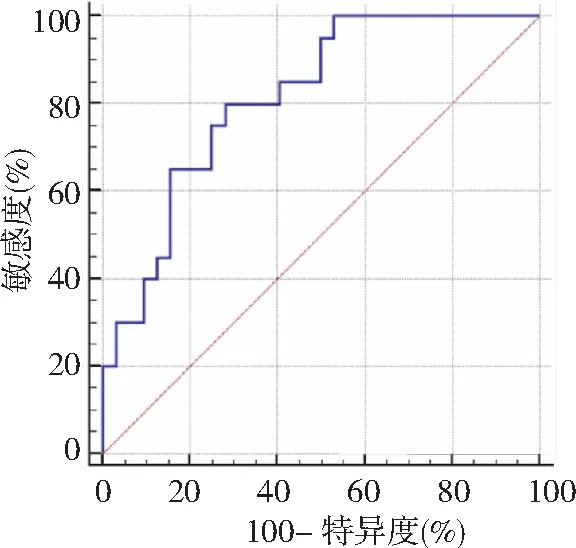
图1 颅脑损伤后24 h 血清α-MSH水平对SIRS的预测价值α-MSH为α-促黑细胞刺激素,SIRS为全身炎症反应综合征
3 讨论
颅脑损伤是世界范围内的公共健康问题,寻找其治疗方法,改善功能康复是目前医学研究的热点。多项研究指出,颅脑损伤患者除受伤时遭受的直接损伤外,还伴有炎性因子介导的继发性炎症损伤[5-6]。张志强等[7]研究证明,减轻颅脑损伤患者继发性损伤对降低患者致残、致死率至关重要。α-MSH是一种分布于丘脑、垂体、脊髓及胃肠道等部位的内源性肽,可通过与黑色素受体(MCR)结合发挥炎症抑制及免疫调节的重要作用,抑制核因子-κB(NF-κB)、嗜中性粒细胞趋化因子及白细胞介素、肿瘤坏死因子-α、一氧化氮等的产生,并通过中枢神经传导通路发挥外周炎症反应调控作用[8-9]。有动物实验证实,α-MSH及其类似物可对脑缺血、脊髓及神经损伤、动物脑损伤起到一定保护作用[10]。但关于α-MSH与人体颅脑损伤程度的临床研究相对鲜见。国外有研究发现颅脑损伤或蛛网膜下腔出血患者血清α-MSH水平显著降低,且与患者预后相关[11]。冯贵龙等[12]研究发现,严重多发伤患者血清α-MSH水平显著降低,且创伤越严重,血清α-MSH水平越低。
本研究结果显示,颅脑损伤轻、中、重组各时间点血清α-MSH水平均显著低于对照组,且伤后24 h、第3、5天时病情越严重的患者血清中α-MSH水平越低,提示颅脑外伤可对血清α-MSH有一定消耗,且血清α-MSH水平与病情严重程度密切相关。但伤后第5 天时,中度组和重度组血清中α-MSH水平比较差异无统计学意义,其原因可能是由于重度组伤后血清α-MSH水平迅速下降,在第3天时达最低值,而中度组血清α-MSH水平伤后下降较缓慢,在第5天时才达最低值。伤后第7天,颅脑损伤轻、中、重度组血清α-MSH水平比较差异无统计学意义,其原因可能是由于伤后第7天可出现临床感染等其他并发症,导致患者恢复程度不一致。总体来说,颅脑损伤患者血清α-MSH水平呈先下降后上升趋势,于伤后第3~5天达最低值[13]。重度组最低值出现时间较早,也进一步提示病情越严重的患者伤后血清α-MSH消耗越多。
严重外伤或感染可导致体内促炎因子大量释放,干扰抗炎-促炎系统平衡,使机体出现发热、SIRS、多器官功能障碍综合征(MODS)[14]。本研究根据预后不同将颅脑损伤分为存活组与死亡组、SIRS组与非SIRS组,结果显示,存活组伤后各时间点血清α-MSH水平均高于死亡组,且伤后24 h SIRS组血清α-MSH水平显著低于非SIRS组。认为持续降低的血清α-MSH水平提示患者病情严重,可能会有不良预后,可预测患者发生SIRS的风险。本研究结果同时显示,颅脑损伤后24 h血清α-MSH水平截断值为19.35 pg/ml,预测SIRS的敏感度、特异度分别为82.50%、80.00%。
综上所述,颅脑损伤患者伤后血清α-MSH水平降低,且其降低水平与病情严重程度相关,病情越严重,血清α-MSH水平越低,随病情恢复,血清中α-MSH水平回升,或可通过补充外源性α-MSH治疗颅脑损伤。同时,血清α-MSH水平还具有预测患者是否继发SIRS的作用,持续低水平α-MSH提示患者病情严重,预后较差。

