蛋白质组学揭示滩羊宰后成熟过程中风味前体物质的变化机理
尤丽琴,姬 琛,罗瑞明
(宁夏大学农学院,宁夏 银川 750021)
滩羊是宁夏优势特色畜种,因其肉质细嫩鲜美、营养丰富和风味独特而闻名。宰后肌肉成熟过程中主要发生的变化为细胞代谢和内源性蛋白酶对结构蛋白的降解[1]。宰后肉成熟过程中肌内的生化反应使肉中蛋白质降解生成的氨基酸以及小分子肽类等风味前体物质在加热时产生一系列风味物质。因此,宰后成熟不仅改善了肉的嫩度,还对肉的风味产生影响,提高了肉的食用品质。
肉的生产和加工过程会引起肌肉生物化学、蛋白质丰度和结构的变化[2]。蛋白质组学是研究一定细胞、组织、体液、器官或有机体所表达的全部蛋白质的科学[3]。同位素标记相对和绝对定量技术(isobaric tags for relative and absolute quantification,iTRAQ)是目前用于蛋白质定量分析的有效技术,它具有较好的准确性和可重复性,允许同时对8 个样品中的蛋白质进行相对定量分析,其与最高分辨率的多维液相色谱串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)技术结合,可实现对低丰度蛋白的定量定性分析。从生物学方面分析,转录和翻译后修饰作用对蛋白质的表达具有调控作用,mRNA转录水平反映了其基因表达的中间状态和相应蛋白质的表达情况[4]。实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)技术应用范围较广,且能够对不同物种的mRNA表达水平进行有效的分析。宰后肉在成熟过程中包含复杂且相互依赖的生化机制,从而对肉的质地、风味和嫩度产生影响,为明确这一作用机制,可从蛋白质组学角度出发研究肉的成熟过程[5],从而探索成熟过程中肉品风味特性变化规律。
目前宰后肉的蛋白质组学分析多集中在宰后肉色泽、持水性能和嫩度的研究[6-12],而宰后成熟肉中肌原纤维蛋白降解产生风味前体物质及其结构完整性对风味形成的影响机制还未明确。因此,本研究以滩羊背最长肌为研究对象,采用iTRAQ以及多维LC-MS/MS技术,研究宰后肉不同成熟期的差异表达蛋白,确定滩羊肉成熟前后蛋白质的表达变化情况,同时采用qPCR技术对宰后滩羊肉中差异蛋白质基因表达水平进行检测,从mRNA转录水平分析差异表达蛋白基因表达情况,并分析差异表达蛋白在mRNA转录水平与蛋白水平表达之间存在的关系,初步探讨宰后滩羊肉成熟过程中风味前体物质的变化机理及其调控,为进一步研究滩羊肉宰后的代谢生化反应提供理论参考。
1 材料与方法
1.1 材料与试剂
滩羊背最长肌 宁夏盐池县大夏牧场食品有限公司。
尿素、二硫苏糖醇、碘乙酰胺、IPG buffer、甲酸美国GE公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三羧基氨基甲烷、三氯乙酸、过硫酸铵、四甲基乙二胺 美国Amresco公司;三乙二胺碳酸盐和考马斯亮蓝G-250 美国Sigma公司;胰蛋白酶美国Promega公司;乙腈和Nuclease-free H2O 美国Thermo公司;HiScript II Q RT SuperMix for qPCR(+gDNA wiper)预混液、ChamQ SYBR qPCR Master Mix试剂盒 南京诺唯赞生物科技股份有限公司。
1.2 仪器与设备
Sciex Triple TOF 5600质谱仪、Eksigent nanoLC-1D液相色谱系统(配有Analyst TF 1.1数据处理软件) 美国SCIEX公司;5910R冷冻离心机 德国Eppendorf公司;Image Scanner III扫描仪 美国GE公司;真空冷冻干燥机、NanoDrop 2000分光光度计 美国Thermo Fisher公司;VCX130超声波细胞粉碎机 美国Sonics公司;Mini PROTEAN Tetra Cell电泳仪 美国Bio-Rad公司;LightCycler®480 II型qPCR仪 瑞士Roche公司。
1.3 方法
1.3.1 样品采集
采集成熟条件为温度4 ℃、相对湿度80%的滩羊背最长肌200 mg,封装于灭菌冷冻管中待用。采样周期为4 d,即采样时间点为0、4 d和8 d,每组样本做3 个平行。
1.3.2 蛋白质组学分析
结合李子欣等[13]的方法提取滩羊肉中总蛋白,采用BCA法定量蛋白,绘制标准曲线(y=0.838 5x+0.008 8,R2=0.997 8),并通过SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)检测蛋白质量。其余样品置于-80 ℃冰箱备用。滩羊肉中蛋白iTRAQ分析委托上海鹿明生物科技有限公司进行,运用Analyst TF 1.1软件获得基于iTRAQ分析的蛋白质组学数据。蛋白质的定性及定量信息采用Protein pilot 4.0软件获得。检索的数据库为绵羊数据库,数据库来源为Uniprot。所有导出的蛋白质可信度水平均高于95%(Unused score≥1.3且peptide≥1)。数据进行归一化处理后,以“差异倍数(fold change,FC)>1.2或FC<0.8”和“P<0.05”为标准筛选差异表达蛋白。
1.3.3 差异表达蛋白基因表达分析
1.3.3.1 RNA提取
滩羊肉中总RNA的提取采用mirVanaTMRNA Isolation Kit说明书进行操作,使用NanoDrop 2000分光光度计确定RNA的纯度,并使用溴化乙锭染色的琼脂糖凝胶进行电泳以评估RNA完整性,将所得到的RNA置于-70 ℃保存备用。
1.3.3.2 反转录
利用HiScript II Q RT SuperMix for qPCR(+gDNA wiper)将待测RNA反转录成cDNA。反转录体系:总RNA 0.5 μg、4×gDNA wiper Mix 2 μL,加Nucleasefree H2O至8 μL,42 ℃保温2 min去除基因组DNA,然后加5×HiScript II Q RT SuperMix II 2 μL。反应程序:37 ℃ 15 min,85 ℃ 5 s。反转录完毕后加入90 μL Nuclease-free H2O储存在-20 ℃冰箱备用。
1.3.3.3 qPCR分析
反应体系参照ChamQ SYBR qPCR Master Mix试剂盒说明书要求:2×ChamQ SYBR qPCR Master Mix 5 μL、上下游引物(10 μmol/L)各0.2 μL、cDNA 1 μL、Nuclease-free H2O 3.6 μL。采用LightCycler®480 II型qPCR仪进行扩增,PCR程序:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火和延伸30 s,45 个循环。循环结束后利用熔解曲线检测产物特异性:从60 ℃缓慢升温至97 ℃,每升高1 ℃采集5 次荧光信号。每个样品一式三份进行分析。引物基于美国国家生物信息中心(National Center for Biotechnology Information,NCBI)数据库获得的mRNA序列设计并由上海捷瑞生物工程有限公司合成,如表1所示。以GAPDH为内参,使用2-ΔΔCt方法计算基因相对表达量。

表1 qPCR引物序列Table1 Primer sequences used for qPCR
1.4 数据统计与分析
采用Microsoft Excel 2010软件处理数据。使用Origin 2020 b软件绘图。
2 结果与分析
2.1 宰后滩羊肉蛋白提取与质量检测结果
宰后滩羊肉蛋白进行提取后,采用SDS-PAGE对宰后不同成熟期滩羊肉蛋白样品进行质量检测,结果如图1所示。滩羊成熟0 d时的3 个生物学重复(0 d-1、0 d-2和0 d-3)、成熟4 d时的3 个生物学重复(4 d-1、4 d-2和4 d-3)和成熟8 d时的3 个生物学重复(8 d-1、8 d-2和8 d-3)条带均清晰度好,且完整均一,表明本次提取的蛋白质量较好,可满足后期iTRAQ技术分析要求。

图1 宰后滩羊肉成熟过程中总蛋白SDS-PAGE检测结果Fig. 1 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis pattern of total proteins in Tan sheep meat during post-mortem ageing
2.2 差异表达蛋白的筛选及丰度的变化
2.2.1 差异表达蛋白的筛选结果
通过iTRAQ结合LC-MS/MS检测宰后不同成熟期滩羊肉中差异蛋白质的表达变化,采用Protein pilot 4.0软件检索蛋白质数据,进一步筛选可信度水平在95%以上(Unused score≥1.3)且至少包含一个Unique肽段的蛋白为可信蛋白,多组重复以均能鉴定到可信蛋白为基本条件,共定性、定量鉴定出814 个可信蛋白。在鉴定出可信蛋白的基础上,分别以“FC>1.2或FC<0.8”且“P<0.05”作为宰后滩羊肉成熟时差异表达蛋白的筛选条件,共得到474 个差异表达蛋白。图2为差异表达蛋白火山图,能够体现宰后滩羊肉不同成熟期差异表达蛋白的显著性。由图2A可知,宰后成熟0 d组和4 d组对比,差异表达蛋白159 个,其中4 d组与0 d组相比上调蛋白151 个,下调蛋白8 个;由图2B可知,宰后成熟4 d组和8 d组对比,差异表达蛋白151 个,其中8 d组与4 d组相比上调蛋白35 个,下调蛋白116 个;由图2C可知,宰后成熟0 d组和8 d组对比,差异表达蛋白164 个,其中8 d组与0 d组相比上调蛋白67 个,下调蛋白97 个。

图2 宰后滩羊肉成熟过程中差异表达蛋白火山图Fig. 2 Volcano plots of differentially expressed proteins in Tan sheep meat during post-mortem ageing
由此可知,宰后成熟0~4 d时,滩羊肉中上调蛋白质处于优势状态,数量较多,说明成熟4 d前宰后滩羊肉肌细胞尚未彻底凋亡,细胞内代谢活动尚在进行,并且代谢活性大于蛋白质降解程度。而宰后成熟4~8 d时,滩羊肉中下调蛋白数量较多,上调蛋白质数量减少,说明此阶段蛋白质降解程度明显。宰后成熟0~8 d时,滩羊肉中差异表达蛋白的数量呈增加趋势,说明成熟对滩羊肉蛋白质变化的影响较大。
2.2.2 差异表达蛋白丰度的变化
基于宰后滩羊肉成熟过程中鉴定出差异表达蛋白的定量数据,根据“FC>1.2或FC<0.8”和“P<0.05”的筛选标准,在成熟期0、4 d和8 d中两两对比的基础上,共筛选出了262 个与风味相关的差异表达蛋白,其中0 d和4 d对比组有131 个差异表达蛋白,0 d和8 d对比组有133 个差异表达蛋白,4 d和8 d对比组有125 个差异表达蛋白。韦恩图显示了宰后滩羊肉成熟过程中差异表达蛋白的数量分布和差异,其中0 d和4 d对比组与4 d和8 d对比组共有的差异表达蛋白71 个,0 d和4 d对比组与0 d和8 d对比组共有的差异表达蛋白79 个,0 d和8 d对比组与4 d和8 d对比组共有的差异表达蛋白83 个,而0 d和4 d对比组、4 d和8 d对比组及0 d和8 d对比组3 组共有的差异表达蛋白46 个(图3)。表2中列出了宰后成熟过程中滩羊肉中46 个共有差异表达蛋白的具体信息。
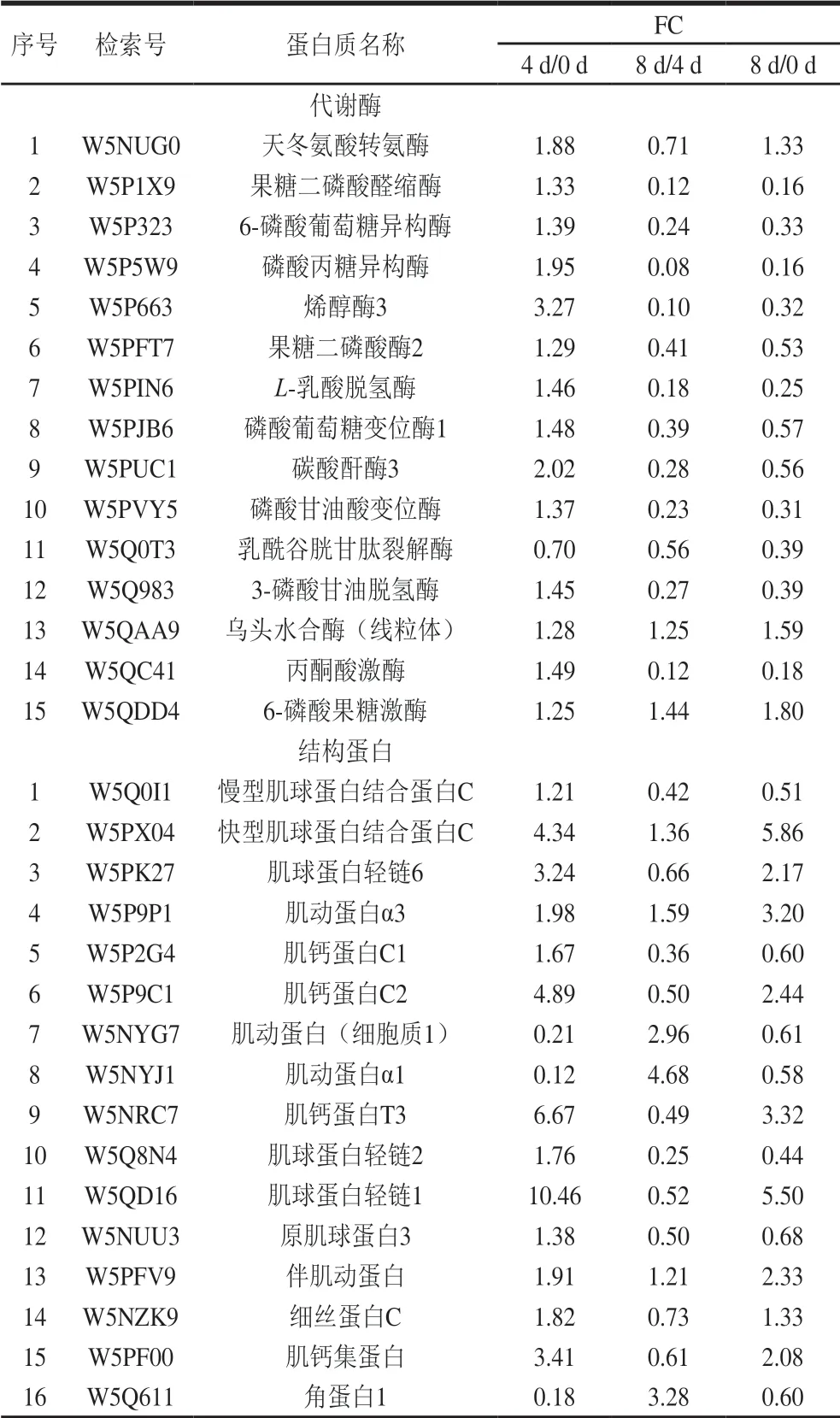
表2 宰后滩羊肉成熟过程中共有的差异表达蛋白Table2 Shared differentially expressed proteins in Tan sheep meat during post-mortem ageing
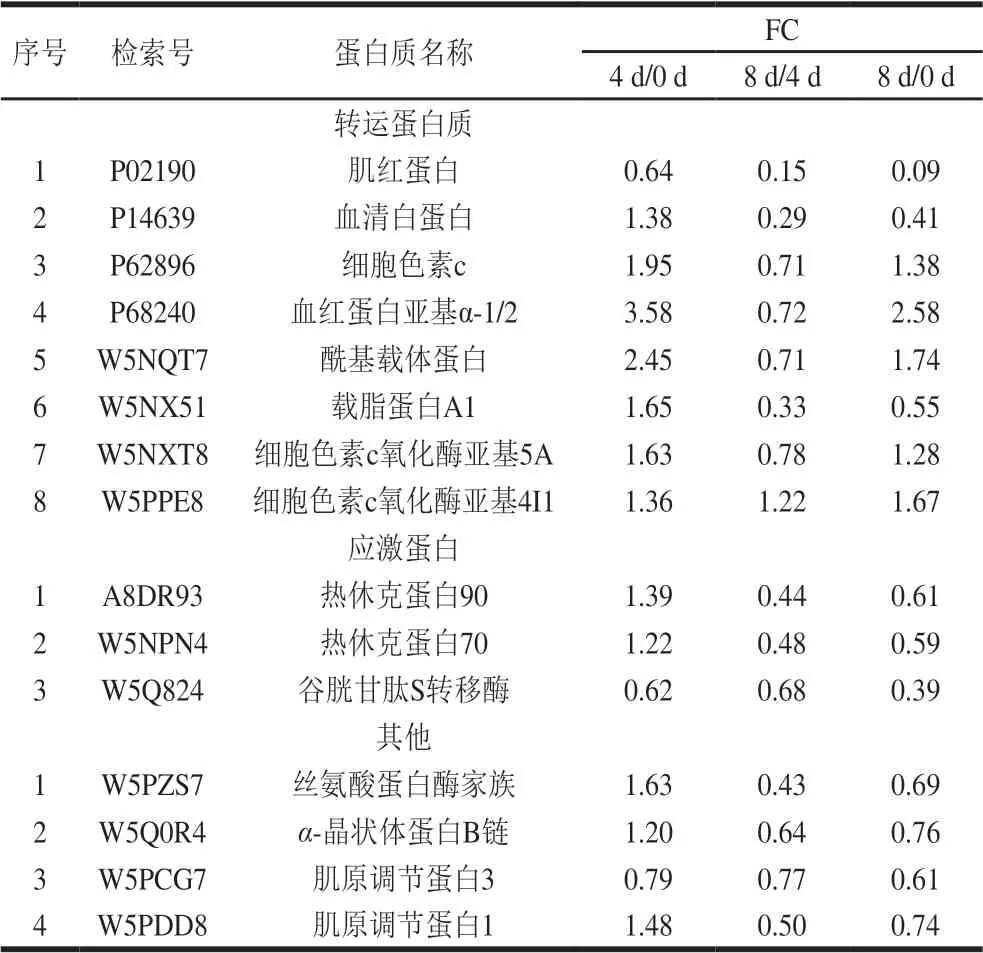
续表2
宰后滩羊肉成熟过程中与风味调控相关的差异表达蛋白主要集中在代谢酶、结构蛋白和应激蛋白等。宰后滩羊肉不同成熟期共有的差异表达蛋白中代谢酶和结构蛋白的种类较多且含量变化较明显,其中代谢酶15 种、结构蛋白16 种、应激蛋白3 种。肉风味的变化主要取决于宰后肉中肌原纤维结构完整性和结构蛋白降解程度的相互关系。本研究主要从宰后代谢酶调控、结构蛋白降解和应激蛋白的防护和抵御等方面来分析宰后滩羊肉成熟过程中影响风味前体物质形成的机制。
宰后肌肉代谢是影响肉品质的关键因素之一[14]。糖酵解直接影响宰后肉能量代谢,进而影响肉中风味前体物质的产生[15]。本研究发现参与糖酵解代谢的酶中,磷酸葡萄糖变位酶1、6-磷酸果糖激酶、果糖二磷酸醛缩酶、3-磷酸甘油脱氢酶、磷酸丙糖异构酶、烯醇酶3、L-乳酸脱氢酶和丙酮酸激酶在宰后滩羊肉成熟0~4 d时的表达上调,而在成熟4~8 d时绝大部分代谢酶表达下调。这是因为畜禽被屠宰时,肌纤维处于低氧缺血状态,使肌肉中腺苷酸激活蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)活性提高,宰后的肌肉能量代谢转为无氧降解,在缺氧应激的状态下,活化的AMPK能够激活提高糖酵解关键酶己糖激酶、6-磷酸果糖激酶和丙酮酸激酶活性磷酸化酶激酶[16-18],加强糖原分解。因此,宰后滩羊肉在成熟前期糖酵解途径被调节,参与滩羊肉宰后成熟的糖酵解酶在成熟0~4 d时表达上调。随着成熟的进行,由于无氧降解产生乳酸及ATP分解产生磷酸根离子使pH值降低,参与糖酵解的这些酶受到抑制或失活,检测到滩羊肉中糖酵解酶在成熟4~8 d表达下调。Ross等[19]研究宰后猪肉发现,前期猪肉磷酸化水平较高,导致pH值下降速率较快,而且经磷酸化修饰的丙酮酸激酶和磷酸丙糖异构酶与宰后肉pH值下降有关。赵巧灵[4]研究发现金枪鱼冷藏过程中代谢酶中磷酸果糖激酶、丙酮酸激酶、烯醇化酶、磷酸甘油激酶、丙酮酸激酶和磷酸丙糖异构酶表达量变化明显,且这些酶在糖酵解途径中起调控作用。以上研究结果与本研究一致。综上,宰后糖酵解酶的活性是影响宰后肉pH值下降速率的主要因素,其影响宰后肉僵直的进程,并对肉中整体风味的形成具有决定性作用。
宰后肉成熟过程中,由于肌原纤维和细胞结构蛋白的降解,肌肉结构变得更松散,离子和蛋白质之间的相互作用改变,内部毛细管空间增加[20]。因此,宰后肌原纤维蛋白的水解及肌原纤维结构的解离使肉的持水性、色泽和风味等都可能受到影响。结构蛋白与构成细胞和生物体有关,是宰后肌肉收缩、能量代谢的基础[21]。肌球蛋白、肌动蛋白和肌钙蛋白等都与肌肉收缩有关,结构蛋白直接影响宰后肉品质,如嫩度、保水性和肉色等[22]。肌动蛋白是参与肌肉收缩的蛋白,在肉制品加工过程中与肉品质的黏结性和质构都有密切关系[23]。本研究发现,宰后滩羊肉成熟0~4 d时,仅肌动蛋白α1、肌动蛋白(细胞质1)和角蛋白1表达量呈明显下降趋势。说明此阶段肉中肌原纤维蛋白整体降解不明显,肌原纤维结构相对完整,一定程度上,肌原纤维的结构完整性和降解程度反映了肌肉的成熟度,因此,宰后成熟4 d时滩羊肉的成熟过程尚未完成,风味物质还需进一步降解产生。肌钙蛋白由T、C、I 3 个亚基构成,和原肌球蛋白一起通过调节钙离子对横纹肌动蛋白ATP酶的活性从而调节肌动蛋白和肌动球蛋白相互作用[24]。滩羊肉中肌钙蛋白C1、肌钙蛋白C2和肌钙蛋白T3在宰后成熟0~4 d时表达量上调,说明在此阶段肌钙蛋白活性较高,肌动蛋白和肌动球蛋白的相互作用被调节,使肌原纤维收缩增强,此时水分由于肌原纤维收缩被挤出,肌肉表面呈现多汁状态,风味物质在此阶段也会随着汁液的浸出而流出。肌球蛋白轻链是肌动球蛋白复合物的组成部分,在肌肉的结构保持和肌肉收缩过程中起重要的作用。宰后滩羊肉成熟0~4 d时,肌球蛋白轻链1、肌球蛋白轻链2和肌球蛋白轻链6的表达量上调,说明肌原纤维蛋白在宰后成熟4 d时已逐渐发生降解,这是内源酶的作用使肌动球蛋白横桥发生断裂所致[25]。Marino等[21]研究了3 种不同品种牛肉成熟过程中肉质形状和肌浆蛋白的变化,发现成熟过程中肌球蛋白轻链、肌钙蛋白T和原肌球蛋白的含量增加,说明肌纤维降解和蛋白水解随成熟进行逐渐加剧。宰后滩羊肉成熟4~8 d时肌球蛋白轻链1、肌球蛋白轻链2和原肌球蛋白3表达量下调,说明此阶段肌原纤维蛋白降解较明显,结构蛋白在保护细胞完整性中起到较重要的作用。宰后肌原纤维蛋白表达量的变化说明成熟对肌肉结构完整性和收缩能力的影响较大,肌原纤维蛋白水解可使蛋白质降解为呈味氨基酸和肽类。综上,肌原纤维蛋白不仅能降解产生风味前体物质,还能通过风味前体物质之间的相互作用影响风味的感知,提升肉的风味水平。
另外,蛋白质如伴肌动蛋白和肌钙蛋白T的降解会破坏肌原纤维的完整性,但同时也会产生味觉氨基酸和肽类[26]。随着成熟的进行,宰后滩羊肉成熟4~8 d时肌钙蛋白C1、肌钙蛋白T3、肌球蛋白轻链1、肌球蛋白轻链2和原肌球蛋白3等蛋白表达量均下降,说明肌原纤维蛋白降解程度较明显。Kemp等[27]发现宰后成熟肉中组织蛋白酶水解数量最多的肌原纤维蛋白主要包括肌钙蛋白T、肌钙蛋白I、肌钙蛋白C、伴肌动蛋白、肌联蛋白和原肌球蛋白。宰后肌肉中的肌原纤维蛋白是肉中味觉活性成分的丰富来源,有研究发现肌原纤维蛋白能够提供8 133 种味觉氨基酸[28]。在肌原纤维蛋白中,味觉活性氨基酸和肽中含量较高的是肌钙蛋白C(骨骼肌),有助于感知所有5 种基本味觉[26]。宰后滩羊肉成熟4~8 d时肌钙蛋白C1和肌钙蛋白T3的降解使肉中的味觉活性氨基酸和呈味肽含量增加,此阶段滩羊肉中滋味属性特点较明显,味感丰富。此外,卢昊[3]的研究表明延边牛宰后肌钙蛋白降解程度与肉的嫩度有关。综上,宰后滩羊肉成熟4~8 d时,肌原纤维蛋白降解产生风味物质,使呈味物质较丰富,同时由于此阶段肌原纤维结构的完整性被破坏使风味前体物质更好地释放。
应激蛋白可防止肌细胞凋亡引起的蛋白质结构损伤和降解,并保护肌动蛋白和其他细胞骨架蛋白免受应激作用所引起的肽链断裂[29]。热休克蛋白70是ATP依赖性伴侣蛋白,它可以使部分变性蛋白聚集以及使蛋白折叠,从而保护细胞氧化应激[30]。热休克蛋白70可以直接参与代谢,本研究发现宰后滩羊肉成熟0~4 d时,应激蛋白中热休克蛋白70表达量上调,而成熟4~8 d时,热休克蛋白70表达量下调。滩羊肉成熟过程中,热休克蛋白70表达量的升高,说明成熟0~4 d时热休克蛋白70可能参与保护肌原纤维结构完整性的作用,而成熟4~8 d时热休克蛋白70表达量的下降说明此阶段开始降解,这也体现出肌原纤维蛋白稳定性的降解变化动态。另外,Bjarnado等[31]研究发现热休克蛋白70的表达量与嫩度有直接关系。综上,宰后滩羊肉成熟0~4 d时应激蛋白的变化保护细胞骨架蛋白的完整性,使肌原纤原纤维结构在此阶段相对稳定,这也与结构蛋白的变化结果相吻合。
2.3 差异表达蛋白基因表达分析结果
2.3.1 差异表达蛋白基因相对表达量的变化
筛选与关键风味代谢物调控作用相关的差异表达蛋白,结合前期对滩羊肉风味形成中重要蛋白质研究的基础[13],选取包含代谢酶、结构蛋白和应激蛋白在内的共8 个差异表达蛋白,分别为糖原磷酸化酶、6-磷酸葡萄糖异构酶、L-乳酸脱氢酶、丙酮酸激酶、磷酸丙糖异构酶、肌球蛋白轻链2、肌动蛋白α1和热休克蛋白70。采用qPCR对以上筛选出的差异表达蛋白在mRNA水平上进行转录水平验证,研究不同成熟期滩羊肉差异表达蛋白在mRNA转录水平的变化,分析各蛋白质基因相对表达量及其变化规律。
采用qPCR检测宰后滩羊肉成熟过程中8 种目标差异表达蛋白在mRNA转录水平上的变化,如图4所示,宰后成熟0~4 d时,6-磷酸葡萄糖异构酶、L-乳酸脱氢酶、磷酸丙糖异构酶、肌球蛋白轻链2和热休克蛋白70在mRNA转录水平上呈上调趋势,而糖原磷酸化酶、丙酮酸激酶和肌动蛋白α1在mRNA转录水平上呈下调趋势。而宰后成熟4~8 d时,糖原磷酸化酶、6-磷酸葡萄糖异构酶、肌动蛋白α1和热休克蛋白70在mRNA转录水平上呈上调趋势,而L-乳酸脱氢酶、丙酮酸激酶、磷酸丙糖异构酶和肌球蛋白轻链2呈下调趋势。对比整个成熟过程,各目标差异表达蛋白mRNA转录水平不同,L-乳酸脱氢酶在成熟0~4 d时上调较明显,而丙酮酸激酶、磷酸丙糖异构酶和肌球蛋白轻链2在成熟8 d时下调较明显,且几乎接近零,这说明滩羊肉随着成熟的进行,差异表达蛋白的mRNA丰度在不同成熟阶段不同。
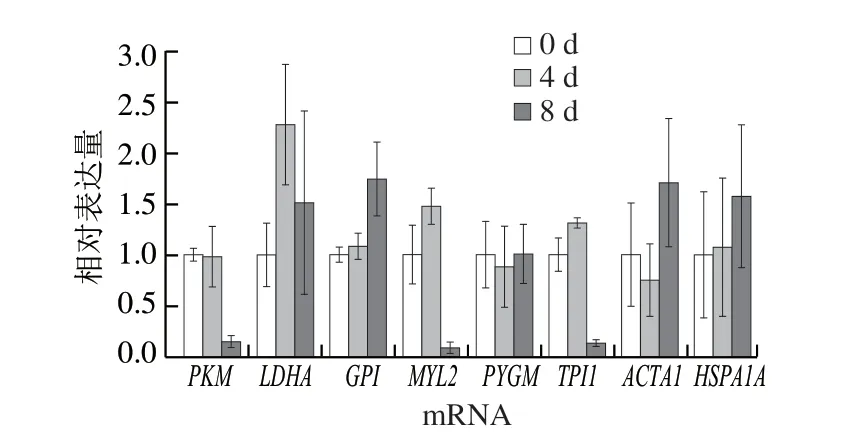
图4 目标差异表达蛋白基因转录的qPCR分析Fig. 4 qPCR analysis of the mRNA expression levels of target differentially expressed proteins
2.3.2 差异表达蛋白在蛋白水平和mRNA转录水平的比较
为了进一步分析宰后成熟过程中滩羊肉中蛋白质的变化机理,在不同成熟期分别对比与风味相关差异表达蛋白的iTRAQ和qPCR结果,探讨风味相关差异表达蛋白在蛋白水平和mRNA转录水平的变化情况,结果如表3所示。

表3 风味相关差异表达蛋白的iTRAQ和qPCR结果比较Table3 Comparison of results from iTRAQ and qPCR for flavorrelated differentially expressed proteins
差异表达蛋白在转录和翻译后修饰作用的调节下导致表达水平不同,从生物学角度分析,mRNA转录水平反映了基因表达的中间状态,同时也反映了潜在的蛋白水平表达情况[32]。qPCR因检测灵敏度高、检测范围广、检测结果重复性好的特点而被广泛应用。差异表达蛋白基因相对表达量的分析是针对蛋白质组学分析的补充,在获得基因表达情况的同时,也可以得知两者之间的联系,差异表达蛋白在蛋白水平和mRNA转录水平的研究相互补充和验证,可为宰后滩羊肉中生物代谢变化和调控机制提供新的思路。
由表3可知,滩羊肉成熟过程中差异表达蛋白中有4 个差异表达蛋白在0~4 d和4~8 d时蛋白水平和mRNA转录水平的表达模式一致,分别为2 个代谢酶(L-乳酸脱氢酶和磷酸丙糖异构酶)和2 个结构蛋白(肌球蛋白轻链2和肌动蛋白α1),其余差异表达蛋白在两种水平表达模式不一致,可能是由于宰后成熟过程滩羊肉中蛋白质的降解不但来自自身内源酶的作用,还可能受到外界酶的影响,从而改变了转录效率或转录后降解的速率[3],在外界酶的调控下抑制或促进了相关蛋白质的翻译,从而使两种表达水平结果不一致。另外,本研究中差异表达蛋白如6-磷酸葡萄糖异构酶和热休克蛋白70在4~8 d时mRNA转录水平上呈现上调趋势,而在蛋白水平上呈现下调趋势,这可能是由于翻译后修饰或在激活因子的作用下,这两种蛋白质的活性状态发生改变或失活,导致mRNA转录水平上调而蛋白水平下降。
3 结 论
本实验采用iTRAQ技术对宰后滩羊肉不同成熟期的蛋白质组学进行分析,与风味相关的差异表达蛋白主要分为代谢酶类、结构蛋白和应激蛋白。滩羊肉不同成熟期差异表达蛋白存在不同程度的变化,滩羊肉中酶的活性在宰后成熟前期被激活且在风味前体物质变化中期发挥主要调控作用,结构蛋白在宰后成熟后期降解较明显,而应激蛋白在成熟前期肌原纤维结构的稳定性中起保护作用,随着成熟的进行逐渐降解或部分失活。采用qPCR对滩羊不同成熟期背最长肌的蛋白质组学分析进行了后续补充分析,使宰后成熟过程中滩羊肉中差异蛋白表达情况在mRNA转录水平上得到了有效验证。

