2020年血清中总胆红素测定比对试验结果分析
于 婷,张娟丽,孙 晶,曲守方△,黄 杰
1.中国食品药品检定研究院,北京 100050;2.河南省医疗器械检验所,河南郑州 450003
血清总胆红素(TBIL)是人体衰老红细胞遭到破坏后产生血红蛋白进而衍化生成,是诊断新生儿高胆红素血症[1-3]及肝胆疾病等的重要指标[4-6]。测定方法包括参考方法(Doumas法)[7]及常规方法如重氮法、化学氧化法/钒酸盐氧化法和氧化酶法[8-10]等。YY/T 1205-2013 总胆红素测定试剂盒(钒酸盐氧化法)[11]行业标准也已发布多年。基于注册检验、监督抽验等任务基础,国内大部分医疗器械检验机构开展了总胆红素检测项目。为考察检测机构总胆红素的检测能力,保证结果的准确性和公正性,同时促进实验室间的技术交流,2020年中国食品药品检定研究院(下称本院)在全国范围内组织开展TBIL测定比对试验。
1 材料与方法
1.1材料 本次试验于2020年11-12月发放3份比对试验用样本,其中1份为比对样本,2份为干扰样本。收集外观透明、澄清,无明显黄疸、溶血和脂血的血清,且传染病4项(乙肝病毒表面抗原、丙肝病毒抗体、人类免疫缺陷病毒抗体和梅毒螺旋体抗体)均为阴性。对收集到符合要求的血清样本依次进行普通滤纸初滤、0.45 μm、0.22 μm滤膜过滤。过滤好的血清按照0.5 mL分装,-70 ℃或以下条件下保存。
1.2方法

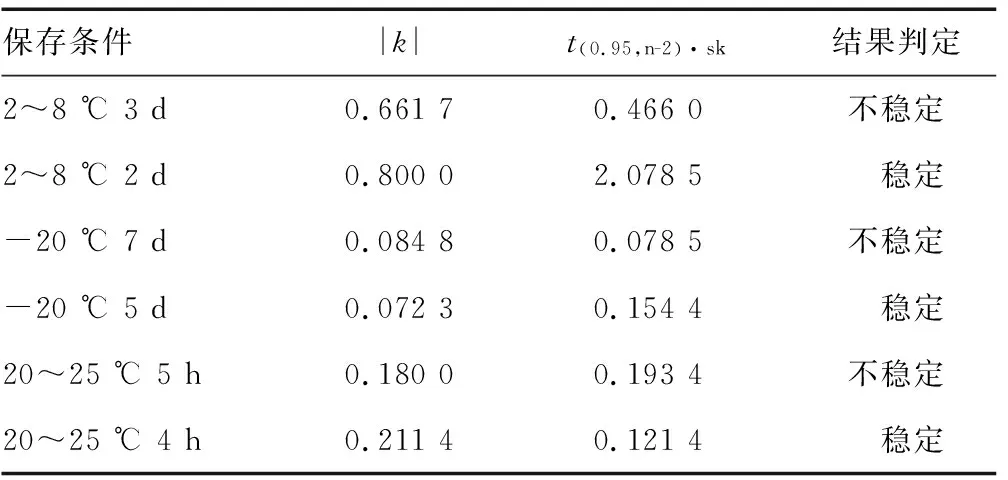
1.2.2比对样本的均匀性和稳定性分析 采用参考方法按照CNAS-GL003:2018《能力验证样品均匀性和稳定性评价指南》[12]进行均匀性、稳定性评价。在样本分装的前期、中期和末期分别抽取15支、20支和15支,采用全自动生化分析仪对抽取样本进行测定,每份样本测定3次。利用单因素方差法进行分析,当F值小于自由度为(f1,f2)及显著性水平(α=0.05)所对应的临界值Fα(f1,f2),表明样本之间差异无统计学意义。
在第1、2、3、5、7、12、20、30天这8个时间点上均随机取出6支样本,分别置于20~25 ℃、2~8 ℃、-20 ℃条件下各2支。在第31天将所有样本取出统一测定。所有取样时间保持一致。采用全自动生化分析仪对样本进行测定。每个样本测定3次,取均值。以时间为横坐标,测定值为纵坐标作图,进行线性拟合回归分析,评价样本测定值的趋势性变化,并计算斜率k、截距b和斜率k的标准差sk。在自由度为n-2,置信水平P=0.95(95%的显著水平)条件下,查t-分布临界值表,得到对应的t(0.95,n-2)值,计算t(0.95,n-2)·sk的值,比较|k|与t(0.95,n-2)·sk的值,如果|k| 1.3比对试验要求 本次比对试验,要求已有TBIL检测能力认可资质的医疗器械检测机构必须参加,其他实验室自愿报名参加。参加实验室应合理选择具有注册证的TBIL测定试剂盒及检测仪器,按照作业指导书进行检测并报告结果,要求每份样本应重复测定不少于5次,计算测定均值(保留2位小数)及变异系数(保留1位小数)。作业指导书中要求:实验前取出的样本应避光恢复至室温20~25 ℃,充分混合后检测,且务必在4 h内使用,整个操作过程中亦应注意避光。 1.4试验结果判定原则 根据定值结果及参考YY/T 1205-2013 TBIL测定试剂盒(钒酸盐氧化法)中“3.7.1批内精密度”项“批内精密度应不大于5.0%”的要求,确定2条判定的基本原则:(1)比对样本测定值应在(27.10±2.71)μmol/L范围内;(2)3份样本检测结果的批内精密度应不大于5.0%。参加实验室的检测结果必须同时满足:比对样本应满足(1)和(2)判定原则,且干扰样本满足判定原则(2),方可判定为满意,否则即判定为不满意。 2.1比对样本均匀性、稳定性及定值结果 采用单因素方差分析方法对数据进行分析,比对样本F值为1.234 1,小于F0.05(1.355 2),说明均匀性良好。结果见表1。 表1 比对样本均匀性检验结果 对比对样本进行3种温度条件下的30 d短期稳定性评价,由表2结果可知,样本在3种温度条件下放置30 d均不稳定,减少时间点数重新进行统计学分析,结果表明,在20~25 ℃条件下,只在当天稳定;在2~8 ℃条件下,可稳定2 d;-20 ℃条件下,可以稳定5 d。同时对室温20~25 ℃ 24 h内的避光稳定性进行了研究,结果显示20~25 ℃ 4 h内稳定。见表2、3。 表2 比对样本稳定性检测结果(μmol/L) 3家实验室联合定值,得到4组独立数据,分别为(26.93、27.14、27.33、26.99 μmol/L),比对样本定值结果的实验室内变异系数不高于0.6%,表明各实验室建立的参考方法重复性好,数据可靠。最终以联合定值的均值,作为比对样本靶值,结果为27.10 μmol/L。 2.2比对试验结果 本次共有40家实验室报名参加本次比对试验,来自全国23个省(自治区)、直辖市,包括各地医疗器械检验所/食品药品检验机构和大学/企业实验室。其中检验机构30家,大学/企业实验室10家。最终,共有39家按要求提交了结果报告。根据评价原则,34家实验室的比对样本血清TBIL测定值满足要求,35家实验室3份样本测定结果的CV满足要求,最终获得结果满意的实验室为31家,满意率为77.25%,结果不满意的实验室为9家(含未上报数据的实验室),不满意率为22.75%。见表4。 表3 比对样本稳定性分析结果 表4 2020年血清中TBIL测定比对试验数据汇总表 本次比对试验选择的是TBIL项目,由于胆红素并不稳定,容易见光分解,因此本院对其稳定性进行了较为充分的研究。除了通过30 d的短期稳定性了解其在3种不同温度下的稳定时间外,还开展了长期稳定性(-70 ℃或以下)的定期监测,以及在分发样本前,再次进行了-20 ℃ 5 d的监测,结果均满意。在样本正式发放时,选择专业冷链公司采用干冰运输,并对整个运输过程中的温度进行监控,以及确保5 d内到达参加实验室,实际2~3 d即可到达。本院在作业指导书中亦明确告知参加实验室,收到样本确认完好且温度至少在-20 ℃以下后,应尽快置于-70 ℃或以下保存,开封后应注意避光,并在4 h内完成检测。以上措施均保证了本次比对试验不会因样本的问题影响各参加实验室的结果,达到真正评价的是参加实验室的检测能力。 对于本次产生不满意的结果,分析主要可能有以下方面:(1)不严格按照说明书要求进行试验。有两类情况比较突出,一是说明书要求使用配套的校准品或者推荐采用某厂家校准品,实际采用了其他厂家的校准品;二是说明书中给出了试剂及样本的加样量,部分说明书提到试剂和样本用量可根据不同仪器要求按比例改变。然而,部分参加实验室未按照要求加样,或者不按比例减少加样量。比如“样本/R1/R2”的加样量,要求8 μL/240 μL/60 μL,实际为8 μL/200 μL/50 μL,虽试剂加样量是等比例减少,但样本量并未等比例减少。实验室必须清楚意识到,说明书是厂家通过多次研究确定的操作程序,应严格按照要求进行操作,不应随意调整,如要改变,必须作性能确认,否则可能存在一定风险;(2)对于试验结果不敏感。本次有4家实验室,均出现低值样本检测结果CV值超出5.00%,其中一家达到7.50%,5次测值结果在6.6~8.1 μmol/L内,最小值和最大值之间的偏差为22.70%。这种结果并不正常。目前全自动生化分析仪无论是国产还是进口,重复性性能理想,一般不会发生这种情况。当波动很大时,仪器检测过程中可能处于一种并不稳定的状态,因此必须要有一定的敏感性,及时发现存在的问题,并尽量找到原因;(3)未能合理选择试剂盒。有4家实验室采用了同一家进口试剂盒,3家比对样本的结果不满意,测值均偏高,1家虽判为满意,但也是接近靶值的上限,这些数据表明,该试剂盒的准确度可能存在一定的问题。 稳定可靠的检测能力是产品质量检验的基础和前提,而比对试验的结果是检验检测系统质量保证能力和检验水平的客观体现,通过获得满意结果,体现了其检验检测结果的可靠性。如何在比对试验中获得满意的结果,参加实验室尤其是检测机构,要转换思路,应从试剂盒的性能评价转到如何选择合适的比对试剂上来,从考官的位置转到考生的位置上来。笔者认为有以下几点值得借鉴:(1)必须建立检测系统是一个整体的概念。完整的检测系统包括检测仪器、配套试剂与校准品、操作程序的固定组合,而不是各部分的性能,所以应严格按照说明书要求,选择检验适用仪器、配套试剂与校准品等,不能随意更换某一组分,才能确保检测结果符合厂家的性能指标,如有更改,必须进行性能确认。目前,我国生化试剂盒依然存在与进口校准品配合使用的现象,尤其是一些小企业。这种将自己的产品定值准确性完全依赖进口校准品,如若出现问题,无法从源头上分析原因,风险较大;(2)无论选择进口或国产试剂,在开展正式实验前,应在操作过程无误以及确认仪器状态良好的情况下,采用TBIL国家或国际标准品进行准确度的确认[13-14],如果所选试剂盒测值结果超过所允许的偏差,那么应该选择其他合适的试剂盒,而不能凭经验认为进口试剂质量一定优于国产试剂。本次实验结果也证明了这一点;(3)试验过程中应细致严谨,当发现结果的不稳定状态时,应及时探寻原因,可从仪器及人员方面进行探查,包括:参数设置和光源是否正确;比色杯和吸样针是否洁净;实验用水是否被污染;反应温度是否正常;仪器是否定期校准;外部环境是否没有干扰;实验人员操作是否熟练等。如不能找到原因,也应更换仪器进行复测,并在复测前,采用其他样本进行预实验,确保仪器处于稳定的状态。 本次比对试验总体满意率为77.25%,结果较满意。参加比对试验的实验室主要为试剂盒质量评价的检验检测机构,这些实验室在试剂盒的注册检验、上市后监督抽验等方面发挥重要技术支撑作用。9家不满意实验室中,除2家为某评价中心外,有5家为省或直辖市的检测机构和2家试剂生产企业,提示这些机构今后要特别注意加强检验检测能力的提升,也进一步说明了参加比对试验是实验室检测结果质量保证的重要手段,有助于实验室评价和证明其检测数据的可靠性,及时发现和纠正自身存在的问题。各实验室应积极参加比对试验,提升技术能力和实验室管理水平。本次比对试验为进一步加强对检测机构、相关企业的监督管理、规范检测市场提供了依据。2 结 果



3 讨 论

