紫草素对HaCat细胞增殖和AnxA2表达水平的影响
胡炜昊,阿依恒·曲库尔汗
(新疆医科大学第一附属医院耳鼻喉科,乌鲁木齐 830054)
中耳胆脂瘤是耳鼻喉科的一种常见疾病,其上皮细胞增生活跃,具有类似肿瘤细胞过度增殖的特性,包括细胞增殖、迁移、分化和侵袭[1]。中耳胆脂瘤形成的各种学说都与角质形成细胞有着密切的关系,角质形成细胞增殖是造成中耳胆脂瘤扩大和诱导骨质破坏的主要原因,涉及多种细胞因子和分子作用通路[2-4]。其中膜联蛋白A2(AnxA2)在胆脂瘤的角质形成细胞核中表达,且AnxA2 在角质形成细胞的过度增殖中可能发挥了重要生理作用[5],提示AnxA2 可能是中耳胆脂瘤发病过程中侵袭和转移调节的关键组分。
紫草是我国一种常用的传统中药,属于紫草科紫草属,在我国多个地区都有分布,尤其以新疆紫草或内蒙古紫草较为多见。目前研究发现紫草中含有多种重要的生物活性成分,紫草素就是其中一种具有特殊功效的生物活性成分,其作为从紫草中提取出的一种萘醌类化合物,对其药理作用及临床应用的研究近年来逐渐深入[6]。紫草素的药理作用极为广泛,包括抗炎[7]、抗肿瘤[8]、抗病毒[9]、抗氧化损伤[10]等重要作用。
本实验通过用不同浓度(0、1、5、10 µmol/mL)的紫草素干预正常生长的HaCat细胞,观察研究紫草素对HaCat 细胞生长状态、细胞迁移、细胞周期以及细胞增殖的影响,并采用实时聚合酶链反应(RT-qP⁃CR)技术和蛋白质免疫印迹(Western-blot)技术分别研究不同浓度紫草素干预对HaCat 细胞中AnxA2 的mRNA 和蛋白表达的影响,探讨紫草素对中耳胆脂瘤上皮细胞增殖的潜在抑制作用,为紫草素治疗中耳胆脂瘤的相关分子机制奠定实验和理论基础。
1 材料与方法
1.1 细胞来源人永生化角质细胞株(HaCat 细胞)购于中国科学院典型培养物保藏委员会昆明细胞库(编号:KCB200442YJ)。
1.2 主要试剂与仪器紫草素、总蛋白提取试剂盒均购自上海索莱宝生物科技有限公司;DMEM高糖培养基、磷酸盐缓冲液PBS均购自武汉普诺赛生命科技有限公司;南美胎牛血清FBS、胰酶均购自美国Gibco公司;双抗购自美国Hyclone 公司;二甲基亚砜(DMSO)购自德国Biofroxx 公司;逆转录试剂盒购自美国赛默飞公司;实时荧光定量PCR 试剂盒购自日本TAKA⁃LA 公司;兔抗人单克隆抗体AnxA2、山羊抗兔IgG 抗体均购自北京博奥森公司;RT-PCR 所用的引物由上海生工生物工程股份有限公司合成。CO2培养箱(HERA cell 240)、酶标仪、荧光定量PCR 仪(美国赛默飞公司),倒置荧光显微镜(IX71)(中国奥林巴斯公司),低速离心机(TDL-5A)(上海安亭科学仪器厂),低温冷冻型离心机(Centrifuge 5415 R)(德国艾本德公司),电泳仪(上海索莱宝生物科技有限公司),蛋白凝胶成像分析系统(美国伯乐公司)。
1.3 方法
1.3.1 紫草素浓度配制 将紫草素用DMSO(浓度<0.1%)溶解,配置成母液浓度为10 µmol/mL 的溶液,于-80℃分装保存,临用时用完全培养基稀释到所需浓度(1、5、10 µmol/mL)供后续实验使用。
1.3.2 细胞培养与分组 将HaCat 细胞株培养于含10%胎牛血清和5%双抗的DMEM 高葡萄糖培养基中,置于37℃、含5%CO2的恒温培养箱中孵育培养。待细胞贴壁后更换细胞培养基,当HaCat细胞贴满壁或细胞数量占80%以上,则可进行细胞传代。每2~3天传代1次,取生长状态良好且处于对数生长期的细胞进行实验,待HaCat 细胞贴壁后分别加入1、5、10 µmol/mL 浓度的紫草素溶液,并将不加紫草素组(0 µmol/mL)设为正常对照组。将分好组的细胞置于37℃、含5%CO2的恒温培养箱中培养,供后续实验使用。
1.3.3 镜下观察细胞生长状态 将处理好的各组细胞置于培养箱中继续孵育培养24 h,期间每隔6 h 移置显微镜下观察每组细胞的大小、形态变化、贴壁情况以及细胞密度等,观察的同时拍摄照片。
1.3.4 划痕试验检测细胞迁移 先用marker 笔标记6孔板,用0.25%胰酶消化收集各组细胞,分别制备细胞悬液。进行细胞计数后,铺6 孔板,密度使其控制在次日能长满。用10 µL 枪头做划痕,划痕方向与marker 笔标记线垂直。分别向各组加入2 mL 无菌PBS 轻轻冲洗培养板,重复3 次。细胞换液,加入无血清的培养基,CO2培养箱中孵育24 h 后于显微镜下进行拍照,观察各组细胞迁移情况。
1.3.5 流式细胞术检测细胞周期 细胞培养24 h 后,用0.25%的胰酶消化收集各组细胞,分别制备细胞悬液,1 500 r/min,离心5 min,吸弃上清,各加1 mL 无菌PBS 重悬细胞沉淀,重复两次。分别加入2 mL 预冷的70% 浓度的酒精,置于-20℃冰箱固定过夜。1 500 r/min,离心5 min。各加1 mL无菌PBS,1 500 r/min,离心5 min,各加500 µL 的无菌PBS 重悬细胞。加入RNA 酶,37℃、5% CO2培养箱孵育30 min,1 500 r/min,离心5 min,各加500 µL 的无菌PBS、重悬细胞。加入染色剂碘化丙啶(PI)(工作浓度50 µg/mL)进行染色,避光操作,室温孵育30 min,细胞过筛,流式细胞仪检测各组细胞的细胞周期。
1.3.6 CCK-8 法检测细胞增殖 在显微镜镜下对培养的HaCat 细胞进行细胞计数,镜下观察约2×106个/mL,将细胞接种到96 孔板上,每个孔的细胞约6×103个,于37℃、5%CO2培养箱中孵育过夜。待细胞贴壁后移除培养基,每孔加200 µL 含不同浓度(1、5、10µmol/mL)紫草素的完全培养基,设0 µmol/mL 为正常对照组,每孔设4个复孔。置CO2培养箱中培养24 h。每孔加20 µL 的水溶性四唑盐(CCK-8 试剂),于CO2培养箱孵育1 h,置于酶标仪中,记录450 nm 波长的吸光度。试验重复3次取平均值。
1.3.7 RT-qPCR 检测AnxA2 基因mRNA 的表达 分别提取各组细胞的总RNA,测定RNA 的纯度和浓度,并将RNA 逆转录成cDNA。从GeneCards中获得AnxA2 的mRNA 序列,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参设计引物,详见表1。

表1 RT-qPCR引物
逆转录反应条件为:25℃,5 min;42℃,60 min;70℃,5 min;4℃终止反应。根据TAKALA 公司试剂盒说明书将获得的cDNA 模板配好反应体系,然后在荧光定量PCR 反应仪进行PCR 扩增,反应条件为:95℃,30 s(预变性,1 个循环);95℃,5 s 和60℃,30 s(PCR 反应,40 个循环)。相对定量方法用2-△△Ct法,结果用GraphPad Prism 8.0软件进行图形分析。
1.3.8 Western-blot 检测AnxA2 蛋白的表达 分别提取各组细胞的总蛋白,用蛋白质定量试剂盒(BCA法)测定蛋白的浓度进行蛋白定量,于100℃煮沸10 min,变性,冷却。上样20 µg 蛋白样品,进行10% 十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,转移到聚偏二氟乙烯膜(PVDF 膜)上,用含5% 脱脂奶粉的磷酸盐缓冲液(PBST)封闭1 h,TBST 洗膜3次,分别加入对应I 抗于4℃摇床孵育过夜。次日用等渗盐缓冲溶液(TBST)洗膜3 次,加入对应Ⅱ抗,室温摇床孵育2 h,TBST 洗膜3 次。用蛋白成像系统采集图像。
1.4 统计学分析实验数据采用SPSS16.0 软件进行单因素方差分析,实验结果采用±s表示,组间比较采用LSD法,P<0.05为差异有统计学意义。统计制图采用GraphPad Prism 8.0 软件进行绘制。
2 结果
2.1 紫草素对HaCat细胞生长状态的影响倒置显微镜下观察,镜下可见对照组的HaCat细胞呈贴壁生长,排列紧密,细胞轮廓清楚可见,呈多角形伸展。而加入紫草素干预后,HaCat 细胞失去原有的细胞形态,出现细胞皱缩、变圆或呈不规则形状,细胞间的接触变松,增殖减慢,细胞贴壁性降低,部分细胞裂解成细胞碎片或脱落呈漂浮状态。结果表明,与对照组相比,用1、5、10 µmol/mL 浓度的紫草素干预Ha⁃Cat细胞后,随着紫草素浓度的增加,贴壁生长的细胞密度越低,见图1。
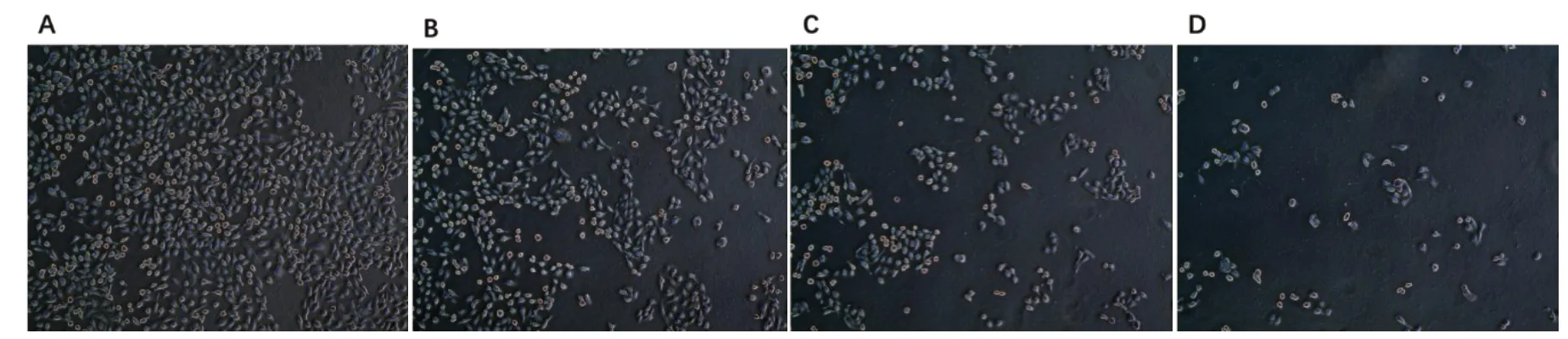
图1 不同浓度紫草素处理24 h的HaCat细胞生长状态
2.2 紫草素对HaCat细胞迁移的影响划痕实验结果发现,各组HaCat 细胞培养24 h 后,正常对照组细胞几乎长满培养板,而1、5、10 µmol/mL 组细胞随紫草素浓度的增加划痕越来越宽,表明细胞迁移的速率随紫草素浓度的增加而降低。见图2。

图2 紫草素对HaCat细胞迁移的影响
2.3 紫草素对HaCat细胞周期的影响流式细胞仪分析检测培养24 h后的各组HaCat细胞的细胞周期,结果显示与对照组相比,随着紫草素浓度的增加,处于G1期HaCat细胞的比例呈剂量依赖性升高,处于S期细胞的比例呈剂量依赖性降低,差异具有统计学意义(P<0.05)。表明紫草素能够阻滞HaCat 细胞的生长,使细胞阻滞在G1期,见图3。
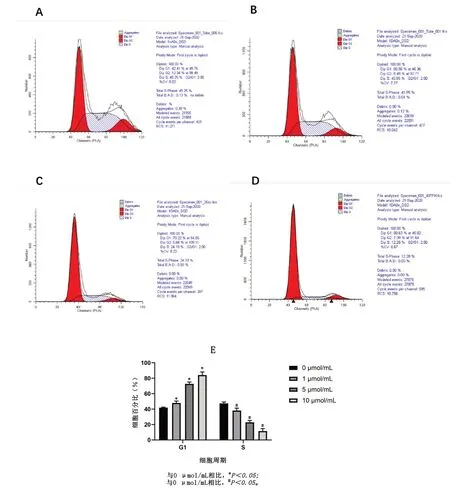
图3 紫草素对HaCat细胞周期的影响(n=3)
2.4 紫草素对HaCat 细胞增殖的影响用CCK-8法检测不同浓度的紫草素对HaCat细胞增殖的影响,将所测得450 nm 处的吸光度数据用±s表示,结果显示5 µmol/mL 组和10 µmol/mL 组与对照组相比,差异有统计学意义(P<0.05),而1 µmol/mL 组与对照组相比,差异无统计学意义(P>0.05),见表2。

表2 CCK-8法检测不同浓度紫草素干预下HaCat细胞在450 nm波长的吸光度
2.5 紫草素对HaCat 细胞AnxA2 mRNA 表达的影响RT-qPCR 研究结果表明,与对照组相比,随着紫草素浓度的增加,AnxA2的mRNA 表达呈剂量依赖性的降低(P<0.05),除1 µmol/mL 组和5 µmol/mL 组差异无统计学意义外,其余各组的组间差异均有统计学意义(均P<0.05),见表3。
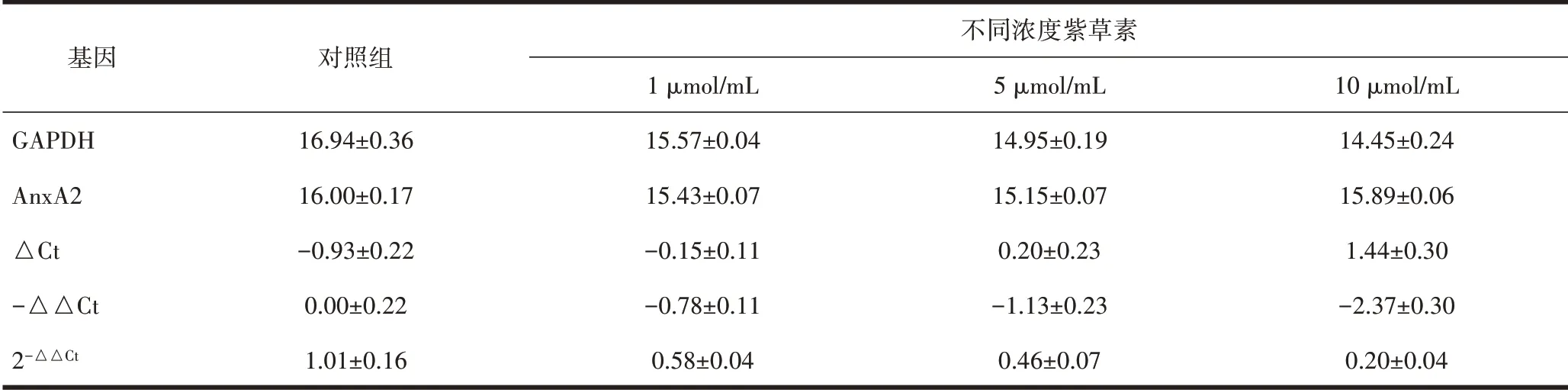
表3 RT-qPCR检测不同浓度紫草素干预下HaCat细胞AnxA2的mRNA表达
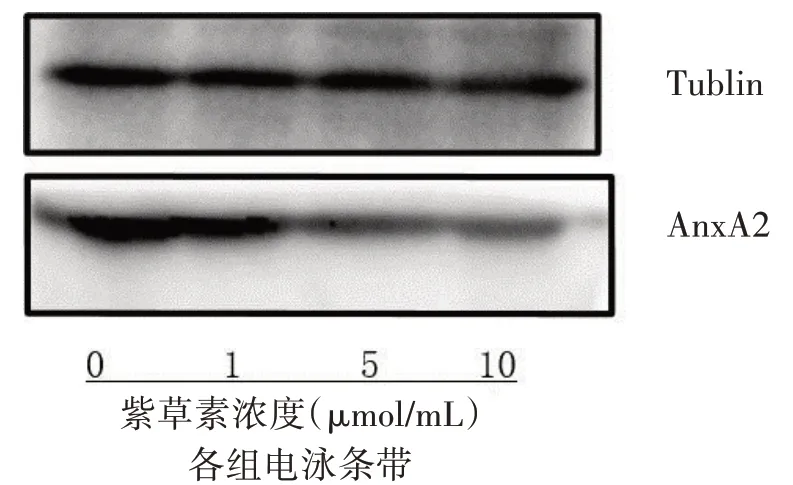
图4 紫草素对HaCat细胞AnxA2蛋白表达的影响
3 讨论
中耳胆脂瘤上皮细胞具有高度的增殖活性,可侵蚀听小骨和颞骨并破坏内部结构,导致听力丧失、面瘫甚至脑脓肿等更致命的颅内外并发症[11],其危害性不容小视。目前尚无有效的药物治疗,主要依靠手术方式去除病灶、改善听力和防治并发症[12]。近年来,有学者对胆脂瘤的发病机制进行了大量的研究,主要集中在上皮细胞过度增殖、炎症介质和骨质破坏吸收等方面,但其发病机制至今尚未完全明确[13-15]。紫草素是从紫草中提取的一种萘醌类化合物,多项研究表明紫草素及其衍生物具有较强的抑制细胞增殖和诱导细胞凋亡的作用,且作用机制呈现多靶点、多途径的特点[16-19]。
膜联蛋白A2是一种依赖钙离子介导的磷脂结合特性的蛋白质,其在调节细胞生长和信号转导途径中起重要作用,包括胞吞和胞吐、囊泡运输、细胞增殖和凋亡、细胞信号传导和离子通道的形成等[20]。在中耳胆脂瘤中,膜联蛋白A2 在胆脂瘤的基底层和棘层中的细胞质膜和角质形成细胞核中表达。有研究表明,在人胆脂瘤的发展过程中,膜联蛋白A2在角质形成细胞过度增殖中的可能发挥了生理作用[5]。也有研究表明,与正常对照组相比,胆脂瘤中AnxA2 和表皮生长因子受体(EGFR)mRNA 的表达明显升高,且AnxA2 和EGFR 的蛋白表达显著增强[21],提示AnxA2 可能是中耳胆脂瘤发病过程中侵袭和转移调节的关键组分。
本研究结果显示,通过用不同浓度的紫草素对HaCat 细胞进行干预,发现紫草素可以影响HaCat 细胞的生长状态、阻滞细胞周期、降低细胞迁移速率以及抑制细胞增殖,且随着紫草素浓度的增加,细胞密度越低,处于G1 期的细胞比例越高,处于S 期的比例越低,细胞的迁移速率越低,而且紫草素可呈剂量依赖性地抑制HaCat 细胞的增殖。随着紫草素浓度的升高,HaCat 细胞AnxA2 的mRNA 表达呈剂量依赖性降低,且AnxA2 蛋白表达量也逐渐降低,提示紫草素对HaCat 细胞增殖的抑制作用可能与下调AnxA2 的表达有关。
角质形成细胞的增殖以及在胆脂瘤角质形成细胞核中表达的AnxA2 在中耳胆脂瘤的发生发展过程中发挥着重要作用。本实验通过研究紫草素对Ha⁃Cat 细胞和AnxA2 表达水平的影响,探讨紫草素对中耳胆脂瘤上皮细胞增殖的潜在抑制作用及相关靶标。但本实验仅就紫草素对正常的HaCat 细胞进行相关研究,对于AnxA2 诱导后高增殖状态的HaCat 细胞是否有类似作用,有待进一步证实。
基于目前紫草素在胆脂瘤方面的研究,目前还没有充足的实验结果证明药物治疗可以完全取代手术治疗,所以紫草素的应用可考虑作为手术治疗中耳胆脂瘤的一种辅助疗法。建议手术后局部应用紫草素制剂,甚至作为生物可吸收凝胶,可能会显著减少胆脂瘤的复发。但中耳胆脂瘤作为一种耳部疾病,紫草素制剂是否具有耳毒性也是需要慎重考虑的问题。基于目前的研究和设想,紫草素在治疗中耳胆脂瘤方面可能具有潜在的开发利用价值和广阔的应用前景。

