酿酒酵母中BAT2基因敲除对桑葚酒中高级醇的影响
徐佳,黄雪芹,杨建飞,易媛,马倩,胡琨,左勇,*
1(四川轻化工大学 生物工程学院,四川 宜宾,644000) 2(四川师范大学 生命科学学院,四川 成都,610000)
桑葚酒是一种以桑葚汁为原料经酵母发酵而成的果酒[1],含有丰富的花青素,具有补血、明目等功效[2],已成为继葡萄酒之后的第二大类果酒[3]。高级醇作为果酒风味物质的骨架成分,在桑葚酒中不仅能够起到呈香呈味的作用,还是构成酯类的前体物质,但含量过高,则会导致酒中产生异杂味,饮后还会造成口渴、头痛等现象[4]。果酒中高级醇含量超过400 mg/L时,会明显加重酒中的辛辣刺激感[5],而目前我国市售的桑葚酒中,高级醇含量大都在400 mg/L以上[6],因此严格控制桑葚酒中的高级醇含量对提高桑葚酒品质具有重要意义。
高级醇作为桑葚酒酿造过程中酿酒酵母产生的次级代谢产物,其中含量最高的是异丁醇和异戊醇,主要由:支链氨基酸分解途径(Ehrlich途径)[7]和糖代谢合成途径(Harrsi途径)[8]产生。果酒中有25%的高级醇来自Ehrlich途径,在此途径中由BAT2基因编码的细胞质支链氨基酸转氨酶是第一步关键酶[9]。LI等[10]通过敲除BAT2基因,降低了白酒中28.85%的高级醇含量;ZHANG等[11]通过敲除BAT2基因,使黄酒中异丁醇和异戊醇分别降低了33%和14.2%。但目前国内针对降低桑葚酒中高级醇含量的研究仍集中在工艺条件的优化[12]和外源添加物的选择[13]等方面,采用基因工程的手段,从分子水平改造酵母降低桑葚酒中高级醇的研究尚属空白,对二倍体酵母中的等位基因进行单、双缺失来逐步降低桑葚酒中高级醇的研究更为少见。
本文以实验室前期从桑葚自然发酵液中选育的优良二倍体酿酒酵母S3为出发菌株,分别敲除1个BAT2等位基因和2个BAT2等位基因后,对敲除菌株进行发酵试验,研究BAT2基因缺失对桑葚酒发酵过程中高级醇生成量的影响。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株与质粒
实验中所用菌株和质粒如表1所示。

表1 实验中所用菌株和质粒Table 1 Strains and plasmids in this study

续表1
1.1.2 引物
根据NCBI公布的酿酒酵母S.cerevisiaeS288c 的BAT2基因序列,设计PCR引物,如表2所示。

表2 实验中所用引物Table 2 Primers used in this study
1.1.3 试剂与仪器
限制性内切酶,赛默飞世尔科技(中国)有限公司;Taq聚合酶、Pfu酶、T4 DNA连接酶,近岸蛋白质科技有限公司;遗传霉素(G418)和博来霉素(Zeocin),北京索莱宝科技有限公司;酵母基因组 DNA 提取试剂盒、纯化回收试剂盒、质粒小量提取试剂盒,北京艾德莱生物科技有限公司;引物由擎科生物技术有限公司合成;标准品正丙醇、异戊醇、异丁醇、2-苯乙醇(纯度均>99.5%,GC),上海麦克林生化有限公司。
PCR 基因扩增仪(5020),赛默飞世尔科技(中国)有限公司;台式高速离心机(D3024),大龙兴创实验仪器(北京)股份公司;电泳仪(DYY-8C),北京六一生物科技有限公司;气质联用仪(6890 N-5975B),美国Agilent公司;恒温恒湿箱(GZ-250-HS11),韶关市广智科技设备有限公司;恒温水浴锅(HWS-12),上海乔欣科学仪器有限公司;凝胶成像系统(Gel DocTMXR+),伯乐生命医学产品(上海)有限公司。
1.1.4 主要培养基
LB培养基,YEPD培养基,半乳糖诱导培养基 (将YEPD 培养基中葡萄糖改为半乳糖即可)[14]。
1.2 实验方法
1.2.1 重组质粒的构建
通过1.1.2中的引物,以原始菌株S3的基因组为模板扩增BAT2基因的上下同源臂片段BA、BB和BAT2基因中的部分片段BA1、BB1,再以 pUG6质粒为模板扩增KanMX片段。然后以酶切连接法依次连接到质粒 pUC19 上获得重组质粒。
1.2.2 酵母转化
将扩增片段利用醋酸锂转化法[15]转化进酿酒酵母S3,涂布于含500 μg/mL G418的YEPD抗性平板,30 ℃培养48 h后,对平板上生长的单菌落进行PCR验证。
1.2.3KanMX抗性基因的去除
为敲除BAT2两个等位基因,需反复利用KanMX抗性基因作为筛选标记。采用Cre/loxP系统,去除阳性转化子中的KanMX筛选标记基因:先将pSH65质粒成功转入阳性子后接入半乳糖诱导培养基诱导4~5 h,再利用影印平板法筛选 G418 抗性阴性转化子,最后进行PCR验证。
1.2.4 pSH65质粒的丢失
pSH65质粒中的Cre重组酶发挥作用后,需将其从菌株中移除,以防止其中的Cre重组酶会在后续的敲除试验中提前表达。将带有pSH65质粒的目的菌株,接入10 mL无抗YEPD液体培养基中,传至8~10代,PCR验证是否丢失质粒。
1.2.5 发酵实验
取斜面菌种一环接种到灭菌后的20 mL桑葚果汁中,25 ℃,180 r/min 振荡培养24 h后,以10%接种量转接到200 mL桑葚果汁中,25 ℃,180 r/min 振荡培养18~24 h。再以5%的接种量接入调整好成分后的200 mL桑葚果汁中,25 ℃恒温无氧发酵5 d。
1.3 分析方法
1.3.1 生长曲线
取斜面菌种1环,接到10 mL YEPD液体培养基中,30 ℃,180 r/min 培养12 h。再以1% 接种量转接至200 mL YEPD液体培养基继续培养,每隔2 h测定600 nm处的吸光值。
1.3.2 理化测定
CO2失重:按照文献[16]描述的方法每隔12 h称重1次;酒精度:采用比色法[17];还原糖:采用斐林试剂法;总酸:参照GB/T 15038—2006 葡萄酒、果酒通用分析方法,采用电位滴定法。
1.3.3 高级醇的测定
1.3.3.1 气相色谱的条件
采用外标法根据各组分峰面积定量计算各组分含量。色谱条件参照文献[13]调整为:毛细管柱J&W 122-7062 DB-WAX(60 mm×0.25 mm,0.25 μm);柱温40 ℃保持3 min,然后以4 ℃/min升至77 ℃,保留1 min,以4 ℃/min升至97 ℃,保留1 min,以4 ℃/min升至107 ℃,保留1 min,以6 ℃/min升至132 ℃,保留1 min,以15 ℃/min升温至230 ℃,保持5 min;进样器温度230 ℃;检测器温度230 ℃,无分流进样;载气He,恒流1.0 mL/min。
1.3.3.2 标准溶液的配制
根据文献[18]中的方法进行调整,准确量取异戊醇0.5 mL、异丁醇0.2 mL、正丙醇和苯乙醇各0.1 mL于100 mL容量瓶中,用体积分数12%的乙醇溶液(色谱级无水乙醇与超纯水配制)定容,得到混合标准储备液。
再分别吸取0.2、0.4、0.6、0.8、1、2 mL混合标准储备液于10 mL容量瓶,用体积分数12%乙醇溶液定容,配制成不同浓度的混合标准溶液待进样,根据各物质峰面积,对质量浓度进行一元线性回归分析,绘制标准曲线。
1.3.3.3 样品前处理
取50 mL桑葚酒样品与50 mL蒸馏水于250 mL蒸馏瓶中蒸馏,得到45 mL蒸馏液后,以蒸馏水定容至50 mL,为待测样品。
2 结果与讨论
2.1 重组菌株S3-1的构建
2.1.1 构建获得敲除质粒pUC-BAKB
按酶切连接法构建重组质粒pUC-BAKB,其流程及结果见图1。

图1 重组质粒pUC-BAKB的构建流程图Fig.1 Flow chart for the construction of plasmid pUC-BABK
2.1.2 重组菌株S3-1的验证
以重组质粒pUC-BAKB为模板扩增片段BAKB,经1.2.2法转化到出发菌株S3后得到阳性转化子S3G,同源重组过程如图2所示。然后以出发菌株S3的DNA为阴性对照,以1-F/1-R 和2-F/2-R为上下游验证引物,对S3G进行PCR验证。结果如图3所示,对照菌S3无条带;重组菌株S3G上游为542 bp,下游为731 bp,与预期条带大小一致。证明KanMX片段已成功整合到出发菌株S3的基因组上,整合位点正确,BAT2基因被敲除。

图2 同源重组过程Fig.2 The process of homologous recombining
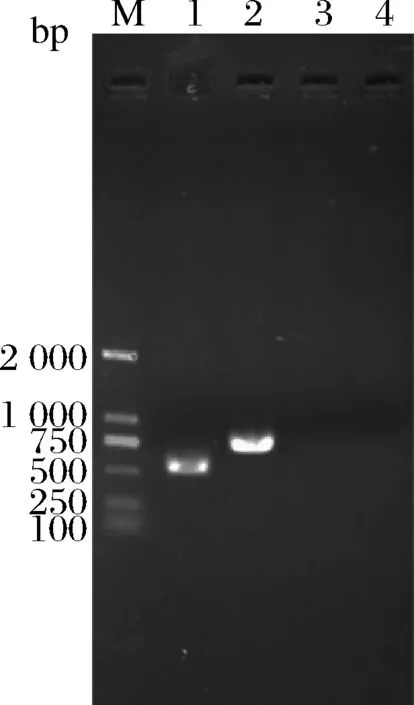
M-2 kbp DNA Marker;1-重组菌株S3G中重组片段BAKB的上游验证;2-重组菌株S3G中重组片段BAKB的下游验证;3-出发菌株S3中重组片段BAKB的上游验证;4-出发菌株S3中重组片段BAKB的下游验证图3 重组菌株S3G的PCR验证Fig.3 PCR verification of the recombinant strain S3G
2.1.3KanMX抗性筛选标记的去除
利用1.2.3的方法,去除存在于S3G基因组上的KanMX抗性基因,经抗性平板筛选后,得到无抗性标记基因的重组菌株S3-1,如图4-a所示。

a-左:含G418抗性的YEPD平板;右:普通YEPD平板;b-M-2 kbp DNA Marker;1-重组菌株S3G中KanMX基因片段的扩增;2-重组菌株S3-1中KanMX基因片段的扩增图4 重组菌株S3-1的验证Fig.4 Verification of the recombinant strain S3-1
S3-1的PCR验证结果如图4-b所示,以K-F/K-R为引物,重组菌株S3G为模板,能够扩增出1 631 bp的KanMX抗性基因片段;以重组菌株S3-1为模板,无法扩增出目的条带,证明重组菌株S3-1基因组中已无KanMX抗性基因。
2.1.4 pSH65质粒的丢失
将重组菌株S3-1连续传代至pSH65质粒丢失,以Z-F/Z-R为引物,PCR验证如图5所示,相比第1代S3-1,第8代S3-1无明显条带,表明S3-1传至第8代时已丢失pSH65质粒。

M-2 kbp DNA Marker;1,2,3-重组菌株S3-1第1,5,7代中Zeocin抗性基因的扩增;4,5-重组菌株S3-1第8,9代中Zeocin抗性基因的扩增图5 pSH65质粒丢失后的PCR验证Fig.5 PCR verification for the curing of plasmid pSH65
2.2 重组菌株D3-1的构建
为提高同源重组效率,采用缩进式[19]基因整合的方式,以BAT2基因中的一部分作为同源臂(BA1和BB1)进行实验。
2.2.1 重组质粒pUC-BA1KB1的构建
采用酶切连接法构建重组质粒pUC-BA1KB1,构建流程方法同2.1.1。
2.2.2 重组菌株的验证
对菌株S3-1进行BAT2基因的2次敲除,操作流程同2.1.2。得到阳性转化子D3G后,通过3-F/3-R和4-F/4-R进行PCR验证,结果如图6所示,条带符合预期大小,证明KanMX片段已成功整合到出发菌株S3-1的基因组上,第2个BAT2等位基因被敲除。

M-2 kbp DNA Marker;1-重组菌株D3G中重组片段BA1KB1的上游验证;2-重组菌株D3G中重组片段BA1KB1的下游验证;3-出发菌株S3-1中重组片段BA1KB1的上游验证;4-出发菌株S3-1中重组片段BA1KB1的下游验证图6 重组菌株D3G的PCR验证Fig.6 PCR verification of the recombinant strain D3G
2.2.3KanMX抗性筛选标记的去除
将菌株D3G的KanMX抗性基因去除后得重组菌株D3-1,流程同2.1.3,抗性平板筛选结果见图7-a,PCR验证结果见图7-b,证明重组菌株D3-1基因组中已无KanMX抗性基因。

a-左:含G418抗性的YEPD平板;右:普通YEPD平板;b-M-2 kbp DNA Marker;1-重组菌株D3G中KanMX基因片段的扩增;2-重组菌株D3-1中KanMX基因片段的扩增图7 重组菌株D3-1的验证Fig.7 Verification of the recombinant strain D3-1
2.2.4 pSH65质粒的丢失
将重组菌株D3-1连续传代,以Z-F/Z-R为引物,PCR验证如图8所示,D3-1传至第8代时也已丢失pSH65质粒。
2.3 重组菌株的生长性能比较
以出发菌株S3为对照,测定重组菌株S3-1和D3-1的生长曲线。如图9所示,重组菌株S3-1的生长趋势与S3一致,无明显差异;而重组菌株D3-1的生长速率和生物量较S3均有下降,这可能是由于BAT2基因完全敲除后菌株对支链氨基酸的吸收能力受到了影响,从而减缓了菌体的生长速率[20]。

M-2 kbp DNA Marker;1-重组菌株D3-1第1代中Zeocin抗性基因的扩增;2,3-重组菌株D3-1第8,9代中Zeocin抗性基因的扩增图8 pSH65质粒丢失后的PCR验证Fig.8 PCR verification for the curing of plasmid pSH65

图9 重组菌株S3-1、D3-1及出发菌株S3的生长情况Fig.9 The growth of strains S3,S3-1 and D3-1
2.4 重组菌株的发酵性能比较
将重组菌株S3-1、D3-1和出发菌株S3,同时进行桑葚酒发酵试验,发酵结束后比较各菌株的基本发酵性能。结果如表3所示,重组菌株S3-1、D3-1与出发菌株S3在相同条件下CO2失重、总酸、还原糖含量以及酒精度均无明显差异(P>0.05),且都符合NY/T 1508—2017 绿色食品 果酒。表明BAT2基因的缺失对菌株的基本发酵性能无显著影响。

表3 重组菌株S3-1、D3-1及出发菌株S3的发酵性能比较Table 3 Comparison of fermentation properties of strains S3,S3-1,D3-1
2.5 重组菌株的醇酯含量比较
参照方法1.3.3测定重组菌株和出发菌株发酵液中的高级醇含量,结果如图10所示。相比于出发菌种S3,重组菌株的高级醇含量均有所下降,其中单敲除重组菌株S3-1的总高级醇降低了20.97%,为359.33 mg/L;双敲除重组菌株D3-1降低了31.63%,为310.85 mg/L,达到了250~350 mg/L的适宜范围[21]。其中,异丁醇和异戊醇下降明显(P<0.01),S3-1分别降低了27.42%、22.86%,D3-1分别降低了40.53%、35.28%;而丙醇和苯乙醇无明显变化(P>0.05),与LI等[10]的研究相似。
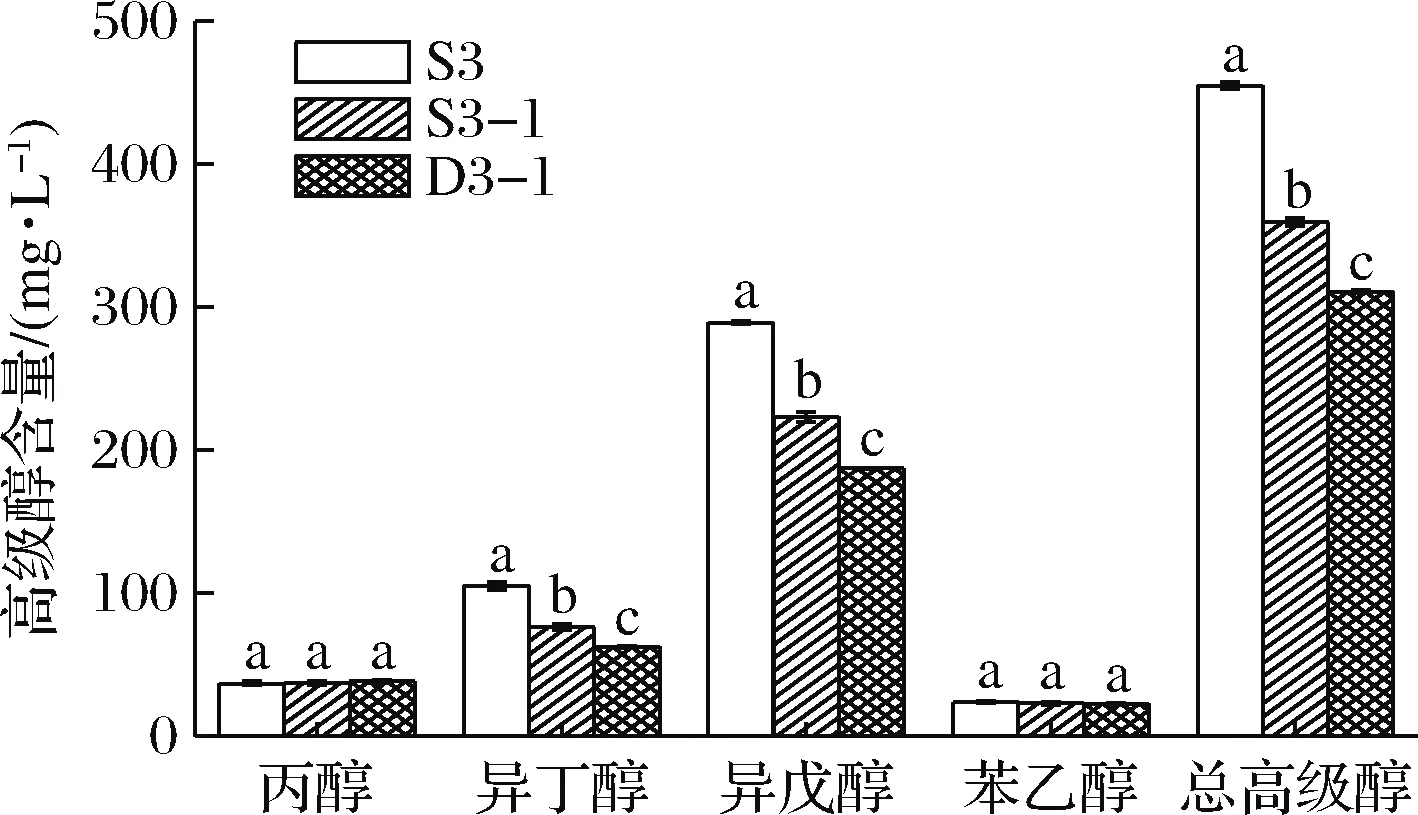
图10 重组菌株S3-1、D3-1和出发菌株S3的发酵醪中高级醇生成量的比较Fig.10 Comparison of high alcohol yields in fermented mash of strains S3,S3-1,D3-1注:总高级醇含量为丙醇、异丁醇、异戊醇和苯乙醇含量之和;不同小写字母表示具有显著性差异(P<0.05)
BAT2基因的缺失可以使酿酒酵母的高级醇产量减少,并且BAT2等位基因的第2次敲除对酿酒酵母高级醇代谢仍具有显著影响(P<0.05)。主要原因可能如下:(1)D3-1生物量的降低导致其产生的高级醇含量减少;(2)BAT2的缺失影响了Ehrlich途径中的第一步反应—转氨作用,阻断了酿酒酵母细胞质中缬氨酸和亮氨酸转化为α-酮酸[22],减少了异丁醇和异戊醇的前体物质,从而降低高级醇含量。并且当出发菌株为二倍体时,BAT2作为等位基因在基因组中会有2个拷贝,所以敲除基因的数量会与高级醇的含量呈负相关。但研究高级醇时,其含量并不是越低越好,当其含量过低时,酒体单薄,不利于果酒的风味和口感;含量过高时又会危害人体,所以达到适宜浓度的高级醇才是果酒的研究目的。
3 结论
本研究利用Cre/loxp系统和基因同源重组技术,对出发菌株S3的BAT2基因进行单敲除和双敲除,得到重组菌株S3-1和D3-1。经生长性能的测定,S3-1的生长趋势与S3一致,但D3-1较S3有所减缓。桑葚酒发酵实验结果显示,S3-1和D3-1的基本发酵性能与S3均无明显差异,符合果酒酿造的基本要求。而高级醇生成量相比出发菌株有不同程度的降低,S3-1降低了20.97%,D3-1降低了31.63%,其中降低最为明显的是异丁醇和异戊醇。这表明对酿酒酵母中BAT2基因的敲除可以在不影响基本发酵性能的同时,降低桑葚酒中高级醇含量,提高桑葚酒品质,具有一定的实际应用潜力。本研究仅探究了BAT2基因对高级醇生成量的影响,在后续研究中可以继续探究BAT2基因对相关氨基酸转化量和桑葚酒中其他风味物质生成量的影响,完善BAT2基因在高级醇代谢途径中的作用机制。

