纤维素降解菌株的分离与筛选*
赖国栋 秦长生 赵丹阳 邱华龙 杨 华 田龙艳 练 涛 徐金柱
(广东省森林培育与保护利用重点实验室/广东省林业科学研究院,广东 广州 510520)
纤维素是地球上含量多、分布广的可再生资源,其以木质纤维形式存在,主要由纤维素、半纤维素和木质素构成[1],其主要来源于高等植物[2]。纤维素以其独特的化学结构在自然界难以被降解[3]。目前纤维素的降解主要有物理法、化学法和生物法3 种方法,生物法相比其它两种方法,具有安全性高、能耗低、经济环保等优势[4],逐渐被人们重视。生物法降解纤维素,主要依靠纤维素酶,自从1906 年Seilliere 首次在蜗牛肠胃消化液中发现的纤维素酶能降解纤维素以来[5],纤维素酶就引起了国内外研究人员重视。
纤维素酶的来源相当广泛,但目前仍然以产酶微生物为主,自1912 年Pringsheim 等人成功从土壤中筛选出第一批纤维素降解菌以来[6],至今已从不同环境中分离获得超过200 种可以产纤维素酶的微生物,其中不乏具有耐低温、耐高温、耐碱等特殊功能的微生物[7-10]。纤维素降解菌主要有真菌、细菌和放线菌,真菌产纤维素酶多为胞外酶,细菌产纤维素酶多为胞内酶,放线菌因产酶量低于真菌和细菌研究相对较少[11-12]。在我国绿化垃圾种类繁多,其主要成分以木质纤维素为主[13-19],但我国对纤维素的利用水平相对较低,本研究旨在筛选出能高效生产纤维素酶的菌株并鉴定,为提高我国纤维素利用率提供参考依据。
1 材料与方法
1.1 土样及菌株来源
土样采自广东省林业科学研究院枯枝落叶堆腐的土壤;菌株:木腐菌7 株,保存于广东省林业科学研究院。
1.2 培养基
(1)富集培养基:羧甲基纤维素钠(CMCNa)15 g,硝酸铵(NH4NO3)1 g,酵母膏1 g,七水硫酸镁(MgSO4·7H2O)0.5 g,磷酸二氢钾(KH2PO4)1 g,蒸馏水1 000 mL。
(2)筛选培养基:羧甲基纤维素钠(CMCNa)20 g,磷酸二氢钾(KH2PO4)2 g,七水硫酸 镁(MgSO4·7H2O)0.3 g,硫 酸 铵(NH4)2SO41.4 g,氯化钙(CaCl2)0.3 g,氯化锌(ZnCl2)0.001 7 g,硫酸锰(MnSO4)0.001 6 g,氯化钴(CoCl2)0.002 g,硫酸亚铁(FeSO4)0.000 5 g,蒸馏水1 000 mL,pH7.0~7.2。
(3)发酵产酶培养基:蛋白胨3 g,硫酸铵2 g,酵母膏0.5 g,磷酸二氢钾(KH2PO4)4 g,氯化钙(CaCl2)0.3 g,七水硫酸镁(Mg-SO4·7H2O)0.3 g,Tween-80 0.2 mL,羧甲基纤维素钠(CMC-Na)20 g,蒸馏水1 000 mL。
(4)SDY 培养基:蛋白胨10 g,酵母粉10 g,葡萄糖40 g,蒸馏水1 000 mL。
(5)LB 培养基:胰蛋白胨10 g,酵母粉5 g,氯化钠(NaCl)10 g,蒸馏水1 000 mL。
1.3 主要试剂
(1)1 mg/mL 刚果红溶液:称取0.5 g 刚果红,加蒸馏水溶解并定容至500 mL,室温、避光保存。
(2)1 mol/L 氯化钠溶液:称取58.5 g NaCl,加蒸馏水溶解并定容至1 000 mL。
(3)1.0 mg/mL 葡萄糖标准液:称取烘干至恒重的葡萄糖0.10 g,加蒸馏水溶解并定容至100 mL,4 ℃保存。
(4)柠檬酸-柠檬酸三钠缓冲液(0.05 mol/L,pH4.5):A 液:称取柠檬酸10.507 g 用蒸馏水溶解后定容至500 mL;B 液:称取柠檬酸三钠14.705 g 用蒸馏水溶解后定容至500 mL;取230 mL A 液和270 mL B 液混合后即为柠檬酸缓冲液。
(5)DNS 试剂:称取6.3 g 3,5-二硝基水杨酸(C7H4N2O7),21 g 氢氧化钠(NaOH),182 g 酒石酸钾钠(C4H4O6KNa·4H2O),5 g 苯酚(C6H5OH)(在50 ℃水溶化),5 g 偏重亚硫酸钠(NaS2O5),搅拌至完全溶解,定容至1 000 mL,避光储存于棕色试剂瓶中,4 ℃保存,放置一周后使用。
(6)1% CMC-Na:称取1.0 g CMC-Na 溶解于100 mL 柠檬酸缓冲液中,4 ℃保存。
(7)DNA 提取试剂盒:M5 Fungal Genomic DNA Kit(50T)。
(8)菌株保存液:30%甘油与无菌水1:1 混合。
1.4 主要实验仪器
超净工作台、水浴锅、紫外分光光度计、搅拌器、高压灭菌锅、PCR 仪、pH 计、离心机、振荡器、电子天平、恒温振荡培养箱等。
1.5 富集培养
将采集的土壤过筛处理,称取土样10 g,放入装有100 mL 富集培养基的250 mL 三角瓶中,加入3 颗无菌玻璃珠,30 ℃,150 rpm 振荡培养3~4 d[9-10]。
1.6 菌株分离
取1 mL 富集培养液,梯度稀释至10-1,10-2,10-3,10-4,10-5和10-6共6 个梯度浓度,每个梯度各取0.1 mL,涂布于筛选培养基平板上,30 ℃培养,每个浓度涂布10 块板。待菌落长出后,挑选不同形态的菌株划线,获得单菌株,纯化菌株[9-10]。
1.7 纤维素降解能力测定初筛(刚果红染色法)
分别将纯化得到的菌株和实验室保存的7 株木腐菌点接到筛选培养基平板中央,每菌株3 个重复,30 ℃恒温培养3~6 d,根据菌落生长速度确定染色时间(菌落直径不超过培养皿半径前进行染色)。取1 mg/mL 刚果红溶液3 mL,均匀布于平板,染色30 min,用1 mol/L 氯化钠溶液冲洗30~60 min,利用十字交叉法测量菌落直径d(mm)和菌落外围透明圈直径D(mm),根据Hc值(Hc=D/d),确定供试菌株分解纤维素能力,筛选比值较大的菌株,进行酶活测试[9-10]。
1.8 CMC 酶活测定复筛(DNS 法)
1.8.1 粗酶液的制备 将初筛目标菌株接种至种子培养基(SDY 培养基),28 ℃,180 rpm 培养3 d,按10%接种量接种至装有100 mL 发酵产酶培养基的三角瓶中,每株菌设3 个重复,28 ℃,180 rpm培养5 d,取10 mL 发酵液,4 ℃,5 000 rpm 离心10 min,所得上清液即为粗酶液[9-10]。1.8.2 标准曲线绘制 参考相关文献[19],绘制葡萄糖标准曲线。取一系列25 mL 具刻度试管并进行标号,根据表1 内容依次加入葡萄糖标准液、蒸馏水和DNS 溶液。混匀后,沸水浴10 min,迅速冷却加蒸馏水定容至 25 mL,在540 nm 波长下,以1 号管调零测量各管的光密度值。以光密度值为纵坐标,葡萄糖浓度为横坐标,绘制标准曲线。

表1 葡萄糖标准曲线绘制Table 1 Draw a standard curve of glucose
1.8.3 纤维素酶(CMCase)活力测定 取4 支25 mL试管,设置1 个空白对照管和3 个试验管分别加入1 mL 粗酶液,将空白对照管进行沸水灭活10 min,试验管不作沸水灭活处理。然后4 支试管均加入1.5 mL 1% CMC-Na,混匀,50 ℃保温30 min 后沸水浴灭活10 min。再分别加入3 mL DNS 溶液沸水浴反应10 min 后迅速冷却,加蒸馏水定容至25 mL,于540 nm 波长下,以空白对照管调零,测定试验管的OD 值,并计算酶活力。
酶活力定义:在50 ℃条件下,1 mL 粗酶液1 min 产生1 μg 葡萄糖为一个酶活单位,用U/mL表示。酶活计算公式如下:
酶活力E=1 000×S×N/(T×V)
其中,E: 样品的酶活力( U/mL) ;S:由样品的平均吸光值在标准曲线上相对应的葡萄糖含量(mg) ;N:粗酶液的稀释倍数;1 000:mg 与 μg之间的换算倍数;T: 反应时间( min) ;V: 参与反应的粗酶液体积( mL)[9-10]。
1.9 高产酶菌株的鉴定
采用M5 Fungal Genomic DNA Kit(50T)试剂盒提取供试菌株总DNA,并以此为模板进行PCR 扩 增 分 析。以ITS1/ITS4 和ITS4/ITS86 为引物,进行 PCR 扩增(表2)。扩增体系为25 μL(Premix Taq 12.5 μL,DNA 模 板2 μL,引 物0.5 μL,ddH2O 15 μL)。扩增条件为:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃延伸30 s,循环32次;72 ℃ 10 min,4 ℃保存。细菌以27F/1492R和357F/907R 为引物进行 PCR 扩增。扩增条件为95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃延伸90 s/30 s,循环32 次;72 ℃ 10 min,4 ℃保存。PCR产物送上海生工生物工程公司测序。测序结果在NCBI 上进行同源性比较和聚类分析,确定菌株种类[9-10]。

表2 高产酶菌株鉴定所用引物Table 2 Primers for strain identification
2 结果与分析
2.1 菌株分离
从同一批次土壤中挑选1~2 株培养性状(菌落形态、生长速率、色素分泌等)差异显著的菌株进行分离纯化。经富集培养分离,从3 批腐殖质土壤中共分离获得47 个菌株(表3)。

表3 土壤微生物形态特征Table 3 Morphological characteristics of soil microorganisms
2.2 纤维素降解性能测试初筛
采用刚果红染色法对土壤中分离的47 株菌和实验室保存的7 株木腐菌进行纤维素降解能力测试。结果表明:供试菌株对纤维素钠的降解能力存在明显差异(Hc = 0-3.87),根据Hc 的大小,最终将供试菌株分为高产酶、低产酶、不产酶3 类。再次利用刚果红染色,筛选出Y2、Y5、Y6 和 HF-3 共4 个菌株菌落外围形成较大透明圈,Y5 的Hc 值最大,为3.87;Y2 的次之,Hc 值为2.54;Y6 的Hc 值1.86;HF-3 的生长速率最快,Hc = 1.35。初步筛选出Y2、Y5、Y6 和 HF-3 高产纤维素酶的菌株共4 株(图1、表4)。
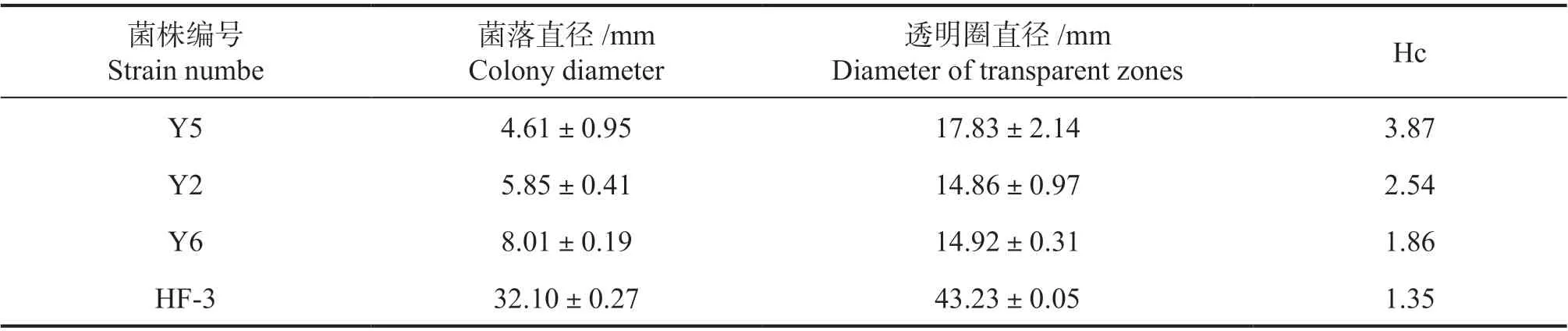
表4 高产纤维素酶菌株的Hc 值Table 4 Hc value of high cellulase producing strain

图1 高产纤维素酶的菌株刚果红染色结果Fig. 1 Congo red staining results of high cellulase producing strain
2.3 纤维素降解菌株酶活测定复筛
试验以葡萄糖含量为横坐标,OD 值540 nm的吸光度为纵坐标,绘制的葡萄糖标准曲线如图2 所示,线性回归方程为:y=0.902 1x+ 0.090 4(R2=0.958 5),拟合效果良好,可用于酶活测定。

图2 葡萄糖标准曲线Fig. 2 Glucose standard curve
将初筛获得的4 株高产纤维素酶菌株在28 ℃,180 rpm 发酵培养5 d,测定各菌株CMC酶活力。菌株HF-3 的CMC 酶活力最高,为67.722 U/mL;其次为菌株Y5,为37.714 U/mL;菌株Y6,为30.694 U/mL;菌株Y2 的CMC 酶活力最低,为25.336 U/mL(表5)。

表5 高产纤维素酶菌株CMC 酶活力Table 5 CMC enzyme activity of the strain
2.4 菌株鉴定结果
通过分离纯化,培养4 个菌株的菌落特征(生长速率、菌落质地、颜色、气味)等特征,初步 确 定Y2、Y5、Y6 为 放 线 菌(Actinomycete),HF-3 为真菌,菌落形态如图3 所示。
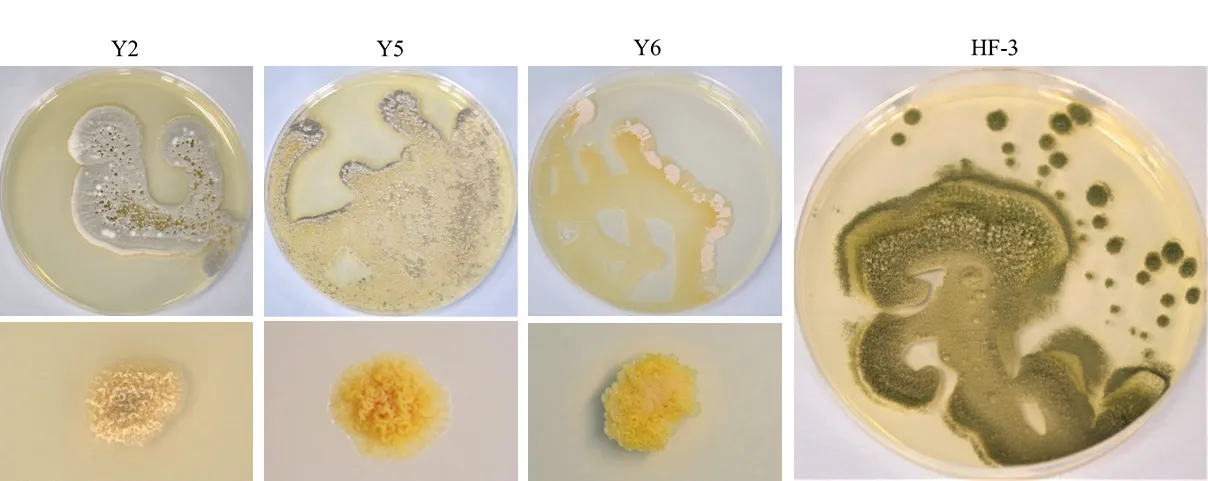
图3 高产纤维素酶菌株菌落形态Fig. 3 Morphological characteristic of strain
采用试剂盒提取菌株DNA,分别以各菌株DNA 为模板进行PCR 扩增。扩增产物送上海生工生物工程公司测序,利用SeqMan 进行序列拼接剪切,将结果输入NCBI 网站,进行同源性比对,同时下载同源序列,利用MEGA7 构建系统发育树(图4~7),确定菌株种类,具体鉴定结果如表6所示,HF-3 为密褐褶孔菌Gloeophyllum trabeum,Y5 为浅灰白链霉菌Streptomyces griseoloalbus、Y6 为丝状链霉菌Streptomyces filamentosus和Y2为威德摩尔链霉菌Streptomyces wedmorensis。

表6 纤维素降解菌种类Table 6 The specie of cellulose degrading strain

图4 Y2 系统发育树Fig. 4 Phylogenetic tree of Y2
3 结论与讨论
在自然界中的纤维素主要靠细菌、放线菌、真菌都产生的孢外纤维素酶进行降解,而高效降
解菌株的筛选是纤维素开发和利用的关键,本研究利用羧甲基纤维素钠培养基和刚果红透明圈染色法,从土壤和实验室已有的木腐菌种中初步筛选出4 株较高产酶的纤维素降解菌株,4 株菌株在28 ℃、180 r/min 条件下培养5 d 后,孢外纤维素酶活性HE-3 菌株最高为67.772 U/mL,其它3 个菌株相对较高,Y5 为37.714 U/mL、Y6 为30.694 U/mL、Y2 为25.336 U/mL。通 过 菌 落 特征以及DNA 分子比对,对4 株菌株进行了鉴定,HF-3 为密褐褶孔菌,Y5 为浅灰白链霉菌、Y6 为丝状链霉菌和Y2 为威德摩尔链霉菌。
图5 Y5 系统发育树Fig. 5 Phylogenetic tree of Y5
图6 Y6 系统发育树Fig. 6 Phylogenetic tree of Y6

图7 HF-3 系统发育树Fig. 7 Phylogenetic tree of HF-3
邵帅等[20]研究发现,在不同的培养基中,菌株产生的纤维素酶的活性存在差异,因此优化产酶条件是提高纤维素降解率的关键。Kato 等[21]研究表明 CSK1 单独培养后进行木质纤维素降解时,其效率显著低于混合菌系;夏强[22]对3 株具有木质纤维素降解功能的菌株进行复配后得到的复合菌剂,对小麦秸秆中纤维素的降解率达到63.59%;由此可知复配是提高菌株降解的另一途径。受此启发,本研究后续将对4 个菌株的产酶条件进行优化,获得高效产酶条件,并将4 个菌株进行复配研究,进一步提高其对纤维素的降解能力。

