成人急性髓系白血病血清HA、LN、PCⅢ表达水平与预后的关系*
兰坚 杨蜀锦 李妮 王姣 邹夏
(1.四川大学华西医院血液科,四川 成都 610041;2.成都市第七人民医院肿瘤科,四川 成都 610000)
急性髓系白血病(acute myeloid leukemia,AML)是一种源自髓系造血干细胞和(或)祖细胞高度异质性的血液系统恶性肿瘤[1],虽然部分患者能够通过初始诱导化疗获得骨髓缓解,但有20%~40%患者会发生原发耐药,导致骨髓未缓解或治疗过程中复发,其病死率较高[2]。目前关于AML的临床研究较多,但其具体的发病机制尚未完全阐明,骨髓微环境的异常病理变化是诱导正常造血干细胞恶性转化的关键因素之一[3],而骨髓纤维组织增生、胶样变性及异常血管新生都可能与AML的发病有关[4]。透明质酸(HA)、层黏蛋白(LN)、Ⅲ型前胶原蛋白(PCⅢ)是反映细胞外基质成分的一类血清标记物[5]。有研究表明,在急性淋巴细胞白血病、AML、慢性髓性白血病患者血清中均能够检测到HA、LN、PCⅢ水平升高[6]。但HA、LN、PCⅢ水平与预后间关系的研究鲜见临床报道。因此本研究旨在探讨AML中血清HA、LN、PCⅢ水平与预后的关系,以期为临床提供评估AML病情及预后的参考指标。
1 资料与方法
1.1 一般资料 选取2017年1月~2019年1月四川大学华西医院收治的156例初治AML患者为观察组。纳入标准:①符合WHO制定的《造血和淋巴组织肿瘤分类诊断标准(2016年修订版)》[7]中诊断标准。②接受骨髓细胞形态学、免疫组织化学、染色体检查及白血病免疫分型检测。③年龄>18岁。④首次诊断为AML。⑤患者知情并签署同意书。排除标准:①合并心、脑、肺、肝、肾等严重功能障碍。②合并其他恶性肿瘤。③合并其他血液系统疾病。另纳入同期门诊体检健康者100例为对照组。本研究经医院伦理委员会审核批准。
1.2 方法 观察组均给予氟达拉滨+阿糖胞苷+粒细胞及所刺激因子(FLAG)治疗方案[8]。具体用药方式:首先给予粒细胞集落刺激因子300 μg/d 皮下注射,持续5 d,注射次日后给予氟达拉滨(辰欣药业股份有限公司,国药准字H20103645)30 mg/m2静脉滴注30 min,持续4 d,每次氟达拉滨静滴完成后4 h,给予阿糖胞苷(国药一心制药有限公司,国药准字H20055127)1~2 g/m2/d,静滴3 h,持续4 d。治疗过程中记录患者症状体征变化,并配合保心、保肝、护胃等对症处理,必要时输注血小板。14 d为1个疗程,治疗2个疗程后判定疗效。
1.3 血清HA、LN、PCⅢ水平检测 分别抽取AML患者入院后次日、治疗后28 d及对照组体检时的空腹静脉血于抗凝管中,低温3000 r/min离心15 min后收集上清,保存于-20 ℃待测。采用酶联免疫吸附法(ELISA)检测,试剂盒购自上海恒斐生物科技有限公司,严格按照试剂盒操作步骤完成。
1.4 疗效判定标准 参照《血液病诊断及疗效标准》[9],以患者的临床表现、外周血及骨髓象进行判定。完全缓解(CR):白血病症状及体征完全消失,血常规男性血红蛋白>100 g/L,女性>90 g/L,血小板计数>100×109/L,中性粒细胞>1.5×109/L,外周血细胞分类中未见白血病细胞;骨髓象原始单核细胞、幼稚淋巴细胞以及幼稚单核细胞或原始淋巴细胞比例<5%,红细胞与巨核细胞均恢复正常。部分缓解(PR):白血病症状及体征、血常规有一项未达到上述标准,骨髓象原始单核细胞、幼稚淋巴细胞以及幼稚单核细胞或原始淋巴细胞比例在5%~20%之间;无缓解(NR):白血病症状及体征、血常规、骨髓象均未达到缓解标准。根据缓解情况将患者分为缓解组(CR+PR)和无缓解组(NR)。
1.5 出院随访 所有AML患者均于出院后通过门诊或电话方式随访1年,随访间隔1个月。记录AML患者的死亡例数以及死亡原因,根据预后结局分为生存组与死亡组。
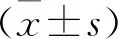
2 结果
2.1 两组一般情况比较 观察组中男性80例,女性76例,年龄26~68岁,平均(46.2±11.8)岁;FAB分型:M0 11例、M1 18例、M2 49例、M3 16例、M4 7例、M5 55例。对照组中男性55例、女性45例,年龄25~70岁,平均(45.5±10.9)岁。两组患者的性别、年龄比较差异无统计学意义(P>0.05)。
2.2 两组血清HA、LN、PCⅢ水平比较 观察组患者血清中HA、LN、PCⅢ水平均显著高于对照组,差异有统计学意义(P<0.05),见表1。
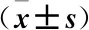
表1 两组血清HA、LN、PCⅢ水平比较Table 1 Serum HA,LN,PCⅢ levels of AML patients compared with the control group
2.3 观察组治疗后不同疗效患者血清HA、LN、PCⅢ水平比较 观察组156例AML患者治疗后CR 94例,PR 26例,NR 36例,总缓解率76.92%,无缓解组患者的HA、LN、PCⅢ水平均高于缓解组患者,差异具有统计学意义(P<0.05),见表2。
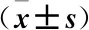
表2 治疗后不同疗效患者血清HA、LN、PCⅢ水平比较Table 2 Comparison of serum HA,LN,PCⅢ levels of patients with different efficacy after treatment
2.4 观察组不同预后患者血清HA、LN、PCⅢ水平比较 观察组156例AML患者1年随访期内有41例患者死亡,存活率为73.72%,死亡组患者的HA、LN、PCⅢ水平均高于存活组,差异具有统计学意义(P<0.05),见表3。
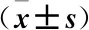
表3 不同预后患者血清HA、LN、PCⅢ水平比较Table 3 Comparison of serum HA,LN,PCⅢ levels of patients with different prognosis
2.5 观察组血清HA、LN、PCⅢ水平预测1年内预后不良的ROC分析 ROC结果显示,AML患者血清中HA、LN、PCⅢ水平预测预后不良的AUC分别为0.731、0.707、0.832,95%CI分别为0.635~0.826、0.619~0.795、0.766~0.898,截断值为83.73 μg/L、117.77 μg/L、140.07 μg/L,见图1、表4。
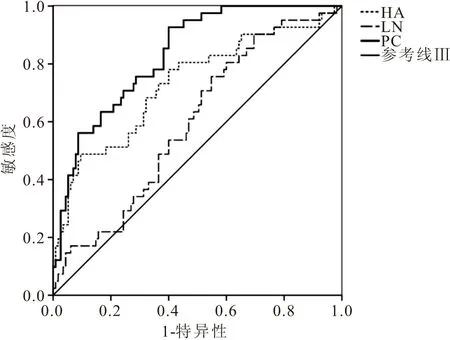
图1 血清HA、LN、PCⅢ水平预测1年内预后不良的ROC曲线Figure 1 ROC curve of serum HA,LN,PCⅢ levels predicting poor prognosis within 1 year
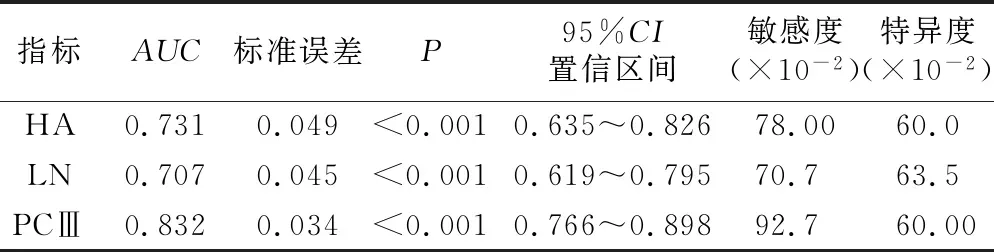
表4 血清HA、LN、PCⅢ水平预测1年内预后不良的效能Table 4 Efficacy of serum HA,LN,PCⅢ levels to predict poor prognosis within 1 year
3 讨论
AML作为一种克隆性起源,骨髓造血干细胞或早期祖细胞突变所引起的造血系统恶性肿瘤,主要是骨髓中的白血病细胞增殖失控、凋亡障碍和分化受阻,进而抑制了骨髓的正常造血[10]。虽然化疗药物的应用和造血干细胞移植技术的发展,使得AML患者缓解率以及无病生存时间有所提高,但AML患者的5年生存率依旧不高,仅在28%~35%之间[11]。临床研究证实,AML患者的临床症状及预后生存情况与FAB亚型关系不大,因此寻找准确评估AML病情及对预后进行分层的临床指标显得尤为重要[12]。骨髓纤维化(MF)是由慢性炎症介导的骨髓基质对造血干细胞克隆增殖紊乱的异常反应,而形成纤维细胞异常增生及组织硬化为特征的骨髓组织,MF的严重程度对AML患者的预后有较大的影响,虽然目前MF的发病机制尚未完全阐明,但骨髓微环境的动态演化在MF的发病过程发挥着重要的作用[13]。骨髓微环境由骨髓内的基质细胞及细胞外物质构成,目前研究显示在AML、多发性骨髓瘤、急性淋巴细胞白血病、骨髓增殖性肿瘤等微环境中的骨髓基质细胞中均可获得肿瘤相关成纤维细胞(CAF),因此研究AML患者的CAF指标对提高其预后具有重要作用[14]。
本研究结果显示,与对照组相比,观察组患者血清中HA、LN、PCⅢ水平显著升高,而经过FLAG方案治疗后,观察组中无缓解患者血清中的HA、LN、PCⅢ水平显著高于缓解组患者,同时1年内死亡患者血清中HA、LN、PCⅢ水平也要明显高于存活患者,提示血清HA、LN、PCⅢ水平具有评价AML病情进展程度及预后预测的潜在价值。现有研究提示30%~75%未经治疗的急性白血病患者伴有骨髓活组织切片内网硬蛋白纤维的局限性和弥散性增多[15],胶原Ⅰ、Ⅱ、Ⅲ型组成胶原纤维并构成细胞外空间的结构骨架,即骨髓活检切片上的网硬蛋白纤维,而PCⅢ的沉积能够反映纤维增殖性反应[16],因此AML患者血清中PCⅢ水平高于正常人。HA是由基质细胞中的间质细胞分泌的一类氨基葡聚糖,是骨髓外机制的重要构成部分,通过与细胞表面受体CD44结合,从而发挥细胞与细胞外基质间的黏附作用,并且还能够受肿瘤细胞的信号传导调控,参与肿瘤细胞的增殖、分化、浸润和转移[17]。当AML发病时会使骨髓正常结构受损,从而导致HA合成增加,而降解减弱,因此能够在血清中检测HA水平升高[18]。LN则是作为一类基底膜的独特成分广泛分布在胆管壁、血管壁、淋巴管壁等部位,既能够发挥细胞与基质粘着介质的作用,还能够连接基底膜上的大分子,与IV型胶原特定位点结合后形成复杂立体结构,促使骨毛细血管化,从而参与肿瘤的浸润转移[19],因此AML发病时,可检测到LN水平升高。本次研究还利用ROC分析了血清HA、LN、PCⅢ水平预测患者不良预后的价值,结果显示,血清中HA、LN、PCⅢ水平预测预后不良的AUC分别为0.731、0.707、0.832,均大于0.700,具有一定的预测价值,但由于HA、LN、PCⅢ水平仅能反映骨髓微环境内基质细胞的情况,而骨髓微环境中的细胞外物质同样发挥着重要的作用,因此HA、LN、PCⅢ水平用于预后的预测的特异度均不高。
4 结论
AML患者血清HA、LN、PCⅢ水平异常升高,并且经治疗后无缓解以及预后不良患者血清HA、LN、PCⅢ水平均较高,说明血清HA、LN、PCⅢ水平对评估患者病情及短期预后具有一定的价值。但本研究样本量较小,还需要扩大样本量,进行相关实验性研究,进一步揭示HA、LN、PCⅢ在AML发病中的作用,为临床诊治提供可靠参考依据。

