BiOBr/NaNbO3复合光催化剂的制备及其性能研究
樊国栋,李 楠,潘谦宏,张 晗,苏肖彦
(1.陕西科技大学 化学与化工学院 教育部轻化工助剂化学与技术重点实验室,陕西 西安 710021;2.西安长庆化工集团有限公司,陕西 西安 710018)
0 引言
日益严重的环境污染严重威胁着人类社会的发展,因此科研工作者开发了多种技术来去除环境中的污染物,其中半导体光催化技术以其绿色、高效的特点,在环境修复中受到广泛关注[1].然而,最早的半导体TiO2只能被紫外光激发,限制了其实际应用,这给探索新型可见光驱动半导体器件带来了挑战[2].
近年 来,Bi基BiVO4、Bi2WO6、Bi2MoO6和Bi2O2CO2等半导体材料因其高效的光催化性能、无毒性和化学稳定性而受到广泛关注.BiOBr作为光催化剂的一个新兴半导体,由于其在降解有机污染物方面的优异性能,近年来引起了广泛的研究兴趣.然而,由于电荷的快速复合,BiOBr原有的光催化效率不尽人意.将BiOBr和其他半导体复合,在二者之间构建异质结来作为一种有效的策略,有利于提高载流子分离效率.其中,基于BiOBr的直接Z型异质结的构建被证明是提高光催化活性的有效策略,Wang等[3]报道了通过两步制备具有显著增强的可见光光催化性能的直接Z 型光催化剂,由于Z 型异质结的构建,约66.7%的有机碳(TOC)可以被去除,表现出显著的光催化性能.
钙钛矿铌酸盐的应用前景广阔,其中铌酸钠(NaNbO3)是一种典型的简单钙钛矿结构,由于其低密度、良好的光催化和光折变特性而具有相当高的研究价值[4].然而,Na Nb O3大的带隙(3.4 e V)不利于可见光的有效利用,其光生电子-空穴对的快速复合限制了其光催化活性.为了解决这一问题,人们采取了各种方法来缩小带隙,加速分离电子-空穴对,提高其光催化活性,包括偶联、自掺杂或与其它元素掺杂[5].其中将NaNbO3与其它材料相结合[6].开发复合光催化剂是提高其光催化活性的有效途径.
本研究采用BiOBr 和Na Nb O3作为构建BiOBr/Na Nb O3(BNN)复合光催化剂的候选物,将BiOBr均匀地分布在NaNbO3的表面上,期望在二者的相界面构建具有特定结构的异质结,其主要目的是提高BiOBr的光催化活性,达到有效降解污染物的目的.这项工作首次通过简便的一步沉淀法制备了新型BiOBr/Na Nb O3复合半导体光催化剂,对光催化性能进行了研究.
1 实验部分
1.1 主要原料及仪器
1.1.1 主要原料
硝酸铋(Bi(NO3)3·5H2O,天津市科密欧化学试剂有限公司);溴化钾(KBr,天津市福晨化学试剂厂);氢氧化钠(NaOH,山西同界化学试剂有限公司);乙二醇(C2H6O2,国药集团化学试剂有限公司);氧化铌(Ni2O5,麦克林试剂公司);无水乙醇(C2H5OH,天津市富宇精细化工有限公司);罗丹明B(Rh B,上海阿拉丁试剂股份有限分公司).以上所有试剂均为分析纯,实验用水为去离子水.
1.1.2 主要仪器
X 射线衍射仪(XRD),RigalcuD/Max-3c型,日本理学公司,对样品进行物相分析;场发射扫描电子显微镜(FE-SEM),SU8100 型,日本日立公司,对样品形貌表征;可见分光光度计,7230G 型,上海精密科学仪器有限公司,用测定吸光度;X 射线光电子能谱(XPS),AXIS Supra型,英国Kratos公司,用来分析样品的化学态;紫外可见漫反射(Uv-vis),Cary 5000型,美国安捷伦公司,用来分析样品的紫外可见吸收及计算禁带宽度;光化学反应仪,GHX-II型,上海嘉鹏科技有限公司,用来光降解RhB;电化学工作站,CHI66E 型,上海辰化有限公司,用来测试样品的光电性能.
1.2 实验方法
1.2.1 铌酸钠的制备
采用水热法,首先将2 g Nb2O5粉末加入30 mL的NaOH(8.4 mol/L)溶液中并搅拌30 min,将形成的悬浮液被转移到100 mL 的聚四氟乙烯内衬的高压釜中,然后在200℃真空干燥箱中加热反应10 h,高压釜自然冷却到室温,离心过滤得到的粉末用蒸馏水离心洗涤6 次,在真空干燥箱中80 ℃下干燥10 h,得到NaNbO3纳米材料.
1.2.2 BiOBr/Na Nb O3复合催化剂的制备
将10 mmo L 的Bi(NO3)3·5H2O 和10 mmo L的KBr分别溶解在20 mL的乙二醇中形成溶液A 和溶液B,以上述BiOBr摩尔占比100%为计算依据,称取摩尔比分别为5%、10%、15%和20%的系列NaNbO3粉末,将其超声分散在10 mL 的乙二醇中得到溶液C,然后将溶液C缓慢滴加到溶液A 中,再将溶液B加到上述混合溶液中,搅拌3 h后静置得到白色沉淀,用无水乙醇和去离子水洗涤3~4次,最终获得含有5%、10%、15%和20%的NaNbO3/BiOBr复合光催化剂,将所得到的复合光催化剂简称为BNN.单一的BiOBr在上述不添加Na Nb O3粉末的条件下制备得到.
1.3 光催化性能评价
取20 mg制备的催化剂置于装有30 mL、60 mg/L的罗丹明B溶液的石英管中,放置到光化学反应仪中,先进行30 min暗反应,使其达到吸附解吸平衡,然后在500 W 的汞灯下进行光降解反应,每隔5 min取1.5 mL样品,离心分离,取1 mL上清液后在波长554 nm 下的可见分光光度计,测定初始浓度为C0时的吸光度和光照一定时间后的吸光度,换算为浓度Ct,采用公式(1)计算降解率η:

式(1)中:C0为吸附平衡后RhB 的浓度值mg/L;Ct为反应t时的RhB的浓度值,mg/L.
2 结果与讨论
2.1 XRD 分析
图1显示了具有不同摩尔百分比的BiOBr/Na Nb O3复合材料与纯的NaNbO3和BiOBr的XRD 图 谱.单一BiOBr在(001)、(101)、(102)、(110)、(112)、(200)和(212)晶面显示出对应的特征衍射峰,2θ角分别为10.9°、25.1°、31.7°、32.2°、39.4°、46.2°和57.1°,根据标准卡片索引到BiOBr的四边形相(JCPDS 09-393)[3].Na Nb O3粉末与(JCPDS 33-1270)的数据索引的Na Nb O3晶相吻合[7].BNN-5 的特征峰较弱可能是由于NaNbO3的含量较低的缘故,随着NaNbO3的含量增加,BNN-10和BNN-15复合物中NaNbO3的单一特征峰22.89°处强度增大,其中BNN-10在22.89°处的特征峰最尖锐.不同比例的BNN 复合材料,都具有与单一NaNbO3和BiOBr所对应的特征峰,这表明BNN 复合材料已成功制备.

图1 不同催化剂的XRD 图
2.2 结构与形貌表征
图2是BiOBr、NaNbO3及BNN-10复合光催化剂的SEM 图.纯BiOBr(如图2(a)所示)形貌呈现不规则的纳米片状结构,其表面光滑,大小各异;纯NaNbO3(如图2(b)所示)立方体结构呈不规则的堆积状态,形状各异,棱角分明;从图2(c)可以清楚看到,BNN-10复合光催化剂的立方体表面是粗糙的纳米片,说明纳米板状的BiOBr紧密包裹在NaNbO3立方形结构的表面,堆积形成BNN 复合光催化剂.形成的BiOBr和NaNbO3紧密的相互作用,推测可能是形成异质结构型[8],使BNN复合材料光降解能力提高.

图2 不同光催化剂的SEM 图
2.3 化学态分析
图3为BiOBr、NaNbO3和BNN-10光催化剂的XPS分析谱图.图3(a)宽谱表明单体BiOBr含有Bi、O 和Br三种元素,单体NaNbO3含有Na、Nb和O 三种元素,而复合催化剂BNN-10中含有Bi、Br、Na、Nb和O 五种元素,表明催化剂表面形成了BiOBr/NaNbO3复合结构;图3(b)中单一BiOBr在结合能为164.16和158.86 e V 处分别对应Bi 4f7/2和Bi 4f5/2能级分裂峰,这是Bi3+的特征峰;图3(c)所示的Br 3d3/2和Br 3d5/2特征峰对应结合能分别为69.06和67.98 e V,表明催化剂中Br是以Br-形式存在,说明BiOBr 成功制备.BNN-10与纯BiOBr对比,所有元素特征峰向高结合能方向移动,可能是由于BiOBr和Na Nb O3之间形成了某种异质结,当光照时,复合催化剂BNN-10中BiOBr半导体单元中产生的光生电子(e-)会发生转移,实现了光生电子和空穴的高效分离,因此在价带上有更高密度的空穴(h+)形成,光催化氧化能力明显增强[9,10],正电荷的增加表现在XPS谱图中向高结合能方向移动.
图3(d)、(e)分别为纯NaNbO3和BNN-10的Na 1s 和Nb 3d 的特征峰,BNN-10 在结合能1071.59 eV 的单峰位置为NaNbO3的Na 1s特征峰[11].图3e中209.51 和206.74 e V 处的特征峰分别归因于Nb 3d3/2和Nb 3d5/2自旋分裂轨道,表明Nb是以Nb5+氧化态形式存在,这与文献中报道一致[12];图3(f)表明BNN-10中存在3种化学态的氧,其中529.75 eV 归因于NaNbO3中的晶格氧[13],531.39 e V 归因于BiOBr中的晶格氧,532.64 eV 归因于其表面吸附的氧[14].
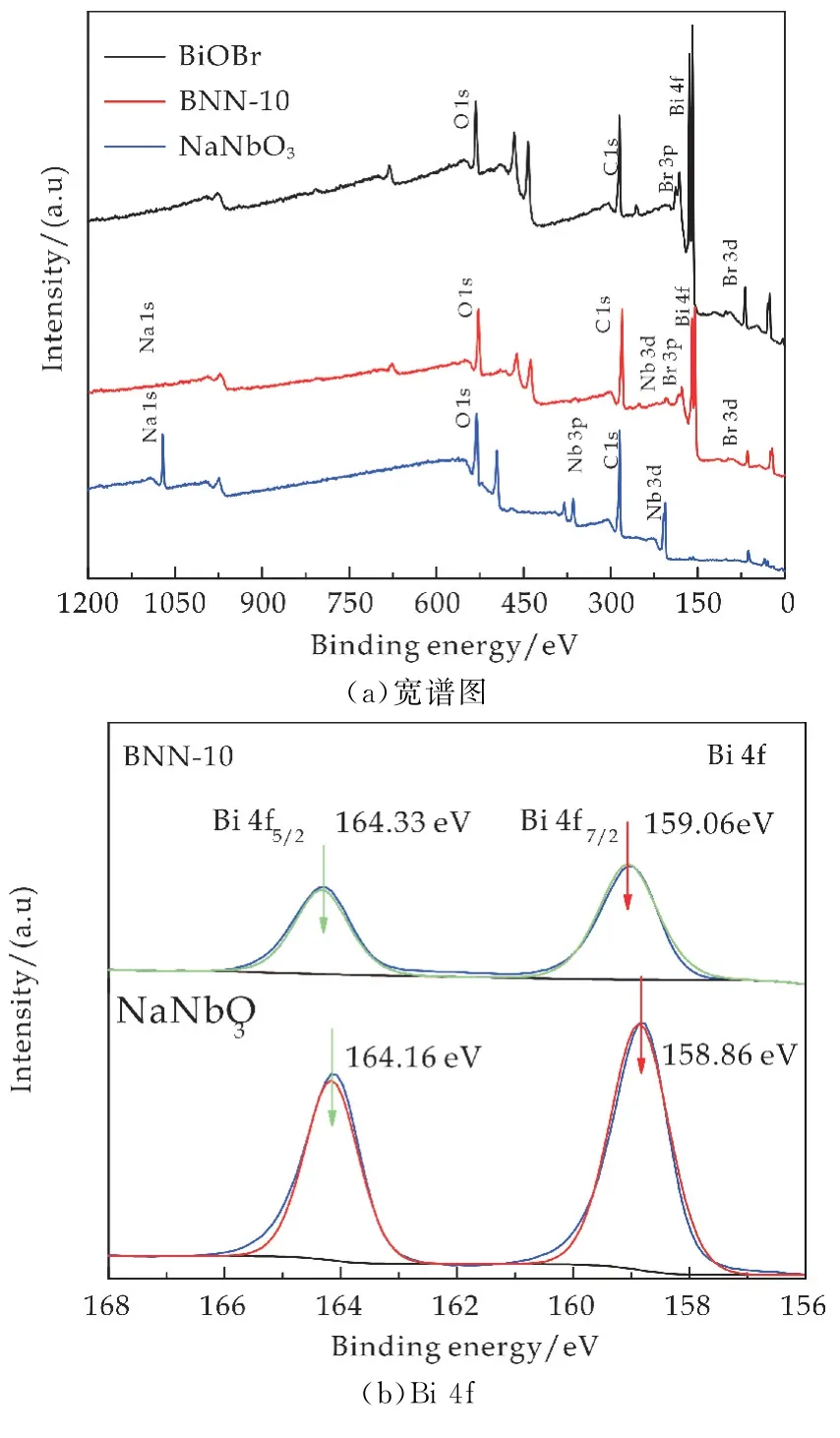
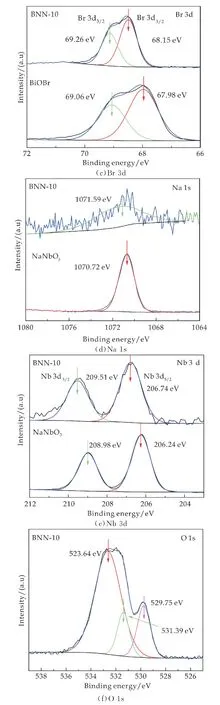
图3 不同催化剂的XPS谱图
2.4 紫外可见漫反射分析
从图4 可以看出,BiOBr和Na Nb O3的吸收边分别为455和406 nm,而BNN-10复合材料的吸收边缘为473 nm,与单一的BiOBr和Na Nb O3相比BNN-10吸收边缘发生红移,其可见光区吸收能力提高.可能是由于BNN 间异质结的形成提高了单一样品的可见光吸收,这将导致催化剂的光生电子-空穴对的产生更有效,从而在可见光照射下催化降解性能增强[15].

图4 不同催化剂的紫外可见漫反射曲线
BiOBr和Na Nb O3半导体的禁带宽度用公式Kubelka-Munk函数来计算:
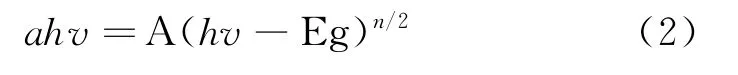
式(2)中:a—吸光系数;v—频率;h—普朗克常数;n—直接半导体n=2;间接半导体n=4;Eg—带隙值;A—常数.
由图5可知,得到BiOBr和Na Nb O3的带隙值分别为2.76[16]和3.28 e V[17],这与文献[16,17]报道的一致.
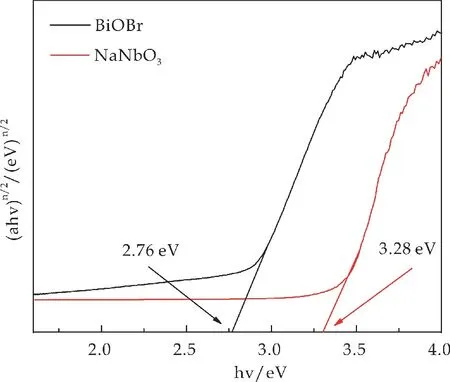
图5 纯BiOBr和Na Nb O3(ahv)n/2与能量(hv)关系曲线
图6为BiOBr和NaNbO3的莫特肖特基曲线.正斜率表明它们都是n型半导体[9],对于n型半导体而言,其平带电势大致等于其导带值[18].BiOBr和NaNbO3的平带电位(Efb)相对于NHE约为0.26和-0.55 e V.因此,BiOBr和Na Nb O3相对于NHE对应的EVB分别0.26和-0.55 eV.基于UV-Vis计算的带隙值结果(如图5所示),根据公式(3)计算得到BiOBr和NaNbO3相对于NHE的EVB分别为3.02和2.73 e V.二者具有匹配的能带结构,具备形成直接Z型异质结的条件.


图6 不同催化剂的莫特肖特基曲线
2.5 光催化性能分析
图7是在可见光照射下所制备的光催化剂样品对RhB降解的光催化活性实验曲线.由图7可知,在不添加光催化剂时,约5%的RhB 被降解,这主要归因于在光照后的自光解作用[3].纯NaNbO3在30 min 内表现出较差的降解率,仅为21.5%,对于纯BiOBr,在相同的反应时间内降解率约36.6%.BNN 复合光催化剂的光催化活性分别优于单一NaNbO3和BiOBr,随着BNN 复合材料中Na Nb O3含量的增加,Rh B 的光催化降解效率先提高,后降低.其中BNN-10 降解率最大,30 min内降解率达到87.8%,分别是单一的NaNbO3和BiOBr的4.1和2.4 倍.可能是由于复合后光催化剂异质结的形成,从而改善了可见光吸收并提高了光生电子-空穴对的分离效率[19].

图7 不同光催化剂降解RhB曲线
为了更好地了解Rh B 的光降解性能,通过准一级动力学方程(4)对光降解数据进行拟合:

式(4)中:k—反应速率常数(min-1);t—辐照时间(min);Ct和C0—辐照时间t和0 时的Rh B浓度(mg/L).
图8 所示的准一级动力学拟合结果表明,NaNbO3反应动力学常数k为0.008 05 min-1,反应速率最慢,BiOBr反应动力学常数k为0.015 01 min-1,BNN-10 反应动力学常数k为0.041 37 min-1.所有的BNN 复合材料都表现出比单相BiOBr和NaNbO3更高的光催化活性,即非均相结合有利于促进光生电子-空穴的分离[20].
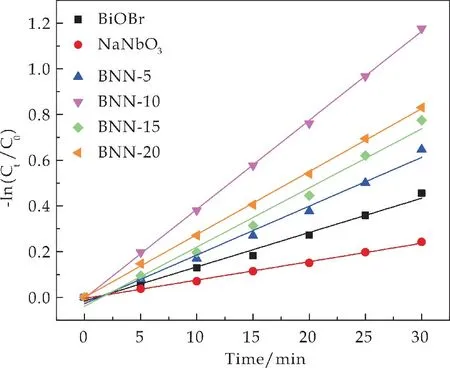
图8 光催化剂降解RhB的准一级动力学曲线
稳定性是光催化剂实际应用的关键,通过循环降解实验研究了BNN-10复合材料的可重复使用性.由图9可知,BNN-10在五个循环后仍保持较高的降解作用,表明其具有较好的稳定性.
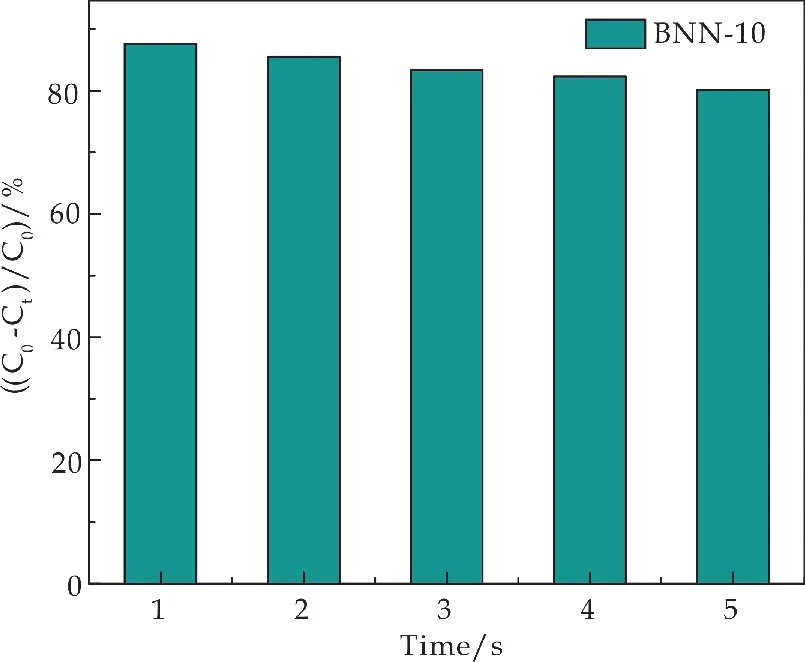
图9 BNN-10循环5次降解RhB的柱状图
2.6 光电性能分析
为了进一步阐明以上讨论的结果,对样品进行了光电流响应,电化学阻抗谱(EIS)和光致发光(PL)的表征.光催化剂的电荷分离效果可以通过瞬时光电流响应得到证实,在可见光照射下开-关几个周期的瞬态光电流响应如图10所示.由图可知,关灯时电流接近于零,但开灯光照时,电流密度急剧增加,光催化剂的光电流密度遵循BNN-10>BNN-20>BiOBr>NaNbO3的顺序,可能由于BNN 之间形成异质结,所有复合物BNN 光催化剂均显示出更高的光电流密度,光生空穴和电子的转移效率变高,寿命增加,光催化效果也增强.
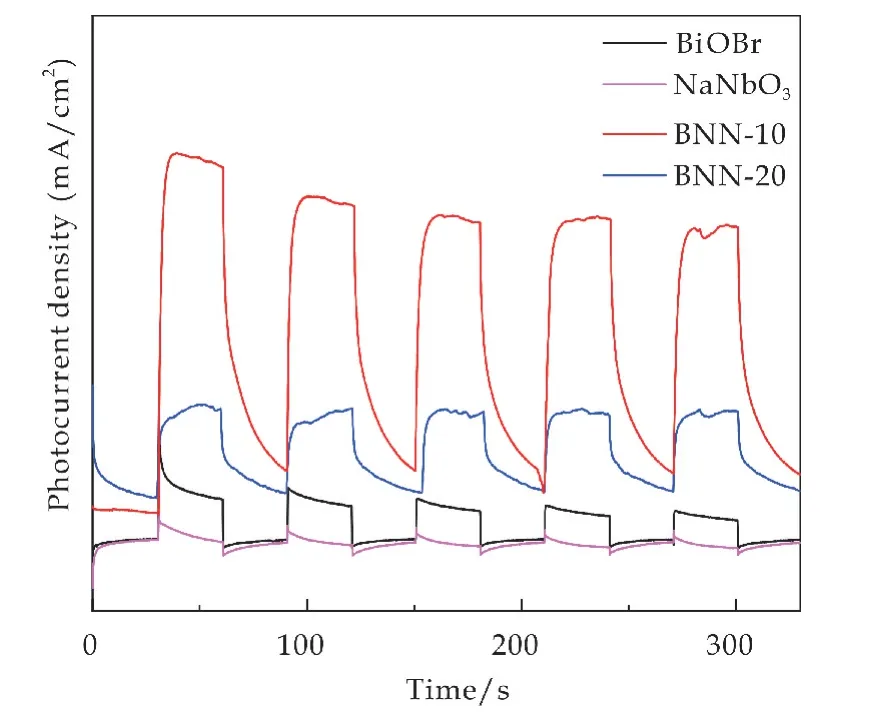
图10 不同光催化剂的光电流曲线
通常,奈奎斯特图的电弧曲线反应的是电子转移过程中受到的阻抗大小相关,与光生电子和空穴的分离效率有关.由图11可知,BNN-10具有最低的电阻,在电荷分离和电子转移方面的效率最高.这可能是由于BiOBr和NaNbO3之间的异质结构造成的.
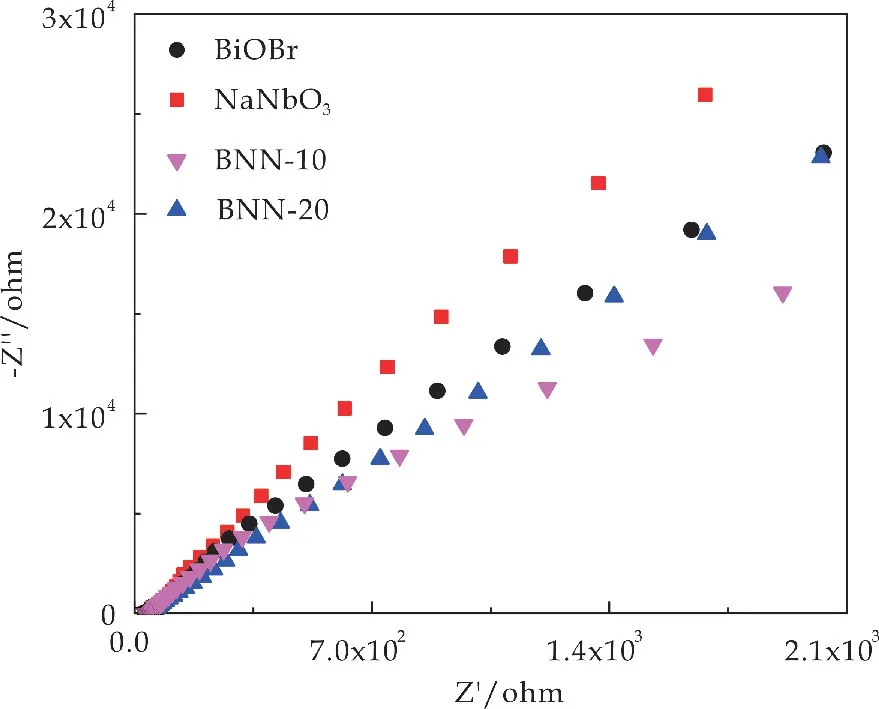
图11 不同光催化剂的EIS曲线
图12显示了不同催化剂的PL 光谱图用于研究半导体中光激发电子与空穴的复合程度.由图可知,在350 nm 激发波长下,光催化剂均表现出相似的发射曲线,发射峰集中在465 nm 附近,主要由于NaNbO3的局部状态和缺陷引起的[20].较低的PL强度表明激发电子和空穴的重组率较低,从而具有较高的光催化性能.与纯NaNbO3和BiOBr相比,BNN-10的光致发光强度明显最低,弱的PL强度表明光催化电子-空穴对的有效分离,具有较好的光催化能力.这一结果与光电流和EIS 测试结果吻合.
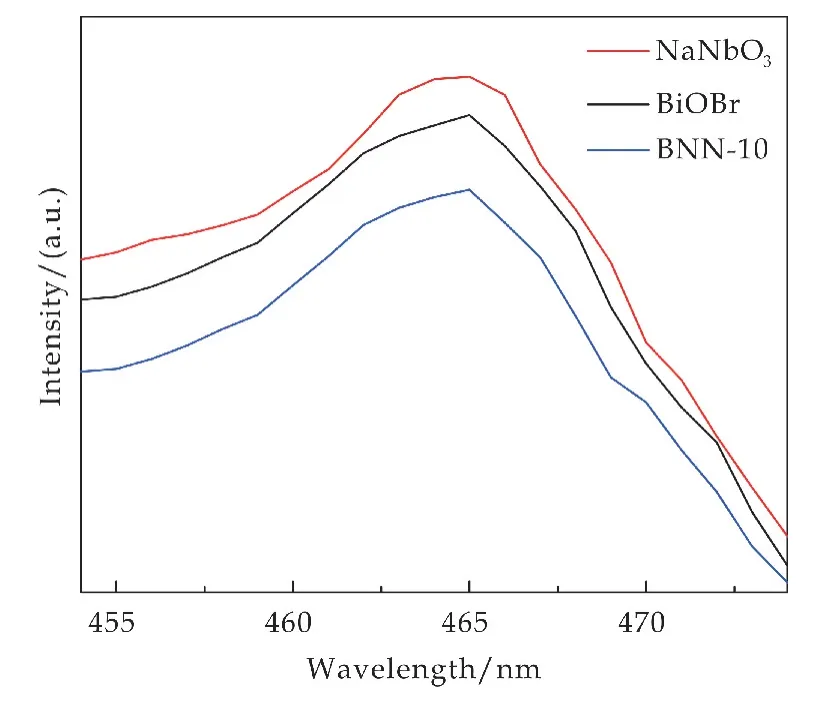
图12 不同光催化剂的PL曲线
2.7 光催化反应机理
对不同光催化剂进行活性物种捕获实验来探究光催化机理,将异丙醇(IPA)、草酸铵(AO)和1,4苯醌(BQ)分别用作·OH、h+和·O2-的猝灭剂,分别加入含有催化剂的溶液中.由图13可以看出,加入AO 后,光照后,BNN-10 的降解率从87.8%显著降低至33.21%,这表明h+在光催化过程中起着至关重要的作用.当加入BQ 时,降解率降低到50.31%,这表明·O2-是有助于光降解过程中的次要活性物质.另外,当加入IPA 作为·OH的猝灭剂时,降解的抑制作用不明显,表明只有少数·OH 自由基参与光降解反应.
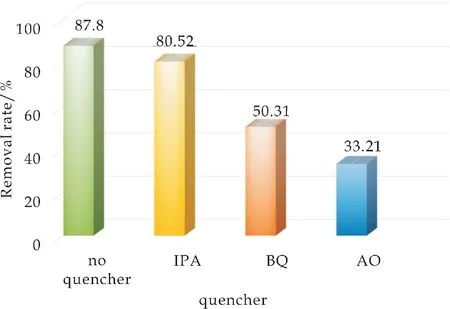
图13 BiOBr和NaNbO3捕获活性物种实验
基于以上讨论,提出了BNN 复合光催化材料降解RhB 的两种可能机理[21].光照后,纯BiOBr和Na Nb O3可以被激发产生光生电子和空穴.图14(a)中描述了传统Type-II型异质结载流子转移机制,若Na Nb O3的CB中光生电子转移到BiOBr的CB中,由 于BiOBr 的CB电 势(0.26 eV)比的电势低,因此溶解的O2不能被e-还原形成·当光生空穴从BiOBr的VB转移到Na Nb O3的VB中后,由于NaNbO3的VB电势(2.73 e V)与相近,只能勉强氧化少量·OH 自由基,但捕获实验中·和·OH 是参与降解的主要活性物质,所以排除了传统Type-II型异质结载流子转移机制.
该构型可能是另一种直接Z 型异质结,如图14(b)所示,光照后BiOBr的CB中的光生电子转移到NaNbO3的VB中,实现了载流子的高效分离,NaNbO3的CB和BiOBr的VB中积累了丰富的电子和空穴参与氧化还原反应.由于BiOBr的VB具有比H2O/·OH(2.72 eV)更大的正电势,Na Nb O3的CB的电势(-0.55 e V)比=-0.33 e V 具有更高的负电势,因此·OH 和自由基均易产生,这些活性物种具有较高的氧化还原能力来降解RhB,与捕获实验结论一致.故BNN 复合材料的高效降解能力依赖于形成的直接Z 型异质结体系的形成,该体系有效地提高了电荷分离效率,并最大程度保留了各自单一半导体较高的氧化和还原能力,提高了光催化活性.
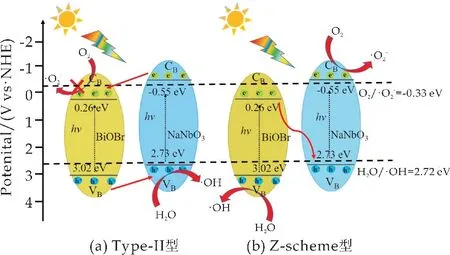
图14 BiOBr/NaNbO3复合催化剂机理图
3 结论
本研究采用简便的共沉淀方法成功的制备出一种新型BiOBr/NaNbO3(BNN)异质结纳米复合材料.BNN 复合纳米材料比纯BiOBr和Na Nb O3表现出对降解RhB更优异的光催化活性.BNN 优异的光催化活性可归因于BiOBr和Na Nb O3之间形成的直接Z 型异质结,从而增强了光的捕获能力,拓宽了光吸收波长范围,加快了光生载流子的传输速率,并提高了氧化还原能力.捕获实验表明,h+和均可导致有机污染物的有效降解和矿化.
此外,制备的BiOBr/NaNbO3光催化剂在经过五次循环运行后,表现出了较高的光催化稳定性.这些发现可能会为可见光驱动的铋基半导体异质结复合材料的构建提供新的思路和技巧.该复合材料可用于水环境中有机污染物的光降解.

