不同提取方法对茯茶多糖理化性质和抗氧化作用的影响
孙玉姣,马芸皓,王 凡,袁旭霜,徐 洋,张 楠,王建康
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
0 引言
中国拥有丰富的茶叶资源,对茶叶资源的综合开发利用一直受到人们的关注.茯砖茶(Fu Brick tea)是中国的传统发酵黑茶,起源于陕西泾阳,历史悠久,是所有茶类中加工工艺最复杂、生产加工周期最长、工艺最独特的产品,有降血压、抗氧化、保护肝脏、抗肿瘤、免疫调节等保健功能,被誉为“中国古丝绸之路上神秘之茶、西北各民族生命之茶”.茯砖茶中含有丰富的茶多酚和茶多糖.茶多酚是形成茶叶色香味的主要成分之一,目前对茯砖茶的研究多集中于黄烷醇、黄酮、儿茶素、花色苷和酚酸等茶多酚[1,2].茶多糖(Tea Polysaccharide)是茶叶中一种重要的功能性大分子物质,具有多种生物活性,其保健功效随着茶叶在医药、保健和食品加工等方面的广泛应用而受到越来越多的关注.茶多糖的组成与含量因茶叶品种、采摘季节及加工工艺的不同而异,乌龙茶中茶多糖的含量高于红茶和绿茶.此外,原料越老,茶多糖的含量也越高,而黑茶多使用的原料较老,预期黑茶中拥有丰富的多糖资源[3].然而,目前对黑茶多糖,尤其是茯砖茶多糖的研究尚处于起步阶段[4,5].
已有研究表明,采用不同提取方法可得到具有不同物理化学性质、理化性质和生物活性的多糖分子[6].热水提取法是最常用的方法,该方法具有简单、方便、成本低等优点,缺点是耗时长、产率低;而采用酸液或碱液辅助热水提取多糖可以提高多糖的溶解性和提取率[7-9].当前研究主要集中于茯茶多糖的热水提取,而采用酸法或碱法制备茯茶多糖的研究鲜有报道.据此,本研究分别采用水提法、酸法和碱法等不同方法提取茯茶多糖,并比较其理化性质和抗氧化作用,为进一步探讨茯茶多糖结构与功能之间的关系以及茯茶资源的深加工提供理论依据.
1 材料与方法
1.1 材料与仪器
1.1.1 主要材料与试剂
茯砖茶,购于陕西省泾阳茯茶镇,粉碎后过60目筛,备用;葡聚糖标准品(相对分子质量分别为5、12、25、50、80 和150 k Da),购 于 美 国Sigma-Aldrich 公司;单糖标准品(Rha、Rib、Xyl、Ara、Man、Glc和Gal)、吩嗪硫酸甲酯(PMS)、还原态烟酰胺腺嘌呤二核苷酸(NADH)、氯化硝基四氮唑(NBT)、1,1-二苯基-2-苦基肼(DPPH)、铁氰化钾([K3Fe(CN)6])和2,4,6-三吡啶三嗪(TPTZ),购于上海阿拉丁生化科技股份有限公司;其余试剂均为国产分析纯.
1.1.2 主要仪器
UV-2600系列分光光度计,尤尼柯(上海)仪器有限公司;DF-101S 集热式恒温加热磁力搅拌器,巩义市予华仪器责任有效公司;BS-100A 自动部分收集器,上海沪西分析仪器厂有限公司;气相色谱仪、高效液相色谱仪配备2414示差折光检测器,日本岛津公司;气相色谱柱Rtx-5MS(30.0 m×0.25 mm ×0.25μm),美国Restek公司;液相色谱柱TSK-gel G4000SW(7.5 mm×30.0cm),日本Tosoh公司;FEI Q45环境扫描电子显微镜;美国FEI公司.
1.2 茯茶多糖的提取与制备
1.2.1 水提法
参照Sun等[9]的方法并加以改进,称取20 g茯茶粉,加入2 000 mL 蒸馏水,在60 ℃下水浴搅拌4 h,过滤,收集上清液浓缩至50 mL.滤渣再重复提取2次,合并提取液.加入4倍体积的95%乙醇,在4℃下放置过夜,离心,取沉淀溶于50 mL蒸馏水.采用Sevag试剂(氯仿∶正丁醇=4∶1,v/v)除蛋白,收集水层透析,并浓缩、冻干,得到茯茶水提多糖,命名为FTWP.
1.2.2 酸提法
参照Sun等[9]的方法并加以改进,称取20 g茯茶粉,加入2 000 mL 1%(w/v)的柠檬酸水溶液,使溶液pH 稳定在2.0,其余步骤参照水提法,得到茯茶酸提多糖,命名为FTAcP.
1.2.3 碱提法
参照Sun等[9]的方法并加以改进,称取20 g茯茶粉,加入2 000 mL 1%(w/v)的Na OH 水溶液,使溶液pH 稳定在10.0,其余步骤参照水提法,得到茯茶碱提多糖,命名为FTAlP.
1.3 茯茶多糖的理化性质分析
1.3.1 中性糖含量测定
采用苯酚-硫酸法[10].将FTWP、FTAcP 和FTAlP 配制成浓度为0.2 mg/m L的溶液,吸取各样品溶液0.1 mL,补水至2.0 mL,依次加入50μL的80%(w/v)苯酚溶液和2.5 mL的浓硫酸,室温静置20 min后,490 nm 测定光吸收值.2 mL的蒸馏水作为空白对照,按照上述方法操作.以葡萄糖为标准,绘制标准曲线,根据回归方程计算各个样品的中性糖含量.
1.3.2 糖醛酸含量测定
采用间羟联苯法[11].将FTWP、FTAcP 和FTAlP 配制成浓度为0.2 mg/m L的溶液,吸取各样品溶液0.1 mL,补水至0.25 mL,依次加入1.5 mL的0.012 5 mol/L四硼酸钠硫酸溶液,振摇混匀,沸水浴中加热5 min后,冷却至室温,加入25μL 的0.15%(w/v)间羟联苯溶液,520 nm 测定光吸收值.0.25 mL的蒸馏水作为空白对照,按照上述方法操作.以葡萄糖醛酸为标准,绘制标准曲线,根据回归方程计算各个样品的糖醛酸含量.
1.3.3 相对分子质量测定
采用高效凝胶渗透色谱法(high-performance gel-permeation chromatography,HPGPC)[12].将FTWP、FTAcP 和FTAlP 配制成浓度为5 mg/m L的溶液,进样10μL,流动相为磷酸盐缓冲液(0.02 mol/L,pH 6.0),流速为0.5 mL/min,柱温箱和检测器温度均为30℃,测定保留时间.以不同分子量葡聚糖为标准,绘制标准曲线,根据回归方程计算各个样品的相对分子质量.
1.3.4 中性单糖组成分析
采用气相色谱法(Gas chromatography,GC)[12].各取FTWP、FTAcP 和FTAlP 2 mg溶于2 mL的2 mol/L TFA,在121 ℃下加热2 h.冷却后,用1 mol/L NaOH 中和,减压蒸干.加入4%(w/v)硼氢化钠(NaBH4),摇匀后,室温静置1.5 h,缓慢滴加200μL的冰乙酸,结束反应,加入0.1%(v/v)甲醇/HCl溶液,减压蒸干,除去过量的硼酸盐.依次加入1 mL吡啶和1 mL 乙酸酐,摇匀,沸水浴中反应30 min,反应结束后,减压蒸干.加入1 mL三氯甲烷和1 mL蒸馏水对样品萃取,弃水相,保留三氯甲烷相,重复三次,取有机相进行GC分析.
GC分析条件:以N2作载气,流速0.6 mL/min,分流比19∶1,进样量0.5μL,进样口温度270℃,检测器温度280℃.柱升温条件:180℃(2 min)6℃/min 210℃0.3℃/min 215℃6℃/min 240℃(30 min).七种单糖(Rha、Rib、Ara、Xyl、Man、Glc和Gal)作为标准,进行同样的衍生化处理和GC分析.
1.3.5 分子形貌分析
分别取大小厚度合适的FTWP、FTAcP 和FTAlP样品粘着于载物台,放置于真空喷镀仪内镀一层导电金膜后,采用扫描电镜(Scanning electron microscope,SEM)进行观察.
1.4 茯茶多糖的抗氧化作用分析
1.4.1 羟自由基清除能力的测定
分别称取FTWP、FTAcP和FTAlP配制成2.5mg/mL的溶液,稀释为0.25 mg/mL、0.50 mg/mL、1.00 mg/mL、1.50 mg/mL和2.00 mg/mL的样品待测液.采用水杨酸比色法[13],取1 mL不同浓度的待测液,依次加入1 mL的9 mmol/L FeSO4溶液、1 mL的9 mmol/L水杨酸-乙醇溶液和1 mL 的8.8 mmol/L H2O2,混匀,37℃下水浴30 min,冷却后,510 nm 测定光吸收值.待测样品对羟自由基的清除能力按照下列公式(1)进行计算:
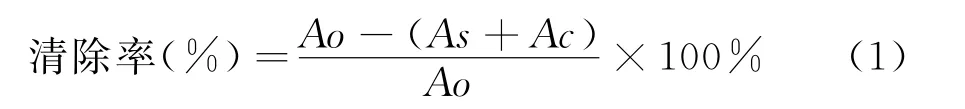
式(1)中:Ao-以H2O 代替待测液加入水杨酸比色试剂的吸光值,As-待测液加入水杨酸比色试剂的吸光值,Ac-待测液不添加水杨酸比色试剂的吸光值.
1.4.2 超氧阴离子自由基清除能力的测定
分别称取FTWP、FTAcP 和FTAlP 配制成2.5 mg/mL的溶液,稀释为0.25 mg/mL、0.50 mg/mL、1.00 mg/mL、1.50 mg/mL和2.00 mg/mL的样品待测液.采用PMS-NADH 系统,考察待测样品对超氧阴离子自由基的清除能力[14].所使用的药品都需要先用0.1 mol/L磷酸盐缓冲液(pH 7.4)配制,然后取1mL的待测液,分别加入1 mL的30μmol/mL PMS、1 mL 的338μmol/mL NADH和1 mL的72μmol/mL NBT,摇匀,室温放置5 min后,560 nm测定光吸收值.待测样品对超氧阴离子自由基的清除能力按照上述公式(1)进行计算;其中Ao-以磷酸盐缓冲液代替待测液加入PMSNADH系统试剂的吸光值,As-待测液加入PMSNADH系统试剂的吸光值,Ac-待测液不添加PMSNADH系统试剂的吸光值.
1.4.3 DPPH 自由基清除能力的测定
分别称取FTWP、FTAcP 和FTAlP 配制成2.5 mg/mL的溶液,稀释为0.25 mg/mL、0.50 mg/mL、0.75 mg/mL、1.00 mg/mL和1.25 mg/mL的样品待测液.将DPPH溶于甲醇,配制成0.2 mmol/L的DPPH溶液.取1 mL不同浓度的样品待测液,加入2 mL配制好的DPPH溶液与2 mL甲醇,摇匀,室温下避光反应15 min后,517 nm测定光吸光值[14].待测样品对DPPH自由基的清除能力按照上述公式(1)进行计算;其中Ao-以H2O代替待测液加入DPPH 溶液的吸光值,As-待测液加入DPPH 溶液的吸光值,Ac-待测液不添加DPPH溶液的吸光值.
1.4.4 还原力的测定
将不同提取方法提取的多糖配制成2.5 mg/mL的溶液,并稀释为0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL、0.6 mg/mL的样品待测液.取不同浓度的样品溶液1 mL,加入1 mL的0.2 mol/L磷酸盐缓冲液(p H=6.6)和0.125 mL的1%(w/v)的铁氰化钾溶液,在50℃下水浴反应20 min后,依次加入0.125 mL的10%(w/v)的三氯乙酸终止反应,最后加入1.5 mL的0.1%(w/v)FeCl3显色,摇匀后,700 nm测定吸光值,吸光值越高代表寡糖的还原能力越强[15].空白参比为蒸馏水代替样品溶液.
1.4.5 亚铁离子螯合能力的测定
分别称取FTWP、FTAcP 和FTAlP配制成2.5 mg/mL的溶液,稀释为0.25 mg/mL、0.50 mg/mL、1.00 mg/mL、1.50 mg/mL和2.00 mg/mL的样品待测液.取200μL待测液,依次加入3 mL甲醇和200μL的2 mmol/L FeCl2溶液,混匀后室温反应5 min,加入400μL的5 mmol/L 2,4,6-三吡啶三嗪(TPTZ)溶液,混匀后室温反应10 min,562 nm测定光吸光值[16].待测样品对亚铁离子的螯合能力按照下列公式(2)进行计算:
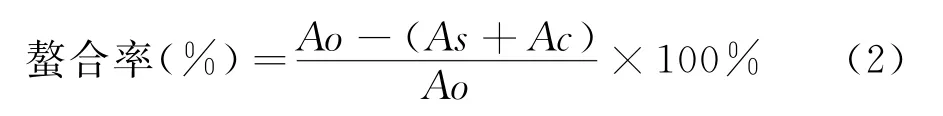
式(2)中:Ao-以H2O 代替待测液加入螯合试剂的吸光值,As-待测液加入螯合试剂的吸光值,Ac-待测液不添加螯合试剂的吸光值.
1.5 数据处理与分析
所有实验都进行三次重复,实验结果采用Origin 8.0和SPSS 22.0软件进行处理和方差分析,并采用LSD 法对各组间的差异进行多重比较.
2 结果与讨论
2.1 水提、酸提和碱提茯茶多糖的制备及其中性糖含量和糖醛酸含量比较
三种方法制备的茯茶多糖得率、中性糖含量和糖醛酸含量见表1.相比于水提法,酸提法和碱提法可不同程度提高茯茶多糖的得率;并且,水提茯茶多糖(FTWP)、酸提茯茶多糖(FTAcP)和碱提茯茶多糖(FTAlP)的化学组成均有一定的差别,其中酸提茯茶多糖(FTAcP)的中性糖含量最高,为65.58%±1.66%;碱提茯茶多糖(FTAlP)的糖醛酸含量最高,为29.76%±0.83%;由此可见,碱提法更有助于制备富含糖醛酸的酸性多糖.此外,水提茯茶多糖(FTWP)、酸提茯茶多糖(FTAcP)和碱提茯茶多糖(FTAlP)的蛋白含量较低,分别为1.50%±0.61%、3.95%±0.22%和6.80%±0.42%.
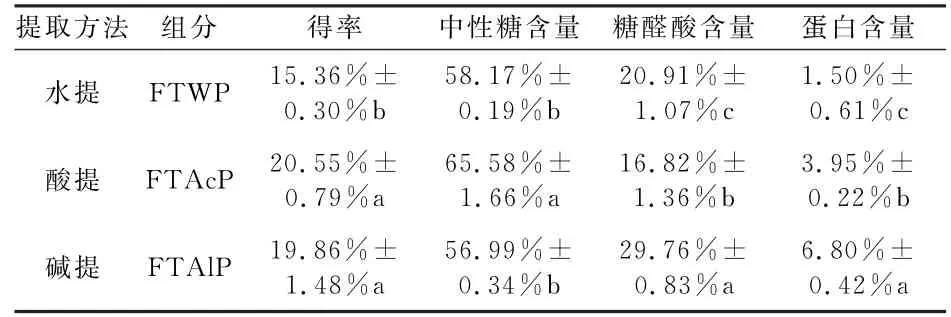
表1 茯茶多糖的得率和化学组成比较
2.2 水提、酸提和碱提茯茶多糖的相对分子质量比较
利用高效凝胶渗透色谱法(HPGPC)对水提茯茶多糖(FTWP)、酸提茯茶多糖(FTAcP)和碱提茯茶多糖(FTAlP)的相对分子质量进行测定,结果如图1所示.根据葡聚糖标准品(相对分子质量分别为5、12、25、50、80 和150 k Da)绘制的标准曲线,得到的线性回归方程是:y=-0.178 6x+8.189 6,R2=0.999 9;根据保留时间,计算可得FTWP、FTAcP 和FTAlP 的相对分子质量分别为4.78×105±1.92 Da、4.70×105±2.81Da和4.68×105±1.51Da,没有表现出显著性差异.
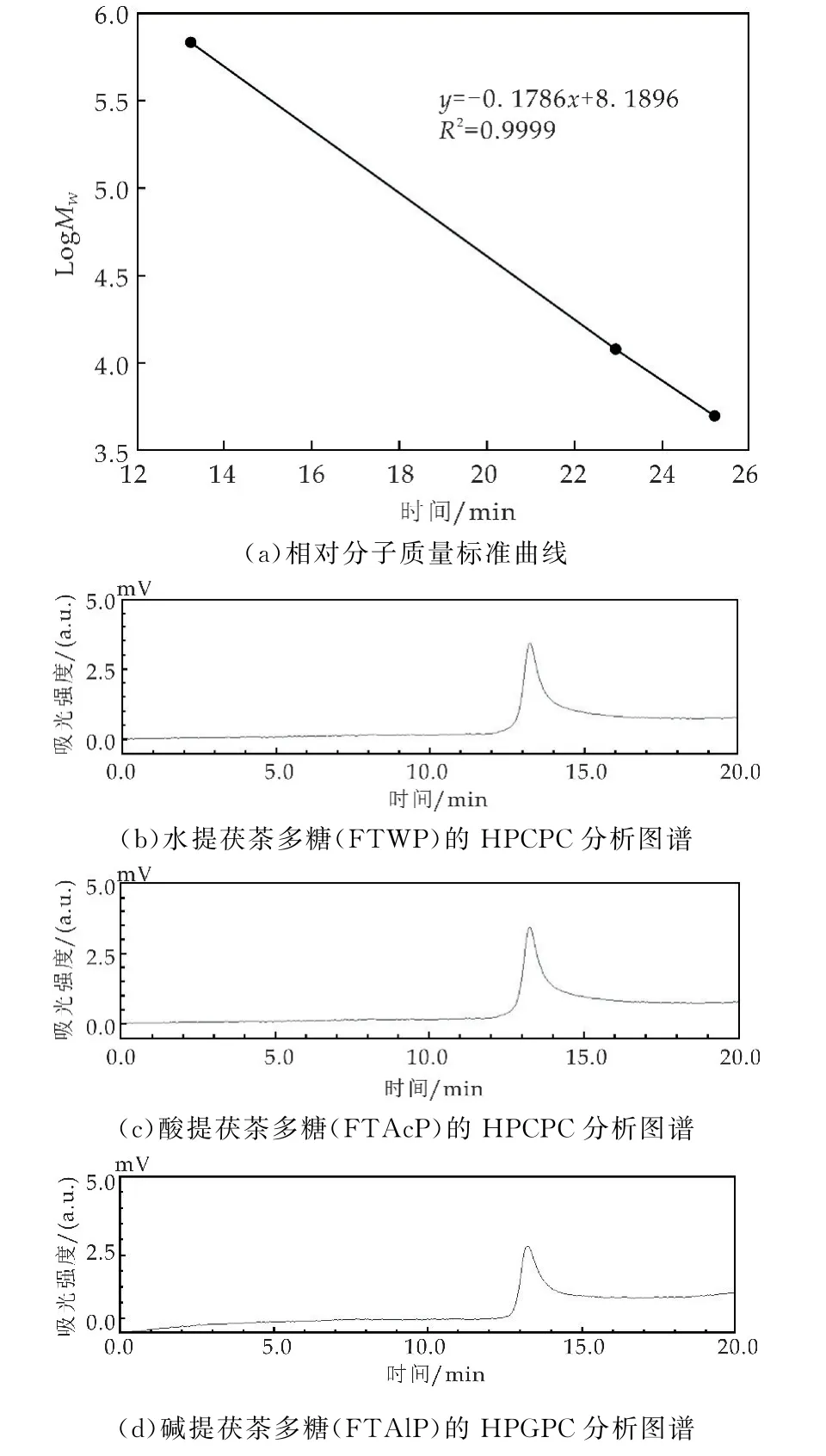
图1 茯茶多糖的相对分子质量比较
2.3 水提、酸提和碱提茯茶多糖的中性单糖组成比较
利用气相色谱法(GC)对水提茯茶多糖(FTWP)、酸提茯茶多糖(FTAcP)和碱提茯茶多糖(FTAlP)的中性单糖组成进行测定,结果如图2所示.依据单糖标准品的出峰时间确定,水提茯茶多糖(FTWP)、酸提茯茶多糖(FTAcP)和碱提茯茶多糖(FTAlP)均是由鼠李糖(Rha)、阿拉伯糖(Ara)、甘露糖(Man)、葡萄糖(Glc)和半乳糖(Gal)组成,但是峰面积由明显差异.根据其峰面积和响应因子,计算各个单糖的摩尔百分比可得,水提茯茶多糖(FTWP)、酸提茯茶多糖(FTAcP)和碱提茯茶多糖(FTAlP)中Rha∶Ara∶Man∶Glc∶Gal的摩尔比例分别为1.58∶2.41∶1∶1.97∶3.89;1.24∶2.04∶1∶4.58∶3.09和1.21∶2.16∶1∶3.80∶3.14.由此可见,酸提法和碱提法可能会影响茯茶多糖的单糖组成,提高了多糖中Glc的含量.
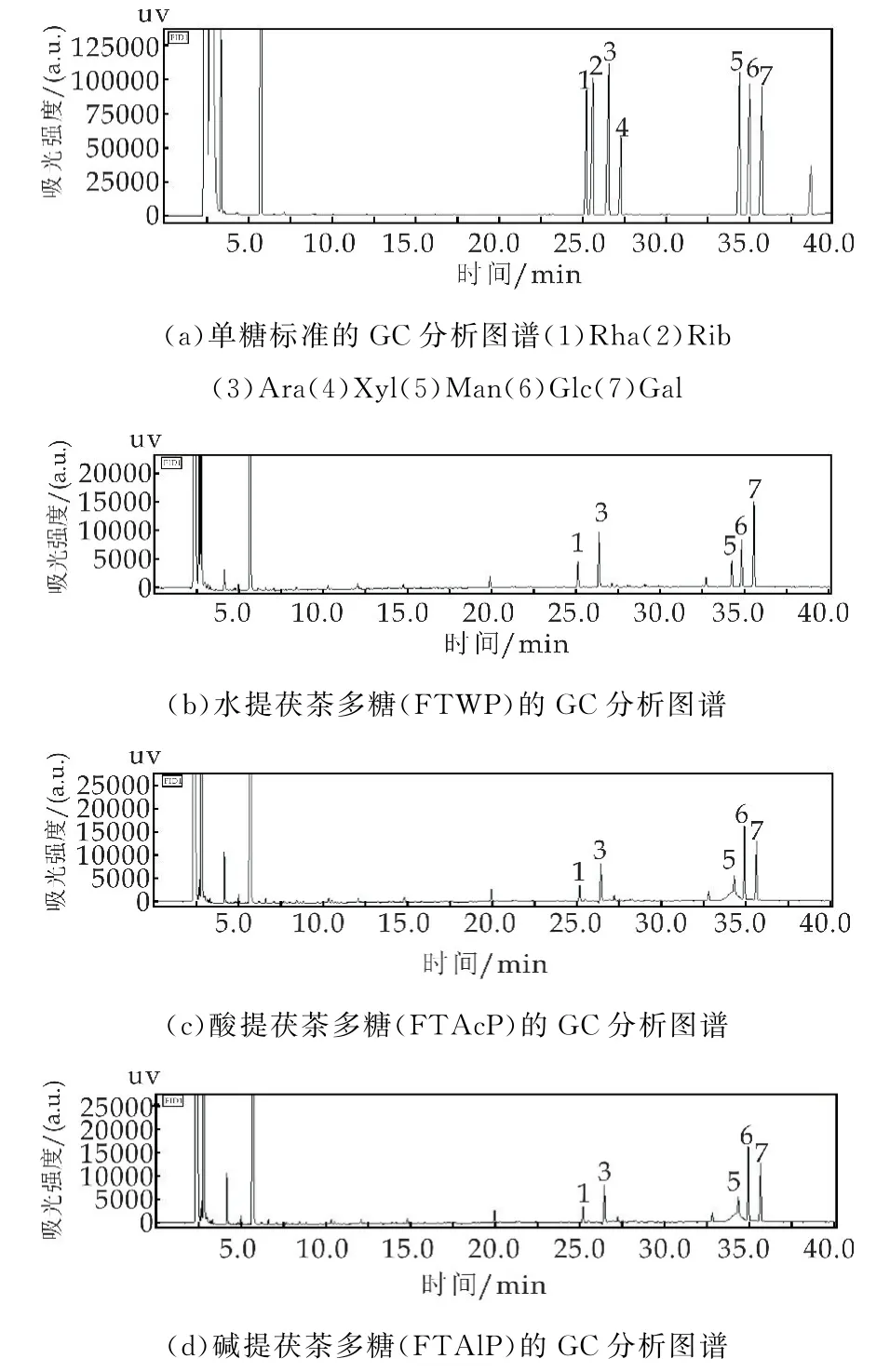
图2 不同提取方式茯茶多糖的单糖组成比较
2.4 水提、酸提和碱提茯茶多糖的分子形貌比较
利用扫描电镜(SEM)分别在500 倍和4 000倍放大倍数下观察水提茯茶多糖(FTWP)、酸提茯茶多糖(FTAcP)和碱提茯茶多糖(FTAlP)的分子形貌,结果如图3所示.结果显示,三种方法提取的茯茶多糖主要以不规则的片状结构为主体,但FTWP 的边缘呈现出不规则的锯齿状结构;相较于FTWP,FTAcP和FTAlP的表面和边缘更加平整光滑,边缘的锯齿状结构明显减少;此外对比FTAcP和FTAlP发现,FTAlP 的表面更加致密,并且还观察到大小不均一的杆柱状形态.由此可见,酸提法和碱提法可能会影响茯茶多糖的微观分子形貌.

图3 不同提取方法茯茶多糖的分子形貌比较
2.5 水提、酸提和碱提茯茶多糖对羟自由基的清除能力比较
如图4所示,在0.25~2 mg/m L 的浓度范围内,水提茯茶多糖(FTWP)、酸提茯茶多糖(FTAcP)和碱提茯茶多糖(FTAlP)的清除率随着多糖质量浓度的增加而呈现出不同程度的增加.当FTWP的浓度达到2 mg/m L时,其对羟自由基的清除能力达到81.01%±0.69%,是FTWP 在0.25 mg/m L浓度时清除率(68.57%±0.43%)的1.18 倍.而相比于FTWP,在此浓度范围内FTAcP和FTAlP 对羟自由基的清除能力均显著低于FTWP 的清除率(***p<0.001).当多糖浓度达到2 mg/m L 时,FTAcP 和FTAlP对羟自由基的清除能力分别为59.68%±0.39%和64.13%±0.36%,比FTWP 对羟自由基的清除能力分别降低了0.26倍和0.21倍.
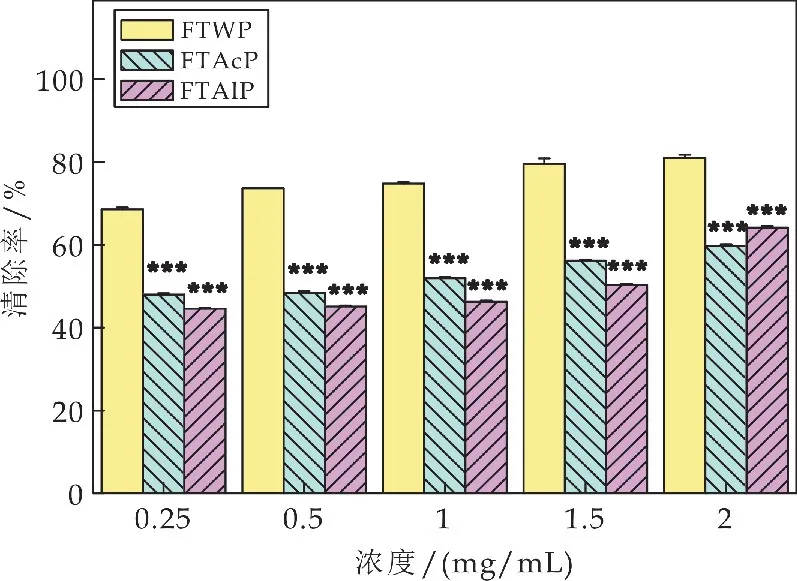
图4 茯茶多糖对羟自由基的清除能力比较(相同浓度下FTAcP、FTAlP同FTWP的比较,*p<0.05、**p<0.01和***p<0.001)
2.6 水提、酸提和碱提茯茶多糖对超氧阴离子自由基的清除能力比较
如图5所示,在0.25~1.5 mg/m L 的浓度范围内,水提茯茶多糖(FTWP)、酸提茯茶多糖(FTAcP)和碱提茯茶多糖(FTAlP)的清除率随着多糖质量浓度的增加而增大;而当多糖浓度增加至2 mg/m L时,FTWP、FTAcP和FTAlP对超氧阴离子自由基的清除能力反而下降.当FTWP 的浓度达到1.5 mg/m L 时,其对超氧阴离子自由基的清除能力达到67.86%±3.99%,是FTWP 在0.25 mg/m L浓度时清除率(54.91%±5.56%)的1.24倍.而相比于FTWP,FTAlP在2 mg/m L 时的清除率为76.52%±4.43%,显著高于FTWP在此浓度时的清除率(*p<0.05).
2.7 水提、酸提和碱提茯茶多糖对DPPH 自由基的清除能力比较
如图6所示,在0.25~2 mg/m L 的浓度范围内,酸提茯茶多糖(FTAcP)随着多糖质量浓度的增加而呈现出不同程度的增加.在0.25~1.5 mg/m L的浓度范围内,水提茯茶多糖(FTWP)和碱提茯茶多糖(FTAlP)的清除率随着多糖质量浓度的增加而增大;而当多糖浓度增加至2 mg/mL 时,FTWP 和FTAlP 对DPPH 自由基的清除能力反而下降.当多糖浓度仅为0.25 mg/mL时,FTAlP 对DPPH 自由基的清除能力达到71.81%±1.01%,显著高于FTWP在此浓度时的清除率(52.38%±4.93%;***p<0.001),在低浓度时表现出良好的清除能力.
2.8 水提、酸提和碱提茯茶多糖的还原能力比较
还原力是评价物质抗氧化作用的一个重要指标,吸光值越大,表明还原性越高[17].如图7所示,在0.1~0.5 mg/m L 的浓度范围内,水提茯茶多糖(FTWP)、酸提茯茶多糖(FTAcP)和碱提茯茶多糖(FTAlP)的还原力随着多糖质量浓度的增加而增大.当FTWP的浓度达到0.5 mg/m L 时,其还原力为0.98±0.00,是FTWP 在0.1 mg/m L浓度时还原力(0.13±0.00)的7.54倍.而相比于FTWP,在此浓度范围内FTAcP的还原力均显著高于FTWP的还原力(***p<0.001);当FTAcP仅为0.1 mg/m L时,其还原力为0.64±0.04,是FTWP还原力(0.13±0.00)的4.92倍;当FTAcP浓度达到0.5 mg/m L 时,其还原力高达2.31±0.03,是FTWP还原力(0.98±0.00)的2.36倍.此外,通过对比FTAlP 和FTWP 发现,在0.2~0.5 mg/m L的浓度范围内,FTAlP的还原力显著高于FTWP的还原力(***p<0.001);当FTAlP浓度达到0.5 mg/m L 时,其还原力高达2.23±0.03,是FTWP还原力(0.98±0.00)的2.28倍.
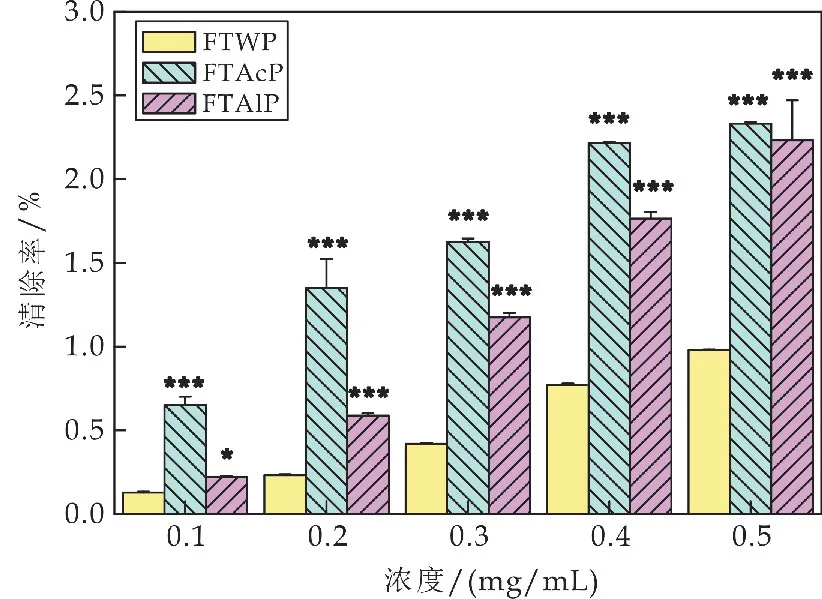
图7 茯茶多糖的还原能力比较(相同浓度下
2.9 水提、酸提和碱提茯茶多糖对亚铁离子的螯合能力比较
亚铁离子具有很强的助氧化活性,因此通过鳌合亚铁离子,降低物质中亚铁离子的浓度,可避免或降低其氧化活性[18].如图8所示,在0.25~1.5 mg/mL的浓度范围内,水提茯茶多糖(FTWP)对亚铁离子的螯合能力随着多糖质量浓度的增加而增大;在0.25~2 mg/mL的浓度范围内,酸提茯茶多糖(FTAcP)和碱提茯茶多糖(FTAlP)对亚铁离子的螯合能力随着多糖质量浓度的增加而增大.在0.25~1 mg/mL的浓度范围内,FTAcP 对亚铁离子的螯合能力显著高于FTWP的螯合能力(***p<0.001);在0.25~0.5 mg/mL的浓度范围内,FTAlP 对亚铁离子的螯合能力显著高于FTWP的螯合能力(***p<0.001);在较低浓度时,FTAcP 和FTAlP 均表现出更为优越的螯合能力.
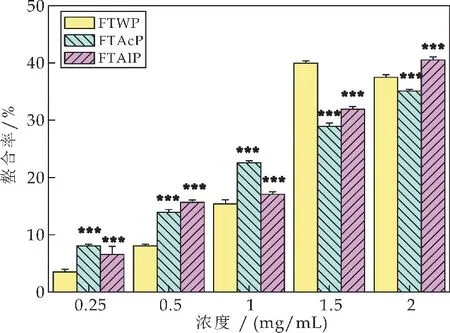
图8 茯茶多糖对亚铁离子的螯合能力比较(相同浓度下FTAcP、FTAlP 同FTWP的比较,*p<0.05、**p<0.01和***p<0.001)
已有研究表明,酸性条件或碱性条件能破坏细胞壁,促使胞内多糖或细胞壁结合多糖的溶出,显著提高多糖的得率;此外,碱提法可提高酸性多糖的溶解性,使得植物细胞中更多的酸性多糖溶出,显著提高酸性多糖的占比[19].本研究同样发现酸提法和碱提法可明显提高茯茶多糖的得率,并且碱提茯茶多糖具有较高的糖醛酸含量.葡萄糖、糖醛酸结构的存在可能提高多糖的抗氧化活性[9,19,20].
通过上述抗氧化评估研究发现,酸提法和碱提法制备茯茶多糖并不会破坏多糖的抗氧化作用.在较低浓度范围内,酸提茯茶多糖(FTAcP)和碱提茯茶多糖(FTAlP)表现出更加显著的对超氧阴离子自由基、DPPH 自由基的清除能力,还原力和对亚铁离子的螯合能力,提示酸提茯茶多糖和碱提茯茶多糖具有良好的抗氧化作用,这可能归功于酸提茯茶多糖具有较高的Glc含量,碱提茯茶多糖具有较高的糖醛酸含量.基于此,后续研究将通过解析水提茯茶多糖(FTWP)、酸提茯茶多糖(FTAcP)和碱提茯茶多糖(FTAlP)的精细结构,深入探索茯茶多糖抗氧化作用的构效关系.
3 结论
本文采用水提法、酸法和碱法等三种不同方法提取茯茶多糖,并初步分析其化学组成、相对分子质量、单糖组成、分子形貌和体外抗氧化作用.结果表明,水提茯茶多糖、酸提茯茶多糖和碱提茯茶多糖的理化性质和抗氧化作用具有明显差异.酸提茯茶多糖的葡萄糖含量最高,碱提茯茶多糖的糖醛酸含量最高,促使酸提茯茶多糖和碱提茯茶多糖在较低浓度时表现出良好的抗氧化作用.通过研究不同提取方法对茯茶多糖的理化性质和抗氧化作用的影响,可为茯茶多糖结构与功能之间的关系研究提供一定的理论参考,有助于茯茶资源的深入开发利用.

