微藻胞外聚合物与棕鞭藻絮凝效率的关系
张安龙,文 然,苏琰儒,张 波*
(1.陕西科技大学 教育部轻化工助剂化学与技术重点实验室,陕西 西安 710021;2.山西大同大学 医学院,山西 大同 037000)
0 引言
微藻是一类能进行光合作用的自养微生物,具有个体微小、分布广泛、油脂含量高、不占用耕地等特点,被广泛认为是最具前景的生物柴油原料[1].微藻可以在各种污水中生长,直接降低二、三级出水中N、P等污染物的含量,利用污水培养微藻可在降低微藻培养成本的同时实现废水的净化与资源化利用[2].
微藻个体微小,细胞直径一般为5~50μm[3],藻细胞表面带有负电荷,细胞间存在静电斥力,在水体中处于稳定悬浮的状态,从而导致微藻细胞采收难度大[4].现阶段,微藻生物质采收的方法主要包括离心法、重力沉降法、絮凝法等.其中,絮凝法被认为是实现大规模收获微藻的最佳方法.絮凝法是通过电中和、架桥或网捕作用,使分散的带电荷藻细胞聚集到一起,进而实现固液分离[5].以铝盐为代表的多价金属盐类是微藻絮凝中应用最早的外加絮凝剂[6].影响微藻絮凝的因素主要包括藻细胞属性、p H、营养环境.不同环境下微藻分泌的胞外有机物(AOM)产量与组分差异较大[7],AOM的组分主要为多糖和蛋白质,它们会与藻细胞竞争有限的絮凝剂,从而对絮凝效果产生影响[8].
棕鞭藻属于金藻门,金胞藻目,棕鞭金藻科,棕鞭藻属;无细胞壁;个体微小;在污水环境中具有较高的生长效率[9].张波等[7]研究表明棕鞭藻在不同营养环境中自絮凝效率存在差异,棕鞭藻更适合在低pH 条件下的生活污水中絮凝.
微藻培养的主要方式包括自养生长模式(如:BG11培养基)、异养生长模式(如:微藻的高密度培养)、混养生长模式(如:利用各类污水进行微藻培养).目前,对于絮凝剂种类、絮凝方式以及理化条件对收获效率的影响有着大量报道,而不同环境下微藻絮凝差异及影响机制尚不明确.
因此,本文以棕鞭藻为研究对象,比较其在BG11培养基、glu+BG11培养基(含10 g/L 葡萄糖的BG11培养基)及生活污水三种环境中的藻细胞絮凝效率,并分析微藻AOM 产量及组分的差异,以揭示不同环境下AOM 组成对微藻絮凝效率的影响机制.本研究将为在具有复杂理化条件的污水环境中建立高效微藻采收体系提供重要指导.
1 实验部分
1.1 主要试剂与仪器
1.1.1 主要试剂
硝酸,分析纯,天津市天力化学试剂有限公司;氢氧化钠,分析纯,天津市天力化学试剂有限公司;葡萄糖,分析纯,天津市科密欧化学试剂有限公司;氯化铝,分析纯,天津市科密欧化学试剂有限公司.
1.1.2 主要仪器
QGZ-500A 智能光照培养箱,杭州琦胜科技有限公司;OPTIMA XPN-10 型低温超速离心机,美国贝克曼库尔特公司;Cary 5000 型紫外-可见-近红外分光光度计,美国安捷伦公司;PHS-25 台式数显pH 计,上海圣科仪器设备有限公司.
1.2 微藻来源及培养条件
所用藻株分离自陕西科技大学人工湖,经16S rDNA 序列分析比对鉴定其为棕鞭藻属Ochromonassp.(Genebank查找号MN028256).利用三种不同的培养基(BG11、glu+BG11、生活污水)培养棕鞭藻,其中,glu+BG11培养基为BG11中添加10 g/L 葡萄糖,生活污水培养基为经3 层纱布过滤后再稀释2倍的生活污水,污水采自陕西科技大学污水处理厂进水口.
取三种培养基各100 mL并置于250 mL三角瓶中,接种微藻悬液至OD540nm 为0.2,光照培养箱内震荡培养7天.光照强度为3 000 lx,温度28 ℃,光周期L∶D=14 h∶10 h,摇床转速150 r/min.
1.3 微藻絮凝效率测定
吸取10 mL培养至稳定期的藻液置于20 mL试管中,加入不同体积的Al3+溶液使得终浓度分别为5 mg/L、10 mg/L、15 mg/L、20 mg/L、25 mg/L、30 mg/L,并充分震荡试管.微藻样品沉降10 min后于液面以下2cm 处取样,使用分光光度计测定吸光度并按照公式(1)计算絮凝效率[10].

式(1)中:OD初始:藻液在540 nm 下絮凝前的吸光度;OD最终:藻液在540 nm 下絮凝后的吸光度.
1.4 微藻AOM 产量与组分分析
取40 mL 藻液置于50 mL 离心管中,5 000 g离心5 min后弃上清,使用0.85%的生理盐水冲洗,5 000 g离心5 min,重复三次.再加入0.85%的生理盐水溶液于50 ℃条件下加热3 h.将处理后得到的微藻悬浮液于11 000 g 离心15 min,将上清液经0.22μm 滤膜过滤,即得到AOM 溶液[11].
取适量AOM 溶液置于50 mL 离心管后用Whatman No.1滤膜进行过滤,将滤液于10 000 r/min离心10 min.取上清液,加入等体积的丙酮,在4℃条件下保存48 h后10 000 r/min离心10 min,保留沉淀,冷冻24 h,将所得粉末称量即为AOM 干重[12].
蛋白质含量测定选用考马斯亮蓝法[13],多糖含量测定选用苯酚-硫酸法[14],多糖组分测定采用离子色谱分析法[15],荧光物质测定采用三维荧光光谱分析法[16].
1.5 不同重悬体系下的微藻絮凝效率
设置以下6种体系进行微藻絮凝效率的测定:A,BG11培养基微藻培养液;B,glu+BG11培养基微藻培养液离心后上清重悬BG11的藻细胞;C,生活污水微藻培养液离心后上清重悬BG11的藻细胞;D,glu+BG11微藻培养液;E,使用新鲜BG11重悬glu+BG11培养液中的藻细胞;F,使用新鲜glu+BG11重悬glu+BG11培养液中的藻细胞.
2 结果与讨论
2.1 不同环境下棕鞭藻絮凝效率比较
如图1 所示,棕鞭藻在三种不同环境中由Al3+诱导的絮凝效率在生活污水中最高,BG11培养基中次之,glu+BG11培养基中最低.Al3+投加量为15 mg/L 时,棕鞭藻在三种环境中絮凝效率差异最为明显,生活污水中絮凝效率高达89%,约为BG11中絮凝效率的1.27倍,glu+BG11中絮凝效率的1.89倍.
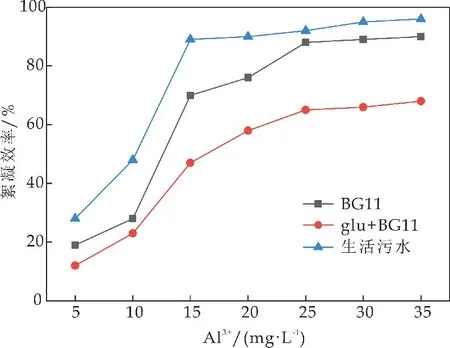
图1 不同环境下棕鞭藻的絮凝效率比较
Zhang等[17]研究发现,葡萄糖的添加使得同剂量Al3+条件下,藻细胞絮凝效率显著下降,其原因是微藻在混养生长时分泌了大量对絮凝有一定抑制作用的物质,从而对絮凝效果产生影响glu+BG11培养基中微藻絮凝效率达到70%时所需的Al3+剂量为35 mg/L,而在BG11与生活污水中所需的Al3+剂量仅为15 mg/L 和11 mg/L,显著降低的絮凝剂用量和更高的絮凝效率有利于在生活污水环境中建立高效、经济的藻细胞絮凝收获体系.在污水环境中建立高效絮凝收获体系将进一步降低微藻生物柴油制备的成本,对实现微藻能源产业化应用具有重要的意义.
2.2 不同重悬体系对棕鞭藻絮凝效率的影响
图2描述了不同重悬体系对棕鞭藻絮凝效率的影响.相较于BG11培养基(A 体系),使用glu+BG11中微藻培养液离心后的上清重悬BG11中的藻细胞(B 体系),微藻絮凝效率由A 体系中的87%降低至64%,使用生活污水中微藻培养液离心后的上清重悬BG11中的藻细胞(C 体系),微藻絮凝效率由A 体系中的87%升至95%(P<0.05).该现象说明不同环境中微藻絮凝效率有明显差异,其中glu+BG11培养基对于微藻絮凝有显著抑制作用.
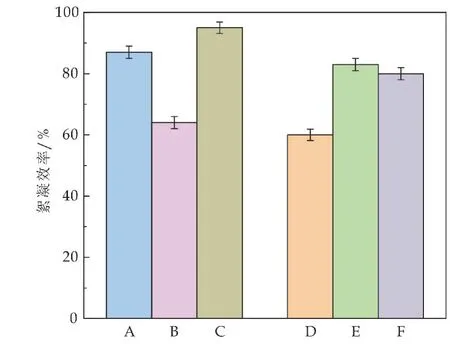
图2 不同重悬体系对棕鞭藻絮凝效率的影响
与glu+BG11(D 体系)相比,使用新鲜BG11培养基重悬glu+BG11培养液中的藻细胞(E体系)絮凝效率由D体系中的60%升至83%,使用新鲜glu+BG11培养基重悬glu+BG11培养液中的藻细胞(F体系)絮凝效率由D 体系中的60%升至80%(P<0.05).该现象说明在glu+BG11培养基中藻细胞絮凝受到抑制是由于微藻在生长代谢中分泌的某种物质,而并非是培养基中葡萄糖本身的作用.赵菲[18]研究发现,不同碳源对微藻自絮凝的影响有显著差异,其中以淀粉为碳源的微藻在培养过程中分泌较高含量的AOM 使得微藻絮凝效率较低,其原因是在易代谢碳源缺乏的胁迫作用下促进了AOM的产生,从而影响微藻的絮凝效率.
2.3 不同环境下棕鞭藻AOM 的产量
不同环境对棕鞭藻AOM 产量的影响如图3所示.在不同pH 条件下,棕鞭藻在glu+BG11中AOM 产量均最高,BG11 中次之,生活污水中最低.这是因为藻细胞在利用有机碳源的过程中代谢途径不同而导致的,此外在培养介质中不同C/N比也会对AOM 产量产生影响[19].当pH 为11时,BG11、glu+BG11、生活污水三种环境中AOM 产量均达到最大值,分别为0.042 g/L、0.109 g/L、0.036 g/L.当pH 为2时,glu+BG11中AOM 产量约为BG11中AOM 产量的2.5倍,生活污水中AOM 产量的3.8倍(P<0.05).张波等[7]研究发现,在glu+BG11培养基中当pH 为11时棕鞭藻絮凝效率低至21.2%,在生活污水中当pH 为2时棕鞭藻絮凝效率高达86.01%,这与微藻在不同pH 条件下AOM 的产量不同有关.Li等[20]研究发现微藻AOM 产量与培养基中的有机物成分有关,有机碳源的添加会促进微藻产生大量的AOM.AOM 中含有大量的胞外多糖,由于胞外多糖中包含负电荷的基团能够与溶液中带有正电荷的离子产生电中和作用,从而对微藻的絮凝产生抑制作用.

图3 不同环境对棕鞭藻AOM 产量的影响
2.4 不同环境下棕鞭藻AOM 的组分分析
2.4.1 AOM 中多糖与蛋白质含量
如图4所示,用不同环境培养的微藻AOM 中多糖含量为0.002~0.021 g/L,多糖含量差异明显.glu+BG11 培养基中多糖含量最高,BG11 培养基次之,生活污水最低.Dries Vandamme等[21]研究发现,斜生栅藻自絮凝过程受到抑制是因为溶液中的多糖与磷酸盐竞争从而干扰Ca3(PO4)2晶体的形成,且多糖中主要是阴离子多糖发挥抑制絮凝作用,如葡萄糖醛酸.

图4 不同环境下棕鞭藻AOM 中多糖与蛋白质含量
BG11、glu+BG11、生活污水三种环境中蛋白质含量较为接近,蛋白质/多糖的比例依次为4.429、1.571、15(P<0.05).Huang等[22]研究表明AOM 中蛋白质是疏水官能团的重要来源,对藻细胞的桥接具有一定作用,蛋白质/多糖越高,微藻细胞之间连接就越紧密,从而促进了絮凝.这与图1中棕鞭藻在三种不同环境下由Al3+诱导的絮凝效率在生活污水中最高,BG11培养基中次之,glu+BG11培养基中最低结果相一致.
2.4.2 AOM 中单糖组成及含量
表1描述了棕鞭藻在不同环境中所产AOM的单糖组成以及含量.glu+BG11 培养基所产AOM 的单糖种类最多(5种),其次为生活污水(4种)、BG11培养基(3种).陈潮州[19]研究发现以葡萄糖为碳源的微藻AOM 检测到6种单糖、以乙酸钠为碳源的微藻AOM 中检测到8种单糖;Alam等[23]发现了小球藻的多糖由葡萄糖、甘露糖和半乳糖组成;Mishra等[24]发现D.salina胞外多糖中含有半乳糖、葡萄糖、木糖和果糖四种单糖;Shi等[25]发现C.pyrenoidosa的多糖主要由甘露糖和葡萄糖组成.由此表明,不同环境、微藻种属差异会对AOM 单糖的组成产生重要影响.

表1 不同环境下棕鞭藻所产AOM 的单糖组成
在glu+BG11培养基中,阿拉伯糖产量最多,鼠李糖产量最少仅为0.973 mg/L,阿拉伯糖的产量约为鼠李糖的13倍.在生活污水中,鼠李糖的含量最高约为1.574 mg/L,半乳糖的含量最少仅为0.032 mg/L,鼠李糖的含量高于岩藻糖、葡萄糖、半乳糖总含量之和.微藻AOM 中单糖组成的差异会影响藻细胞的絮凝效率,Rashid等[26]研究发现岩藻糖比其他单糖亲水性弱、疏水性强,阿拉伯糖能够抑制细胞聚集特性,鼠李糖与半乳糖为藻细胞生长提供能源.
2.4.3 AOM 的三维荧光光谱分析
棕鞭藻所产AOM 的三维荧光光谱图如图5所示.结果发现,不同环境下棕鞭藻所产AOM 均存在类蛋白荧光峰(A 峰,λex/em=225~250/280~360nm)与酪氨酸荧光峰(B峰,λex/em=260~290/300~330nm),可见富里酸荧光峰(C峰,λex/em=240~260/430~460nm)仅存在于BG11培养基中.

图5 不同环境下棕鞭藻AOM 的三维荧光光谱图
glu+BG11培养基中棕鞭藻所产AOM 的类蛋白A 峰、酪氨酸B 峰荧光强度明显高于BG11培养基、生活污水,这与有机碳源促进棕鞭藻生成大量的AOM 有关.在glu+BG11培养基中,棕鞭藻细胞快速生长,使得藻细胞更快达到生长衰减期,衰老、死亡的藻细胞会释放出大量的荧光物质,从而导致荧光物质强度增强.类蛋白与可溶性微生物副产物较易被微生物降解利用,并且微生物在利用糖类、蛋白类化合物时,会造成腐殖酸等大分子物质的积累.同时,藻类胞外有机物所含荧光物质的强度、类型与藻种、生长阶段、生长环境均有关,曾滟[27]研究发现,铜绿微囊藻在生长稳定期会较多地利用荧光物质中容易吸收的酪氨酸和类色氨酸维持生命,而在生长适应期或衰亡期更多的是利用溶液中的非荧光物质维持生长繁殖.
3 结论
棕鞭藻在生活污水中具有最高的絮凝效率与最低的AOM 产量,在含糖体系中由于葡萄糖的添加使得微藻AOM 产量显著增加,进而对藻细胞絮凝产生强烈抑制.与此同时,含糖体系中的AOM所含的单糖种类最多且阿拉伯糖含量最高,而生活污水中AOM 单糖组分以鼠李糖为主.

