枸杞渣多糖的乙酰化修饰及其表征
刘 宁,任 歌,贺人杰,李道明,陈雪峰,房 斐,于哲雄,王金霞,陈西军
(1.陕西科技大学 食品与生物工程学院,陕西 西安 710021;2.陕西农产品加工技术研究院,陕西 西安 710021;3.宁夏天仁枸杞生物科技股份有限公司,宁夏 中宁 755100;4.陕西安康花旗食品有限公司,陕西安康 725000)
0 引言
近年来,随着枸杞种植和加工产业的发展,枸杞浓缩汁、枸杞饮料、枸杞果酒等产量不断增大,产生大量的加工废弃物--枸杞渣,一方面造成环境污染,另一方面造成大量资源浪费,这已成为枸杞加工业迫切需要解决的瓶颈问题[1,2].
多糖的分子结构与生物活性紧密相关,对多糖分子进行接枝功能基团可提高多糖活性.近年来,多糖的改性成为研究热点之一[3].多糖分子改性常用的方法有化学、物理和生物三种,其中化学改性的方法主要有硫酸化、烷基化、磷酸化、硒化、乙酰化、羧甲基化等[4].已有研究[5]表明,多糖经化学修饰后其抗肿瘤活性显著提高.乙酰化改性是在多糖分子的支链上引入乙酰基的反应,并使多糖的支链充分展开,暴露出更多糖内固有的羟基或羧基,从而改善其水溶性,提高其生物活性.
张丽程等[6]对茯砖茶多糖进行乙酰化修饰,乙酰基取代度为0.214,研究发现0.18 mg/m L的茯砖茶多糖和乙酰化茶多糖对α-葡萄糖苷酶的抑制率分别为90.3%和92.2%.张春洁等[7]研究发现海鲜菇多糖乙酰化取代度达到0.602,与海鲜菇多糖相比体外抗氧化活性大大增强.巩丽虹等[8]研究发现制备乙酰化防风多糖的最佳试验条件为:乙酸酐用量7 mL、反应温度40 ℃、反应时间4 h,乙酰化多糖对·OH 和DPPH·的清除能力显著增强.蔡婉静等[9]研究发现超声降解和醋酸干法联合处理海带多糖,可改善海带多糖理化性质,并显著提高其体外抗氧化能力及吸湿/保湿能力.因此,本研究将对挤压后的枸杞渣多糖进行乙酰化修饰,并探究其修饰前后结构变化.
本研究采用单因素和正交试验对乙酰化枸杞渣多糖的最优制备工艺参数进行探究,以乙酰基取代度为评价指标,考察反应时间、乙酸酐添加量和反应温度等三个因素对枸杞渣多糖乙酰化修饰效果的影响,并利用扫描电镜和红外光谱对其进行表征,旨在为枸杞渣多糖的下一步研究奠定理论基础.
1 材料与方法
1.1 材料与试剂
枸杞渣,宁夏天仁枸杞生物科技股份有限公司;乙醇(95%)、乙酸酐、氯化钠、溴化钾,天津市科密欧化学试剂有限公司;氢氧化钠、酚酞、无水乙醇,天津市天力化学试剂有限公司;浓盐酸,天津市东丽区天大化学试剂厂;Φ45 mm 透析袋(8000-14000 Da),Microdialysis Chambers公司.以上试剂均为分析纯.
1.2 仪器与设备
SYSLG30-IV 双螺杆挤压机,济南赛百诺科技开发有限公司;FEI Q45环境扫描电子显微镜,美国FEI公司;Vertex70 红外光谱仪,德国Bruker公司;FD-1D-50冷冻干燥机,上海比朗仪器制造有限公司;H-1850R 台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;RE-2000B 旋转蒸发器,上海亚荣生化仪器厂;LDP-200高速多功能粉碎机,浙江永康市红太阳机电有限公司.
1.3 试验方法
1.3.1 枸杞渣多糖的提取
将枸杞渣进行挤压改性,挤压工艺为:物料粒度40目、加水量30%(质量分数)、螺杆转速210 r/min、静置时间60 min,获得挤压改性枸杞渣.准确称取5.0 g挤压改性枸杞渣,加入125 mL 去离子水,于60℃恒温浸提3 h,待冷却至25℃后,以5 000 r/min离心10 min,取上清液,将上清液浓缩至原体积的1/5,向浓缩液中加入4倍体积95%的乙醇进行醇沉,于4℃下放置12 h,沉淀物用蒸馏水复溶后旋转蒸发除去有机溶剂,冻干后即得枸杞渣多糖.
1.3.2 乙酰化枸杞渣多糖的制备
参照陈金龙[10]的方法,具体步骤如下:先准确称量一定量的枸杞渣多糖,用超纯水溶解样品,加入NaOH 调节溶液的pH 约9.0,10 min后缓慢加入一定量的乙酸酐,乙酸酐的添加分5次进行,整个反应过程的pH 维持在9.0左右,待所有的乙酸酐添加完毕,恒温反应一段时间,将溶液的pH 调为中性,流水透析2 d以除去小分子物质,置于冷冻室下冷冻12 h,于冷冻干燥机中冻干后即得乙酰化枸杞渣多糖.
1.3.3 乙酰化枸杞渣多糖取代度的测定
乙酰化枸杞渣多糖的取代度测定根据酸碱滴定法[11],具体步骤如下:准确称取20.0 mg乙酰化枸杞渣多糖,用浓度为0.01 mol/L 的氢氧化钠溶液与多糖样品混合均匀,于50 ℃恒温下保持2 h,剧烈摇动使之充分皂化.酚酞溶液作指示剂,用0.01 mol/L盐酸溶液滴定,红色消失为滴定终点.在充分皂化时会发生多糖降解,从而产生氢氧化钠的消耗.因此,需作空白对照减少误差.乙酰基取代度(DS)计算公式如下:

式(1)中:A为乙酰基含量,%;V0为加入的氢氧化钠溶液的体积,m L;C0为加入的氢氧化钠溶液的浓度,mol/L;V1为加入的盐酸溶液的体积,m L;C1为加入的盐酸溶液的浓度,mol/L;m为待测样品质量,g.
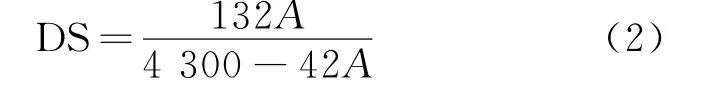
式(2)中:DS为乙酰基取代度;A为乙酰基含量,%.
1.3.4 单因素试验设计
(1)反应时间对枸杞渣多糖乙酰化效果的影响
称取0.1 g枸杞渣多糖置于烧杯中,加入一定量的超纯水溶解多糖,用碱液调节pH 约为9.0,选定乙酸酐的添加量为15 mL,在50 ℃下缓慢加入乙酸酐,整个反应pH 维持在9.0左右,待乙酸酐添加完毕,于恒温条件分别反应1 h、2 h、3 h、4 h、5 h,用酸液调节pH 约为7.0,冷冻干燥得乙酰化多糖,测定乙酰基取代度.
(2)乙酸酐添加量对枸杞渣多糖乙酰化效果的影响
称取0.1 g枸杞渣多糖置于烧杯中,加入一定量的超纯水溶解多糖,用碱液调节pH 约为9.0,分别取5 mL、10 mL、15 mL、20 mL、25 mL 的乙酸酐,在50 ℃下缓慢加入乙酸酐,整个反应pH 维持在9.0左右,待乙酸酐添加完毕,于恒温条件下反应4 h,用酸液调节pH 约为7.0,冷冻干燥得乙酰化多糖,测定乙酰基取代度.
(3)反应温度对枸杞渣多糖乙酰化效果的影响
称取0.1 g枸杞渣多糖置于烧杯中,加入一定量的超纯水溶解多糖,用碱液调节pH 约为9.0,乙酸酐的添加量为15 mL,分别于50 ℃、60 ℃、70 ℃、80 ℃、90 ℃下缓慢加入乙酸酐,整个反应pH 维持在9.0左右,待乙酸酐添加完毕,于恒温条件下反应4 h,用酸液调节pH 约为7.0,冷冻干燥得乙酰化多糖,测定乙酰基取代度.
1.3.5 正交试验设计
在单因素试验基础上,取枸杞渣多糖添加量0.1 g,选取反应时间、乙酸酐添加量、反应温度为因素,以乙酰基取代度为评价指标,设计3因素3水平,进行正交优化试验,其因素及水平设计见表1所示.

表1 正交试验因素水平表
1.3.6 乙酰化修饰前后枸杞渣多糖扫描电镜分析
分别称取适量枸杞渣多糖、乙酰化枸杞渣多糖样品于载物台上,喷金处理30 s,将载物台置于仪器内,调整不同倍数以观察其微观结构.
1.3.7 乙酰化修饰前后枸杞渣多糖红外光谱图分析
称取枸杞渣多糖和乙酰化枸杞渣多糖样品各5.0 mg,加入500.0 mg KBr混匀研磨,在波数范围为4 000~400cm-1内进行红外扫描,并绘制红外谱图.
1.3.8 数据分析
每组数据重复测定3次取平均值,通过SPSS 17.0软件计算数据差异显著性分析,通过Origin 9.0软件作图分析.
2 结果与讨论
2.1 反应时间对枸杞渣多糖乙酰化效果的影响
预设反应温度50 ℃,枸杞渣多糖添加量为0.1 g,乙酸酐添加量为15 mL,考察反应时间对乙酰化效果的影响,结果见图1所示.由图1可知,乙酰基取代度随着反应时间的延长呈现先增后减的趋势.当反应时间从1 h到4 h时,乙酰基取代度随着反应时间的延长而显著升高;当反应时间为4 h时,取代度达到最大值0.429;当反应时间从4 h到5 h时,乙酰基取代度随着反应时间的延长而显著降低.这可能是由于反应时间过长引起多糖降解,因此确定反应时间为4 h.

图1 反应时间对枸杞渣多糖取代度的影响
2.2 乙酸酐添加量对枸杞渣多糖乙酰化效果的影响
预设反应温度50 ℃,枸杞渣多糖添加量为0.1 g,反应时间为4 h,考察乙酸酐添加量对乙酰化效果的影响,结果见图2所示.由图2可知,乙酰基取代度随着乙酸酐添加量增加呈现先增后平稳的趋势.当乙酸酐添加量处于5~15 mL 范围内,乙酰基取代度显著升高;当乙酸酐添加量为15 mL时,乙酰化枸杞渣多糖的取代度最高为0.431;当乙酸酐添加量处于15~25 mL 范围内,乙酰基取代度基本趋于平稳.这可能是因为多糖与乙酸酐试剂按照一定比例反应,当乙酸酐添加量为15 mL时,刚好与0.1 g多糖完全反应.因此综合考虑确定乙酸酐添加量为15 mL.

图2 乙酸酐添加量对枸杞渣多糖取代度的影响
2.3 反应温度对枸杞渣多糖乙酰化效果的影响
预设反应时间4 h,枸杞渣多糖添加量为0.1 g,乙酸酐添加量为15 mL,考察反应温度对乙酰化效果的影响,结果如图3所示.由图3可知,乙酰基取代度随着反应温度升高呈现先增后减的趋势.当乙酰化反应开始前,通常会加入一定量的NaOH 溶液,使酸性物质与碱液发生反应,以此提高枸杞渣多糖溶解度[12].当反应温度处于50℃~60℃范围时,乙酰基取代度显著升高;当反应温度为60 ℃时,乙酰基取代度最高为0.453,此时乙酰化效果最佳;当反应温度处于60 ℃~90 ℃范围时,乙酰基取代度显著下降,这说明反应温度过高对多糖和乙酸酐试剂的取代反应有不利影响[13],因此确定反应温度为60℃.

图3 反应温度对枸杞渣多糖取代度的影响
2.4 正交试验结果
以反应时间、乙酸酐添加量、反应温度为变量,以乙酰基取代度为考察值,通过正交试验对乙酰化枸杞渣多糖制备工艺进行了优化,结果见表2所示.

表2 正交试验设计及结果
由表2分析可得,因素B(乙酸酐添加量)对枸杞渣多糖乙酰化修饰效果影响显著(p<0.05),因素A(反应时间)、因素C(反应温度)对枸杞渣多糖乙酰化修饰效果影响不显著,各因素影响的大小顺序为:B>C>A.乙酰化枸杞渣多糖最佳制备工艺为A2B2C2,即枸杞渣多糖添加量为0.1 g时,反应时间4 h,乙酸酐添加量15 mL,反应温度60℃.在该条件下进行重复性验证试验,可得乙酰化枸杞渣多糖取代度为0.454,均高于优化之前.
2.5 乙酰化修饰前后枸杞渣多糖的扫描电镜分析
图4为乙酰化修饰前后枸杞渣多糖的扫描电镜图.由图4可以发现,乙酰化修饰前,多糖结构致密,表面较为光滑平整.乙酰化修饰后,多糖表面变得粗糙且不平整,有明显褶皱.这可能是由于乙酰化修饰使得多糖内部结构发生了改变,从而引起表面形貌的变化.
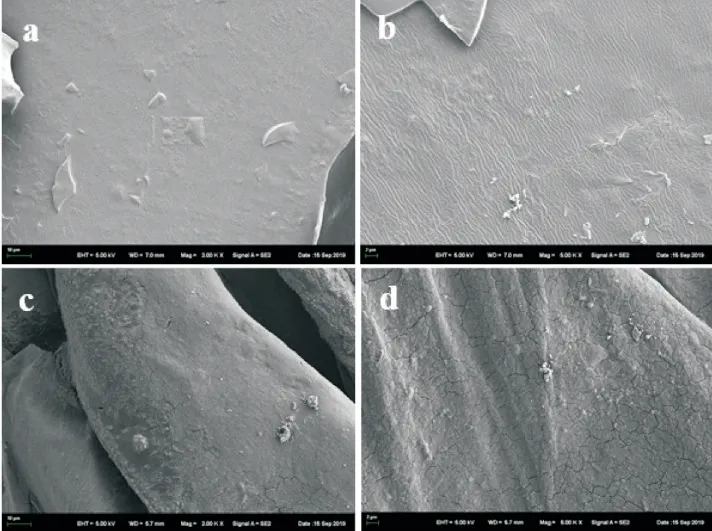
图4 乙酰化修饰前后枸杞渣多糖扫描电镜图
2.6 乙酰化修饰前后枸杞渣多糖红外光谱分析
图5(a)、(b)分别为乙酰化修饰前和修饰后枸杞渣多糖的红外光谱图.由图可知,乙酰化修饰前后枸杞渣多糖均具有多糖的特征吸收峰[14],3 400cm-1附近为多糖分子中的-OH 振动吸收峰,2 900cm-1附近为糖类C-H键的伸缩振动峰,1 300~1 000cm-1附近为C-O的伸缩振动峰,1 600cm-1和1 400cm-1附近处的吸收峰为羧基伸缩振动峰.乙酰化修饰后,多糖在1 746cm-1处出现了新的吸收峰,这可能是由于酯基中C=O的伸缩振动所引起的[14].由此可见,枸杞渣多糖中成功引入乙酰基.
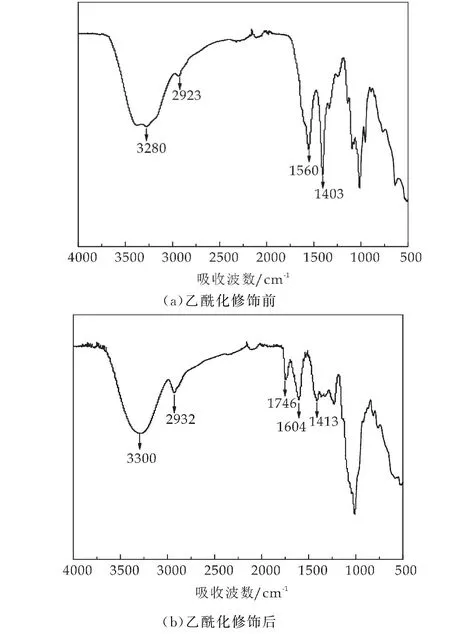
图5 乙酰化修饰前后枸杞渣多糖红外光谱图
3 结论
对枸杞渣多糖进行乙酰化修饰,结果表明,试验各因素对乙酰基取代度影响大小依次为:乙酸酐添加量>反应温度>反应时间,最佳制备工艺为:枸杞渣多糖添加量为0.1 g,反应时间4 h,乙酸酐添加量15 mL,反应温度60℃,此时乙酰基取代度为0.454.红外光谱结果显示,多糖被乙酰化修饰后,出现新的酯基C=O 伸缩振动吸收峰.较多研究结果表明[3,15-19],对多糖进行乙酰化修饰可提高多糖的体外抗氧化活性、抗炎活性及免疫活性等,使其更有可能在功能食品和医药行业应用.下一步,将对乙酰化枸杞渣多糖的抗氧化和免疫活性等进行研究,以期为枸杞渣的高值化利用提供理论参考.

