八角枫丸剂抗大鼠类风湿性关节炎的作用机制
徐李玲, 黄艳萍, 郭殊玮, 梁宝贤, 蒋伟哲, 付书婕
(广西医科大学药学院,广西 南宁 530021)
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的全身性自身免疫性疾病,以关节的慢性炎症、软骨和关节骨的破坏为特征,表现为类风湿结节、肺间质病变、Felty’s综合征等一系列关节外表现[1-2],是一种典型的慢性炎性自身免疫性疾病,主要表现为关节炎、滑膜增生、软骨及骨破坏。目前,相关治疗药物包括非甾体类抗炎药、甾体类抗炎药、疾病修饰类抗风湿药、生物制剂、中药[3]。NF-κB信号通路参与类风湿关节炎的发病机制,它作为转录因子,通过激活和参与炎症产生(如IL-1β、TNF-α等)来调节发病机理,从而影响本病炎症进展[4-6]。
八角枫为八角枫科八角枫属植物AlangiumChinese(Lour)Harms,其味辛温[7-8],主要成分为生物碱,烯、醇醚类、苷类等[9-11],对中枢神经系统、心血管系统、平滑肌、呼吸系统均有良好的作用[12]。八角枫丸剂由广西壮要方医院医疗机构制剂室提供,具有镇痛、消炎、抗风湿、肌肉松弛的作用[13-14],主要用于类风湿性关节炎等疾病的治疗。本实验建立胶原诱导关节炎大鼠模型,研究八角枫丸剂抗类风湿性关节炎活性及其可能的作用机制。
1 材料
1.1 动物 SPF级雄性SD大鼠40只,体质量(150±20)g,由广西医科大学实验动物中心提供,实验动物生产许可证号SCXK(桂)2014-0002,温度控制在(23±2)℃,相对湿度控制在(50±10)%,适应性喂养1周。
1.2 药物 八角枫丸剂(批号20190730,广西壮要方医院医疗机构制剂室自制);雷公藤多苷片(批号20190401,湖南千金协力药业有限公司)。
1.3 试剂 牛源性Ⅱ型胶原蛋白(批号190209,美国Chondrex公司);弗氏不完全佐剂(批号SLBZ2765,美国Sigma公司);羧甲基纤维素钠CMC-Na(批号20180110,国药集团化学试剂有限公司);4%多聚甲醛溶液(批号P1110)、苯甲基磺酰氟化物PMSF(批号20190903)、RIPA裂解液(批号20190826),均购自北京索莱宝科技有限公司;肿瘤坏死因子(TNF-α)、转化生长因子(TGF-β1)、白介素1β(IL-1β)、白介素10(IL-10)ELISA试剂盒(批号均为20191220),均购自于南京建成生物工程研究所;β-actin抗体(批号4970S)、Anti-rabbit IgG(H+L).(DyLightTM800 4×PEG Conjugate)(批号5151P),均购自美国CST公司;NLRP3抗体(批号AB263899,英国Abcam公司);TLR4抗体(批号ABS143411)、IRAK1抗体(批号ABS116547),均购自上海爱必信生物科技有限公司。
1.4 仪器 冷冻离心机(MicroCL17R型,美国Thermo Fisher Scientific公司);连续光谱扫描酶标仪(SpectraMaxPlus384型,香港分子仪器公司);电泳仪(PowerPac HC型,美国Bio-Rad公司);Odyssey红外荧光扫膜成像系统(LI-COROdyssey CLx型,美国LI-COR公司)。
2 方法
2.1 八角枫丸剂的制备 称取八角枫适量,加入10倍量蒸馏水煎煮提取2次,每次1 h,合并滤液,浓缩成稠膏,蒸干为干膏,取适量加入辅料(CMS-Na和淀粉)和润湿剂(水)制丸,干燥,即得。
2.2 造模 将溶解于冰醋酸的牛源性Ⅱ型胶原蛋白加入等体积的弗式不完全佐剂,在冰浴条件下使两者充分乳化(以乳化液滴入水中不扩散为度),使用高速匀浆机充分混合均匀,转速设置为3 000 r/min,时间间隔3 min,其间适时更换冰水混合物,保持离心管温度在4 ℃左右,以免胶原变性,乳剂最终状态应充分混匀,呈油包水状。若未达到此效果需重复上述操作过程,最终质量浓度为1 mg/mL。在大鼠尾根部及足耻底部注射牛源性Ⅱ型胶原蛋白乳剂各0.1 mL,初次免疫后第7天,在大鼠尾根部、背部以相同剂量再次免疫[15]。
2.3 分组及给药 造模成功后,将大鼠分为模型组、八角枫丸剂高(84 mg/kg)和低(21 mg/kg)剂量组、阳性药(15 mg/kg雷公藤多苷)组、空白组,按10 mL/kg剂量灌胃给药,模型组、空白组大鼠灌胃给予等量0.5%的CMC-Na,连续28 d。
2.4 检测指标
2.4.1 足厚度 分别于致炎前(第0天)和致炎后第14、21、28、35、42天,用软尺测量每只大鼠右后爪周长,游标卡尺测量右足肉垫厚度。
2.4.2 关节炎指数 参考文献[16-17]报道,于致炎前(第0天)和致炎后第14、21、28、35、42天进行评分,标准为(1)0分,正常;(2)1分,踝关节出现红斑和轻微肿胀;(3)2分,踝关节到跖关节或掌关节红斑和轻微肿胀;(4)3分,踝关节到跖趾关节或掌关节出现红斑和中度肿胀;(5)4分,踝关节到趾关节出现红斑和重度肿胀。
2.4.3 免疫器官指数 各组大鼠禁食12 h,末次给药1 h后腹腔注射水合氯醛麻醉,分离脾脏和胸腺,称定质量,计算大鼠免疫器官指数,公式为脾脏或胸腺指数=(脾脏或胸腺质量/体质量)×103。
2.4.4 血清炎症因子水平 各组大鼠禁食12 h,末次给药1 h后腹腔注射水合氯醛麻醉,腹主动脉取血,3 000 r/min离心15 min,取血清,采用ELISA法检测血清IL-1β、TNF-α、IL-10、TGF-β1水平。
2.4.5 组织病理学 大鼠脱颈处死,立即分离病变关节,4%多聚甲醛固定48 h,10%EDTA脱钙液脱钙,以大头针刺入踝关节局部无阻力感为脱钙完全,HE染色后,于显微镜下观察踝关节组织病理学变化及评分,标准为(1)滑液损伤,无损伤0分,轻度损伤1分,中度损伤或增生2分,严重破坏3分;(2)炎性浸润,无炎症0分,轻度浸润1分,温和的渗透2分,严重的渗透3分;(3)软骨破坏,无损伤0分,轻度破坏1分,中度破坏2分,严重破坏伴有软骨丢失或完全碎裂3分;(4)骨破坏,无损伤0分,轻度软骨下骨质破坏1分,中度骨质破坏2分,骨破坏严重伴有大面积骨丢失3分;(5)骨赘形成,无0分,轻微形成1分,中等形成2分,广泛形成3分[18]。
2.4.6 Western blot法 给药4周后,麻醉处死各组大鼠,取下踝关节滑膜组织,用含蛋白酶和磷酸酶抑制剂混合物的高效RIPA组织/细胞裂解液裂解蛋白,加缓冲液,沸水浴5 min变性,上样,电泳,转膜1.5 h,5% BSA封闭液封闭1 h,孵育一抗,4 ℃过夜,二抗孵育1 h,扫膜,通过Image J软件检测蛋白表达。

3 结果
3.1 足厚度 造模后14 d,与空白组比较,模型组、阳性药组、八角枫丸剂组大鼠足厚度增大(P<0.01);造模后21~42 d,与模型组比较,阳性药组、八角枫丸剂组大鼠足厚度减小(P<0.05,P<0.01),见表1。
表1 八角枫丸剂对大鼠足厚度的影响
3.2 关节炎指数 造模后14~42 d,与空白组比较,模型组大鼠关节炎指数升高(P<0.01);造模后21~42 d,与模型组比较,阳性药组、八角枫丸剂组大鼠关节炎指数降低(P<0.05,P<0.01),见表2。
表2 八角枫丸剂对大鼠关节炎指数的影响(分,
3.3 脏器指数 与空白组比较,模型组大鼠脾脏、胸腺指数升高(P<0.01);与模型组比较,阳性药组、八角枫丸剂组大鼠脾脏、胸腺指数降低(P<0.01),见表3。

表3 八角枫丸剂对大鼠脏器指数的影响
3.4 血清炎症因子水平 与空白组比较,模型组大鼠血清TNF-α、IL-1β、TGF-β1水平升高(P<0.01),IL-10水平降低(P<0.01);与模型组比较,阳性药组、八角枫丸剂组大鼠血清TNF-α、IL-1β、TGF-β1水平降低(P<0.05,P<0.01),IL-10水平升高(P<0.01),见表4。

表4 八角枫丸剂对大鼠血清TNF-α、IL-10、IL-1β、TGF-β1水平的影响
3.5 踝关节组织病理学 空白组大鼠滑膜组织细胞形态完整,无炎性细胞浸润,关节软骨无损伤,关节结构完整;模型组大鼠关节腔内滑膜组织增生,滑膜下组织血管扩张,部分滑膜组织纤维化,有血管翳形成,并伴有大量炎性细胞浸润;阳性药物组大鼠病理切片显示关节面光滑,但细胞形态改变,有纤维化痕迹;八角枫丸剂低剂量组效果不理想,而高剂量组大鼠细胞排列整齐,视野内滑膜细胞增生减少,有少量炎性细胞浸润,未见血管翳,与模型组比较病理变化明显,见图1、表5。
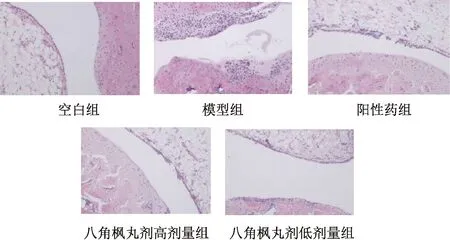
图1 各组大鼠踝关节组织病理学(×100)
表5 八角枫丸剂对大鼠踝关节组织病理学的影响(分,
3.6 NLRP3、TLR4、IRAK1蛋白表达 与空白组比较,模型组大鼠滑膜组织NLRP3、TLR4、IRAK1蛋白表达升高(P<0.01);与模型组比较,阳性药组、八角枫丸剂组NLRP3、TLR4、IRAK1蛋白表达降低(P<0.05,P<0.01),见图2、表6。

表6 八角枫丸剂对大鼠滑膜组织NLRP3、TLR4、IRAK1蛋白表达的影响
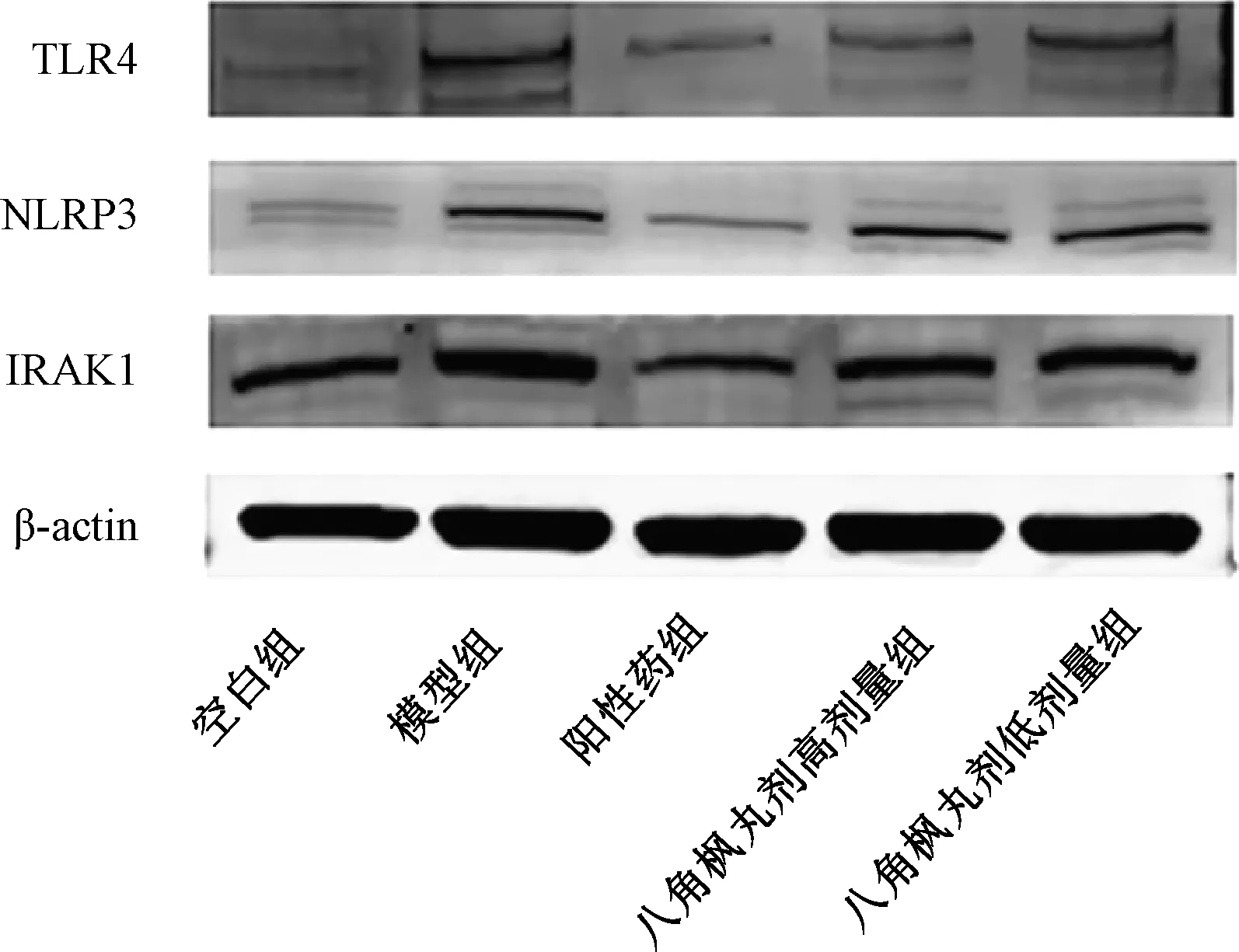
图2 各组大鼠滑膜组织NLRP3、TLR4、IRAK1蛋白表达
4 讨论
类风湿关节炎(RA)是一种慢性全身性自身免疫性疾病,主要累及关节,引起增殖性滑膜炎。其特点是大量炎性细胞浸润,形成血管翳,滑膜扩张,侵犯邻近关节软骨及软骨下骨,与肿瘤相似,造成损伤[19-20]。NF-κB信号通路参与各种炎症因子和基质金属蛋白酶的产生[21-22]。NF-κB作为一种重要的核转录因子在类风湿关节炎的发病机制中发挥关键作用,其中包括两个主要机制,首先NF-κB的激活能增加炎症介质的转录,反过来,这些炎症介质可以激活NF-κB的表达;两者都构成正反馈机制,导致类风湿关节炎的炎症介质[23]。
本研究结果显示,八角枫丸剂能降低大鼠关节炎指数,能缓解大鼠的足趾红肿,表明八角枫丸剂能较好的抑制RA大鼠的炎症症状。通过病理学分析可以知道八角枫丸剂组大鼠细胞排列整齐,视野内滑膜细胞增生减少,有少量炎性细胞浸润,未见血管翳。与模型组比较,病理改变明显。由此可看出,八角枫丸剂对类风湿关节炎具有良好的治疗作用。类风湿关节炎的发病机制较为复杂,根据相关研究显示,在类风湿关节炎的病变过程中,会使关节积液与滑膜组织中T淋巴细胞和B淋巴细胞数量增多,进而促进多种炎症因子的分泌,炎症因子是关键功能分子在类风湿性关节炎中影响发病和进展的主要原因之一[24],包括TNF-α、IL-6和IL-1β[25]。其中IL-1β在类风湿关节炎的发病机制中起着重要的作用。研究表明,IL-1β主要由巨噬细胞产生,IL-1β可以激活单核细胞巨噬细胞,诱导细胞粘附分子,趋化因子和其他炎症介质,从而导致关节炎症加剧[26]。本文研究显示,八角枫丸剂可以降低大鼠血清中IL-1β、TNF-α、TGF-β1水平,升高IL-10水平,提示八角枫丸剂可能通过减少炎症因子的产生从而减轻类风湿关节炎大鼠足肿胀炎症反应来发挥抗类风湿关节炎的作用。说明降低炎症因子的水平可能是八角枫丸剂抗类风湿性关节炎作用机制的一部分。
NF-κB信号通路作为参与炎症反应的最关键的信号通路,其密切作用于慢性疾病的发展过程。NF-κB有能力控制基因产物的表达影响多种细胞反应,包括细胞增殖和细胞凋亡。该信号通路可刺激滑膜的新生血管生成和炎症反应[27-28]。蛋白免疫印迹法结果显示,八角枫丸剂能下调NLRP3、TLR4、IRAK1蛋白表达水平,说明八角枫丸剂抗类风湿关节炎的机制与抑制NF-κB信号通路的激活有关。
综上,八角枫丸剂对牛源性Ⅱ型胶原蛋白所致的类风湿性关节炎具有良好的治疗作用,其机制与抑制炎症因子的产生和下调NF-κB信号通路相关蛋白水平有关。

