枕骨大孔区椎管内支气管源性囊肿2例
吴虹林 杨佳 杨李轩
支气管源性囊肿(bronchogenic cyst,BC)是胚胎时期支气管树异常出芽形成一种少见的先天性囊肿,其特征是囊壁由假复层纤毛柱状上皮覆盖[1]。支气管源性囊肿主要见于成人,多位于肺实质或纵隔,少部分可发生在颈部、膈肌、腹部、椎管及颅内等部位[2]。椎管内支气管源性囊肿(intraspinal bronchogenic cyst,SBC)约占椎管内囊性病变的0.5%[3],常见于颈椎和胸椎段[4],其中涉及枕骨大孔区的SBC仅报道了 3例[2,5-6]。2008年至今,我院共收治了 2例枕骨大孔区椎管内支气管源性,现报道如下。
1 临床资料
病例 1,女,50岁,因“四肢麻木 1年,走路不稳 4个月”入院。查体:四肢肌张力正常,双侧上肢肌力5级,左下肢肌力 4级,右下肢4+级。四肢浅感觉明显减退,左下肢 Babinski征(+),右下侧 Babinski征弱(+),余未见明显阳性体征。血常规、肝功能、肾功能及凝血功能未见明显异常。术前头颈部MRI检查:自枕骨大孔至颈4椎体下缘水平椎管内可见一囊性液性信号影,T1WI稍低信号,T2WI明显高信号,增强扫描无强化(图1)。考虑良性囊肿可能性大。手术采用俯卧位,Mayfield头架固定,麻醉后取枕项后正中切口,切开皮肤、皮下,沿项白线切开,分离椎旁肌肉,牵开器撑开,显露C1-C6棘突及椎板,咬除C1-C5棘突并磨开两侧椎板,尖刀纵行切开硬膜,丝线缝吊拉向两侧。术中见囊肿位于髓外硬膜下,腹侧,上端至枕大孔,下端至C4水平,囊壁透明,囊内为微白色清亮液体,活动性可,囊内减压后,分离后发现囊肿蒂位于C3腹侧,显微镜下电凝离断囊肿蒂部,完整切除囊肿(图2)。术后病理示囊肿4.0 cm×1.0 cm×0.2 cm,纤维组织构成的囊壁样结构,囊内壁被覆单层立方或纤毛柱状上皮,病变符合良性囊肿,考虑为支气管源性囊肿(图3)。术后3个月随访,四肢麻木和走路不稳症状消失,复查MRI未见复发(图1)。
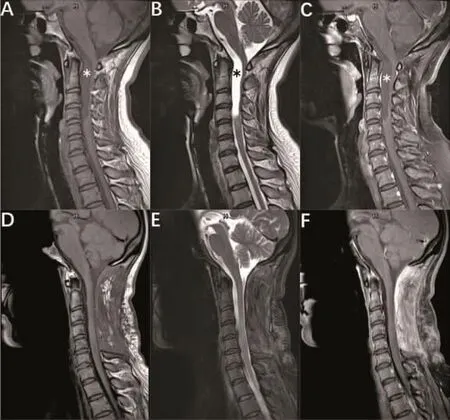
图1 术前和术后3个月颈部 MRI影像 A、B、C.(术前)自枕骨大孔至C4椎体下缘水平椎管内可见一囊性液性信号影,T1WI稍低信号,T2WI明显高信号,增强扫描无强化。D、E、F.(术后3个月)自枕骨大孔至C4椎体水平,颈髓前方蛛网膜下腔略增宽,相应节段颈髓变扁,颈髓信号未见异常。颈椎顺列正常,生理弯曲变直。C1-C5棘突及部分椎板骨质缺损,相应节段颈后部软组织结构紊乱,T1WI呈等、低信号,T2WI呈稍高信号,增强扫描不强化。未见囊肿复发征象。
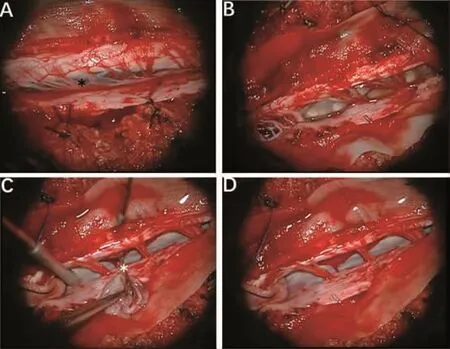
图2 术中情况 A.打开脊髓硬脊膜并悬吊(黑色*示囊肿位于脊髓腹侧,髓外硬膜下);B.挑开脊髓蛛网膜,分离蛛网膜下粘连,暴露整个囊肿;C.囊肿蒂位于C3腹侧(白色*示囊肿蒂位置);D.完整切除囊肿。
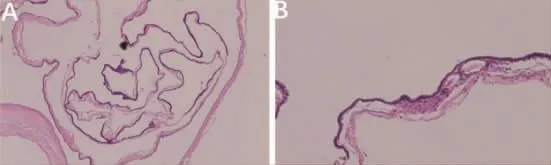
图3 病理结果 A.髓外硬膜下囊性病变,纤维组织构成的囊壁样结构。B.囊内壁被覆单层立方或纤毛柱状上皮。病变符合良性囊肿,考虑为支气管源性囊肿。
病例 2,女,39岁,因头痛头晕 1年,下肢麻木乏力1个月入院。查体:双下肢肌力IV级,双下肢浅感觉减退。其余查体未见明显阳性体征。术前检查血常规、肝功能、肾功能及凝血功能未见明显异常。颅脑MRI检查:左侧脑桥-延髓区见一软组织异常信号影,边界清,T1WI呈稍高信号,T2WI呈稍高信号,内见2个T2WI呈等信号结节,增强扫描后病灶大部未见强化,结节强化(图4)。考虑良性囊肿可能性大。手术俯卧位,Mayfield头架固定,麻醉后,取左侧反“L”形切口,从C5至枕粗隆上,取左侧枕下外侧入路,游离左侧枕鳞部骨瓣6 cm×6 cm开颅,打开左侧环椎和枕大孔,到横突和枕髁内侧,显露左侧乙状窦内侧缘。术中见肿物上达面听神经上方,下达C2水平,左侧进入颈静脉孔内,右侧超中线包绕椎基动脉,黄褐色囊性肿物,包膜半透明,穿刺抽出麦绿色粘稠液体,囊内见豆腐渣样内容物,并可见一红色结节,桑果样,囊壁部分粘连明显,分块剥离包膜并全切囊肿,肿物大小约 5.0 cm×4.0 cm×3.0 cm。术后病理:纤维性囊壁组织,被覆纤毛柱状上皮,局部为鳞状上皮。另见角化物,胆固醇沉积,异物巨细胞反应,淋巴细胞浸润及纤维组织增生(图5)。病变符合支气管源性囊肿特征。术后3个月随访,患者下肢麻木无力感消失,复查MRI未见囊肿复发(图4)。

图4 术前和术后3个月颈部MRI影像 A、B、C.(术前)左侧脑桥-延髓区见一软组织异常信号影,边界清,T1WI呈稍高信号,T2WI呈稍高信号,增强扫描后病灶大部未见异常强化。内见2个T1WI呈高信号、T2WI呈等信号以及增强扫描环形强化的结节。考虑为良性囊肿可能性大。D、E、F.(术后3个月)左侧枕部部分骨质不连呈术后改变,T1WI、T2WI及增强扫描未见异常强化灶,余颅内未见异常信号影,未见明确囊肿复发征象。
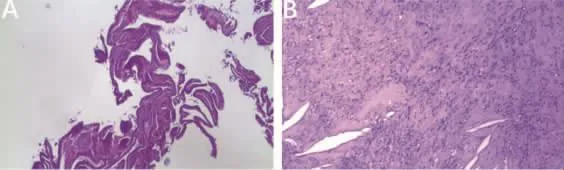
图5 病理结果 A.纤维性囊壁组织,被覆纤毛柱状上皮,局部为鳞状上皮。B.囊壁内少量淋巴细胞浸润,局部小灶见脑膜皮细胞样细胞轻度增生,另见异物巨细胞反应,淋巴细胞浸润及纤维组织增生。病变符合支气管源性囊肿,未见恶性特征。
2 讨论
椎管内支气管源性囊肿由JUNKOH YAMASHITA于1973年首次报道,该病发病率极低,术前临床诊断难以明确[7]。SBC多位于颈胸段脊髓腹侧,常合并其他脊柱畸形如脊髓裂、脊髓栓系等[4]。而本文2例SBC均发生在枕骨大孔区附近,位置高,且未发现其他部位畸形,从而导致术前分别误诊为神经鞘瘤和脑膜瘤。目前SBC发生机制尚不明确,可能与胚胎发育有关。胚胎发育过程中,在三胚层分化阶段,内胚层卷入胚体内形成原始消化管(primitive gut),原始消化管再分化成消化管、消化腺、呼吸道和肺的上皮以及甲状腺、甲状旁腺和胸腺等的上皮[5]。根据胚胎发育理论,目前文献[8]有4种假说解释SBC的发病机制:分离不全假说,潜能分化假说,脊索裂综合征,以及异常分化假说。由于SBC很多伴有脊柱其他畸形,脊索裂综合征假说认可度高一些。
SBC的临床表现主要是囊肿在椎管内的占位效应引起,没有特异性。本组SBC临床表现也是由囊肿在局部压迫所产生,表现为局部疼痛、四肢感觉异常和肌张力下降,无其他特殊体征。文献报道位于枕大孔区的SBC还可以导致颅内压升高、后组神经受压迫等症状,而本组病例并未出现上述体征,可能与囊肿较小有关。发现SBC主要依靠MRI,MRI检查大多提示髓外硬膜下一边界清楚的椭圆状或梭形囊肿,T1WI呈低信号、T2WI呈高信号,增强扫描无明显强化。但病例2的MRI检查示囊肿内部存在明显环形强化的结节,术中见结节为红色桑果样,考虑囊肿蒂,此为首次报道,这也是导致术前误诊的原因之一。根据上述症状和影像学特征,SBC可以与蛛网膜囊肿、神经鞘瘤、表皮样囊肿、畸胎瘤、脂肪瘤等椎管内疾病进行鉴别,但确诊SBC仍需依靠病理学检查。本组SBC病理学检查可见SBC囊壁主要由厚薄不均的单层或假复层纤毛柱状上皮构成。病例2中囊壁局部为鳞状上皮,囊壁内少量淋巴细胞浸润,局部小灶见脑膜皮细胞样细胞轻度增生,这可能与胚胎发育时囊肿壁具有潜能分化有关。
椎管内支气管源性囊肿最有效的治疗方法是全切除囊肿避免复发。部分髓内SBC全切除容易过度损伤脊髓,而大多数髓外SBC多位于脊髓腹侧,大多与脊髓、神经根粘连紧密,手术全切除囊肿不易[2],当囊壁和周围神经结构粘连严重而无法分离时,次全切除也是可以接受的。本组囊肿与周围组织粘连时,在术中电生理监测下,先用细针抽吸囊液使囊壁皱缩,再用显微剥离子将囊壁从脊髓表面分段剥离,避免过多应用双极电凝,减少脊髓和周围神经的热损伤。2例患者术后恢复良好,无明显并发症出现,术后3个月随访,术前症状得到完全缓解。
综上所述,SBC临床上极少见,其中涉及枕骨大孔区的高位SBC更加罕见。根据症状和影像学特征可初步做出鉴别,但病理学诊断是金标准。治疗上首选手术,但囊肿多与周围组织粘连,手术的关键是需要手术医生在术中电生理监测和高倍显微镜下细心剥离,才能避免脊髓神经的损伤。术中如若将囊肿分块,则不易找出其边界,应整体剥离才不易残留,应尽量全切除避免复发。

