功能区胶质瘤术中直接皮层电刺激诱发癫痫发作1例☆
梁新宜 练欢 李欣 姜代芬但炜
直接皮层电刺激 (direct electrical cortical stimulation,DCS)被广泛用于术前或术中功能区皮层定位,是脑功能区病变手术治疗的重要辅助手段。但DCS行功能区定位时,可诱发后放电(afterdischarges,ADs)甚至癫痫发作。ADs会影响功能区定位结果准确性,而术中癫痫发作对患者及术者身心均会产生极大影响。如何在皮层脑电图(cortical electroencephalogram,ECoG)监护下早期识别ADs以及阻断其进展演变为癫痫发作具有重要的临床意义。2020年12月我科收治1例功能区胶质瘤患者,全麻下术中低电流强度DCS引起ADs演变为癫痫发作,现报告如下。
1 临床资料
1.1 一般资料患者,女,47岁,右利手,“发作性右上肢麻木伴眼角抽搐1+月”入院。1+月前患者无明显诱因出现右上肢麻木及乏力,从指尖开始,延手臂向上蔓延,最后出现眼角抽搐,发作持续约3~4 min,发作过程中无双眼凝视、口角流涎、四肢抽搐、意识丧失等表现,病程中共发作4次,每次发作症状类似。外院头颅MRI提示“左侧额顶叶占位病变”。入院查体未见明显异常。头颅MRI(图1A-C):左侧额顶叶可见4.0 cm×3.0 cm×3.1 cm不规则团块状信号影,T1WI呈低信号,T2WI呈高信号,FLAIR呈高信号,DWI信号稍增高;增强后病灶强化不明显,考虑肿瘤性病变可能性大,低级别胶质瘤?MRS:病变区N-乙酰天门冬氨酸(NAA)峰较正常侧明显下降,胆碱(Cho)峰明显升高,Cho/NAA约为3.41,符合肿瘤波谱表现。fMRI:测得运动语言中枢位于左侧中央前回及额中回后部可能性大,激活区与肿瘤最小直线距离约9 mm。PWI:病灶处呈低灌注改变。DTI:病灶周围白质纤维束受压推移。动态脑电图示各导联略多同步4~5 Hz θ活动及单个棘尖波,左侧为著。
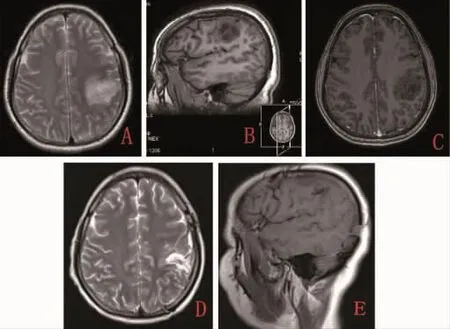
图1 术前及术后头颅MRI A-C.(术前)左侧额顶叶邻近中央沟占位,T1WI呈低信号,T2WI呈高信号,强化不明显;D-E.(术后3个月)左侧额顶交界区术区残腔形成,伴少许胶质增生。
1.2 手术方法采用静息复合麻醉,监护全程不给与肌松剂,保持麻醉深度。暴露术区后,首先测定体感诱发电位,明确中央沟位置,随后行DCS功能区定位。根据指南[1]及以往术中DCS经验设置刺激参数:采用双极神经电刺激器,双极间距5 mm;刺激波形为双相方波,刺激频率60 Hz,波宽1 ms,刺激持续时间1 s,采用连续刺激模式。刺激电流从2 mA开始,此后以0.5 mA幅度递增刺激电流强度,直至出现功能阳性反应(通过自由肌电活动判断有无功能区阳性反应)或ADs。同时将4×4栅状皮层电极放置于病灶后方用于监测ADs。
行功能区定位,当刺激病灶上方皮质时(图2),在2 mA刺激电流下,于刺激位点后方ECoG监测到低幅快活动ADs(图3A),立即停止刺激并予以冰盐水冲洗。ADs仍向临近电极扩散,出现同步化棘波/棘慢波节律(图 3B、C),患者出现强直阵挛发作,立即予以丙泊酚推注 (6 mL,0.1 mL/kg)后发作结束(图3D)。期间患者未出现脑肿胀、脑膨出、颅内出血及脑缺氧等并发症。由于功能区定位已接近尾声,出于对患者安全考虑,未再对诱发出患者惊厥发作的刺激位点行重复刺激。

图2 术中皮层电刺激定位 A.红色箭头处为刺激位点(位于病灶上方皮层),先后于相邻电极触电14、15及9号电极处监测到ADs;B.病灶切除后于病灶上方及其周围皮层行地毯式ECoG监护;C-D.病灶切除前及切除后皮层。
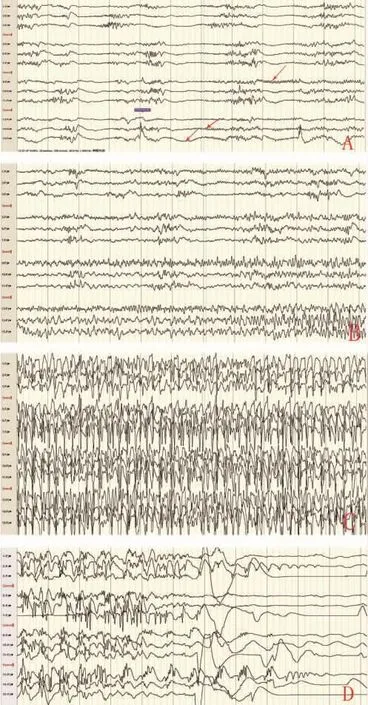
图3 术中ECoG监测 A-C.(ADs演变为癫痫发作)ECoG于病灶后方相邻电极监测到低幅β节律(红色箭头示),持续约15s后演变为连续性棘尖波,随后各导联出现同步棘尖慢波。D.予以丙泊酚推注后,棘尖波抑制。
结束DCS,患者生命体征平稳,依据功能区定位结果及术中神经导航行病灶切除(图2C、D),病灶切除后再次于病灶上方及病灶周围皮质行地毯式ECoG监护(图2B),未见明显癫痫放电,结束手术,整个过程持续约6 h。术后病理结果示左侧额顶叶少突胶质细胞瘤,IDH突变型和1p19q共缺失(WHO Ⅱ级)。
1.3 围术期管理及随访患者术后第1天出现癫痫发作两次,症状同术前。予以左乙拉西坦(500 mg,2次/d)+奥卡西平(300 mg,2次/d)口服叠加抗癫痫治疗。后患者未再出现癫痫发作,查体四肢肌张力正常,肌力V级,无肢体感觉异常及言语功能障碍。术后病理证实:少突胶质细胞瘤(WHO II级)。出院后继续口服左乙拉西坦+奥卡西平,术后3个月随访无癫痫发作,复查头颅MRI(图 1D、E)未见复发。根据指南[2]及复查影像结果,建议患者继续当前抗癫痫治疗,至少连续2年无发作可考虑逐步减停药物。
2 讨论
脑功能区胶质瘤手术对于神经外科医生而言极具挑战性,而多模态术中监测为实现优化“肿瘤功能平衡”提供了可能[3-4]。DCS作为功能区定位“金标准”,是多模态监测的关键[5]。但DCS常诱发 ADs,研究[6]表明,约 75%患者在功能区定位时可出现ADs。ADs是DCS诱发的节律性癫痫样放电,不仅影响功能区定位结果,甚至进展演变引起术中癫痫发作。尽管ADs及术中癫痫发作对患者预后(住院时长、术后并发症、术后癫痫控制等)无明显影响[7],但术中癫痫发作可引起脑肿胀、脑膨出、颅内出血及脑缺氧等并发症,应尽量避免。
目前用于功能区定位的DCS参数仍缺乏统一标准。研究[6,8]发现,诱发ADs参数阈值不仅存在较大个体差异,甚至在同一个体不同刺激区域、两个相邻刺激位点之间、同一位点重复刺激时都存在不同。而诱发ADs的刺激电流强度也并非一定高于引起功能区阳性反应的刺激强度。CORLEY等[9]在对92例难治性癫痫患者皮层刺激数据回顾性分析中发现,运动、感觉及言语反应最低阈值平均值分别为(4.15±2.67)mA、(3.5±2.15)mA 和(4.48±2.42)mA,引起ADs阈值平均值为(4.33±2.37)mA。可见使用足够的电流强度刺激以获得可靠的功能响应并同时避免ADs具有难度,刺激强度需根据ECoG监测结果行个体化调整。本例患者在全麻状态下,给予病灶上方皮层2 mA起始刺激强度即诱发ADs,随后演变为临床癫痫发作。因此对于术前无创脑电显示频繁发作间期放电区域及癫痫发作起始区(即激惹区及致痫区),可能须降低初始电流强度以及随后的增量。可从1 mA电流开始刺激,以0.5 mA递增刺激电流强度,并密切观察ECoG波形变化。同时对于这些相对敏感区域,可在最后进行刺激以减少ADs及术中癫痫发作对功能区定位结果的影响。
尽管尚不清楚为何某些ADs会传播并发展为临床癫痫发作,而其他则仅限于受刺激电极并自发终止,但ADs形态具有规律性,早期识别ADs特征有助于预测刺激性癫痫发作的风险。LIU等[10]将ADs分为4种不同的形态学类别:正弦型或半正弦型节律波(rhythmic waves)、棘尖慢波(spike waves/spike-and-slow-wave complexes)、多 棘 波(polyspikes)和连续性棘波(sequential spikes)。其中最常见的ADs形式是连续性棘尖波,而DCS引起的癫痫发作大多也由连续性棘尖波发展而来。同时GOLLWITZER等[6]发现不含慢波成分的ADs更容易出现进展扩散 (频率/部位变化或两者同时改变)。本病例中,在致痫区皮层行DCS时于刺激位点临近电极监测到低幅β节律波,立即停止刺激,β节律波未自发终止,持续约15 s,继之脑电演变为各导联同步棘尖波,与上述文献描述易于出现进展扩散及最常见引起癫痫发作ADs特征一致。因此在术中监测观察到EcoG背景活动改变时,特别是出现连续性的棘尖波节律及低幅β节律等,如停止刺激ADs未自发终止,应警惕刺激性癫痫发作的风险。
指南[1]指出冰生理盐水冲洗局部可控制大部分癫痫发作,而对于癫痫仍持续发作者则可根据情况迅速加深麻醉。但术中癫痫发作以及麻醉的加深不仅会中断DCS,还会对后续功能区定位产生影响。研究[6]发现,刺激引起术中癫痫发作患者的ADs相对于未发作者持续时间延长,平均可达9.8 s。本例中从诱发ADs到进展为癫痫发作的间期长达15 s。如果在这一间期早期采取措施阻断ADs,则有可能大大降低DCS引起术中癫痫发作风险。我们既往经验是在观察到连续性的棘尖波节律及低幅β节律时,早期予以局部冰盐水冲洗,大多数ADs可被终止。
综上所述,对于功能区胶质瘤手术,尤其是伴有胶质瘤相关癫痫的患者,在行DCS功能区定位时,为避免诱发ADs,可从较低的刺激电流(1 mA)开始,同时对于致痫区及激惹区内的相对敏感区域,可在最后进行刺激。如果诱发ADs,应注意连续性棘尖波及低幅快节律的出现,早期采取阻断措施,可大大降低术中癫痫发作的风险。

