马钱子苷对小胶质细胞活化的抑制作用
易赛妮,张文娇,李良远,肖承鸿,唐鑫,刘芹,苏大鹏,胥春云,张进强,周涛
(贵州中医药大学,贵州 贵阳 550025)
小胶质细胞是中枢神经系统的固有免疫细胞,在突触连接和去除凋亡细胞中起到重要作用[1]。在正常情况下,小胶质细胞通常处于静息状态,可通过吞噬作用清除细胞碎片从而维持脑内环境稳态[2]。但当大脑发生创伤、炎症或感染时,小胶质细胞被激活,激活的小胶质细胞可分为经典(M1)表型和选择性激活(M2)表型[3]。其中M1表型的小胶质细胞可由内毒素脂多糖(lipopolysaccharide,LPS)诱导得到,其通常表现为胞体膨大,分枝缩短,呈阿米巴样形态[4],可通过分泌神经毒性物质(如ROS)和炎症细胞因子(如IL-1β、TNF-α等)产生细胞毒性作用[5-6]。已有研究证明,经典激活的小胶质细胞在神经炎症疾病中扮演着重要角色[7],故抑制小胶质细胞的M1型激活可成为治疗中枢神经系统炎症的重要途径。
马钱子苷(loganin)属环烯醚萜苷类化合物,为中国传统中药山茱萸(CornusofficinalisSieb.et Zucc.)的重要指标性成分,现已有研究发现其具有良好的抗炎、抗免疫及神经保护作用[8]。基于此,本研究以LPS刺激原代培养的小胶质细胞诱导炎症反应,探讨马钱子苷对小胶质细胞活化的影响及其分子机制,为马钱子苷应用于神经炎症的预防和治疗提供理论依据。
1 材料与方法
1.1 实验仪器
CFX96实时荧光定量PCR仪(美国Bio-Rad);Centrifuge 5810 R冷冻离心机(德国Eppendorf);CO2培养箱(美国Thermo Fisher);倒置荧光显微镜(日本Olympus BX51)。
1.2 实验试剂
马钱子苷(成都埃尔法生物科技有限公司);LPS(美国 Sigma);4%多聚甲醛固定液、引物(四川生工生物有限公司);小鼠抗Iba1抗体、兔抗iNOS抗体、兔抗CD68抗体、兔抗NF-κB抗体(英国 Abcam);Alexa Fluor 594 Conjugate山羊抗小鼠、Alexa Fluor 488 Conjugate山羊抗兔(美国Cell Signaling Technology);无菌PBS缓冲液、DAPI染色液(武汉博士德生物工程有限公司);Myco-3(德国Applichem);胰蛋白酶、DMEM培养基、10%胎牛血清(美国 Gibco);青链霉素混合液(北京索莱宝科技有限公司)。
1.3 实验材料
C57BL/6J小鼠3只,出生2 d,雌雄不限,购自湖南省长沙市天勤生物技术有限公司,动物质量合格证号SCXK(湘)2019-0014。
2 实验方法
2.1 原代小胶质细胞培养
C57BL/6J小鼠3只,出生2 d,脱臼处死,75%乙醇消毒3~5 s,取出全脑放入无菌PBS缓冲液中洗净表面血迹,移除小脑,剥离脑膜。吹吸粉碎大脑组织后600 r/min离心3 min,保留沉淀。0.125%胰蛋白酶37 ℃消化3~5 min,加入内含10%胎牛血清的DMEM完全培养基终止消化。使用70 μmol/L细胞筛过滤细胞悬液,离心,取底部沉淀即为细胞,加入小胶质细胞培养基(45 mL DMEM、5 mL PBS、100 μL青链霉素混合液、500 μL Myco-3)10~15 mL,移液枪吹打分散。将细胞悬液打入细胞培养瓶中,放入培养箱孵育,24 h后更换培养基,之后每3 d更换一次培养基,至细胞培养10 d左右后,用震荡分离法分离纯化即得原代小胶质细胞,将小胶质细胞以5×105的比例接种于24孔板中用于后续实验。
2.2 药物处理
将分离纯化得到的小胶质细胞接种于24孔板中,放入37℃,5% CO2的培养箱中培养。细胞分为4个组,分别为空白对照组、模型组和不同浓度的马钱子苷处理组(50、100、200 μmol/L),每组3个复孔。空白对照组不做特殊处理,模型组每孔加入10 μL LPS(10 μg/mL),给药组分别加入不同浓度马钱子苷,放入培养箱15~30 min后取出,除空白对照组外每孔加入LPS 10 μL,于CO2培养箱中培养24 h后进行后续检测。
2.3 免疫细胞染色及荧光成像

2.4 定量PCR检测炎症因子表达
药物处理24 h后,吸弃培养基,用PBS洗涤1遍,每孔加入1 mL Trizol裂解液,室温放置5 min提取细胞总RNA。按照逆转录试剂盒说明书进行纯化及反转录,得到cDNA。采用定量PCR技术,在扩增曲线的线性阶段测定每个反应的阈值扩增循环数(Ct)。每管反应混合物包括1 μL模板cDNA、5 μL MasterMix和1 μL引物,加入DEPC水,总体系为10 μL,瞬离后放入CFX96实时荧光定量PCR仪,在98 ℃预变性2 s,70 ℃退火5 s,并延伸,该过程重复35个循环,每个样品3个重复。内参基因为β-actin,相关基因的表达按照2-ΔΔct的方法计算。引物序列见表1。

表1 引物序列Table 1 Primer sequences
2.5 酶联免疫吸附测定(ELISA)
药物处理24 h后离心收集细胞上清液。按照BCA蛋白测定试剂盒说明书进行操作,得到标准曲线后,计算样品的总蛋白浓度,将样品稀释到相同浓度后严格按照ELISA试剂盒说明书操作测定TNF-α、IL-1β蛋白质表达水平。
2.6 数据统计及显著性分析
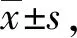
3 结果与分析
3.1 小胶质细胞分离纯化
混合小胶质细胞体外分离培养1~3 d时,可见悬浮于培养基中的圆形小胶质细胞及贴壁生长的片状、条状星形胶质细胞(如图1A~1C所示);4~5 d时,悬浮的小胶质细胞数量增多,底部星形胶质细胞呈片状铺满(如图1D、1E所示);6~8 d小胶质细胞数量逐渐增多至峰值,底部星形胶质细胞呈片状铺满(如图1F~1H所示)。混合培养一周左右,当上层悬浮的小胶质细胞生长到对数期时(大多数小胶质细胞还未长出分枝之前),从混合胶质细胞中将小胶质细胞分离纯化。刚分离纯化后的小胶质细胞在显微镜下观察呈圆形(如图1I所示),于体外培养1~2 d可见其形态不规则,呈短棒状,有突起伸出(如图1J、1K所示)。用细胞纯度检测方法:(IBA1标记的细胞数量/DAPI细胞数量)×100%,结果显示细胞纯度达到99.3%以上,可用于后续研究。

注:图A~H分别为分离培养1、2、3、4、5、6、7、8 d的混合胶质细胞;图I为从混合胶质细胞中刚纯化得到的小胶质细胞;图J为纯化得到的小胶质细胞在体外培养1 d的形态图;图K为纯化得到的小胶质细胞在体外培养2 d的形态图;图L为小胶质细胞免疫荧光染色图,IBA1标记小胶质细胞(红色),DAPI标记细胞核(蓝色)。图1 原代小胶质细胞分离纯化培养Fig.1 Isolation,purification,and culture of primary microglia
3.2 马钱子苷干预对LPS激活的小胶质细胞形态的影响
免疫细胞化学染色结果显示,与对照组相比,LPS处理组小胶质细胞可观察到呈现阿米巴样巨噬细胞形态,表明LPS能够成功诱导小胶质细胞向M1表型激活。且LPS处理后小胶质细胞胞体膨大,细胞核面积显著增加(P<0.005)。用3个不同浓度的马钱子苷干预后,均能显著减少小胶质细胞的细胞总面积和细胞核面积(P<0.001)(图2)。

注:IBA1(红色)标记小胶质细胞,DAPI(蓝色)标记细胞核,Merge表示三色叠加。图2 马钱子苷干预对LPS激活的小胶质细胞形态的影响Fig.2 Effects of loganin on LPS-activated microglia morphology
3.3 马钱子苷干预对LPS激活的小胶质细胞炎症因子mRNA表达的影响
定量PCR结果显示,与空白组相比,LPS组小胶质细胞所分泌的促炎性细胞因子IL-1β、TNF-α、IL-6的mRNA表达明显升高(P<0.05),表明此时的小胶质细胞由静息状态向M1型活化。与LPS组相比,50 μmol/L的马钱子苷预处理组TNF-α、IL-6的mRNA表达水平显著降低(P<0.05),IL-1β表达水平虽有下降但无统计学差异(P>0.05),而100 μmol/L与200 μmol/L的马钱子苷干预组TNF-α、IL-6和IL-1β的mRNA表达水平均显著下降(P<0.05)(如图3所示)。

图3 马钱子苷干预对LPS激活的小胶质细胞炎症因子mRNA表达的影响Fig.3 Effects of loganin on the expression of inflammatory cytokine mRNAs in LPS-activated microglia
3.4 马钱子苷干预对LPS激活的小胶质细胞iNOS蛋白表达的影响
诱导型一氧化氮合酶(iNOS)可催化生成一氧化氮(NO)从而参与炎症和肿瘤形成,本研究通过检测iNOS的蛋白表达量从而反映细胞发生炎性活化的程度。免疫细胞化学染色结果显示,与对照组相比,LPS组小胶质细胞绿色荧光增强,阳性染色面积更大,表示细胞被激活且细胞内有iNOS蛋白表达(图4B1~B4)。与LPS模型组相比,50、100、200 μmol/L的马钱子苷干预组均可见绿色荧光强度及染色面积都有一定程度的降低,细胞质内iNOS蛋白表达下降,表示细胞被激活但是激活程度有所降低(如图4 C1~ E4所示)。

注:iNOS(绿色)标记胞内iNOS蛋白,IBA1(红色)标记小胶质细胞,DAPI(蓝色)标记细胞核,Merge表示三色叠加。图4 马钱子苷干预对LPS激活的小胶质细胞iNOS蛋白表达的影响Fig.4 Effects of loganin on iNOS protein expression in LPS-activated microglia
3.5 马钱子苷干预对LPS激活的小胶质细胞炎症因子蛋白质含量的影响
ELISA(enzyme linked immunosorbent assay)结果显示,与对照组相比,LPS组细胞培养上清液中IL-1β、TNF-α的蛋白质含量显著增加(P<0.001);与LPS处理组相比,100 mmol/L马钱子苷干预组细胞IL-1β、TNF-α的含量显著减少(P<0.05)(图5)。

图5 马钱子苷干预对LPS激活的小胶质细胞炎症因子蛋白质含量的影响Fig.5 Effects of loganin on the protein contents of inflammatory factors in LPS-activated microglia
3.6 马钱子苷干预对LPS激活的小胶质细胞的NF-κB信号通路的影响
NF-κB为一种重要的多向性细胞核转录因子,NF-κB被激活后进入细胞核内发挥其重要作用,并参与炎症反应。本研究通过检测NF-κB在小胶质细胞细胞核内的表达情况,反映小胶质细胞的炎性活化程度。免疫细胞化学染色结果显示,与对照组相比,LPS组小胶质细胞绿色荧光更强(图6 B1),且胞体明显膨大(图6 B2),表示NF-κB信号通路被激活。与LPS模型组相比,50 μmol/L、100 μmol/L马钱子苷干预组细胞绿色荧光强度均有所降低(图6 C1、D1);在200 μmol/L马钱子苷干预下细胞绿色荧光强度甚至消失(图6 E1),细胞核及总细胞面积均有所减少(图6E2)。实验结果表明低、中、高浓度的马钱子苷干预能抑制LPS诱导的小胶质细胞NF-κB信号通路激活,从而抑制小胶质细胞向M1型极化。

注:NF-κB(绿色)标记胞内NF-kB蛋白,IBA1(红色)标记小胶质细胞,DAPI(蓝色)标记细胞核,Merge表示三色叠加。图6 马钱子苷干预对LPS激活的小胶质细胞的NF-kB信号通路的影响Fig.6 Effects of loganin on NF-κB signaling pathway of LPS-activated microglia
4 讨论
小胶质细胞在大脑的发育、脑环境的维持和脑疾病监视中起着重要作用[9-10],其能够通过吞噬细胞碎片和蛋白聚集体维持中枢神经系统的稳定性[11]。正常情况下,小胶质细胞处于相对静息状态,但在遭受脑损伤后,小胶质细胞可以被激活为M1表型和M2表型[12]。其中M1表型小胶质细胞可产生促炎细胞因子(如TNF-α,IL-1β,IL-12),并表达高水平的诱导型一氧化氮合酶(iNOS)以促进NO的产生,这些炎症介质的进一步积累可引起神经毒性,并损伤神经元[13]。小胶质细胞的活化状态与脑内受损伤部位的严重程度密切相关,因此,寻找一种能够抑制小胶质细胞M1型活化的药物成为脑疾病治疗的研究热点。
LPS是一种已知的神经毒素[14],可刺激小胶质细胞成M1表型并表达促炎细胞因子,诱导神经炎症的发生,目前被作为神经退行性变的胶质细胞激活剂广泛应用[15]。本研究利用LPS处理原代培养的小胶质细胞,并分别给予低、中、高浓度的马钱子苷干预。结果显示,LPS刺激的小胶质细胞胞体膨大、分支缩短,呈现出明显活化的阿米巴样形态。而用马钱子苷干预后,小胶质细胞的细胞总面积及细胞核面积均显著减少,几乎恢复到与空白对照组相当的水平,并观察到细胞呈现与空白对照组相似的分支形态。有研究发现,细胞肥大是其活化后蛋白表达增加的表现[16]。本研究也发现,LPS处理后,小胶质细胞分泌的促炎细胞因子量显著增加,而3个不同浓度的马钱子苷均可显著下调LPS诱导的小胶质细胞TNF-α、IL-6和IL-1β的mRNA表达增加;中浓度的马钱子苷能使LPS刺激的小胶质细胞分泌IL-1β、TNF-α的蛋白质含量显著降低;3个不同浓度的马钱子苷均能下调LPS诱导的小胶质细胞iNOS蛋白表达。
核转录因子-κB (NF-κB)是一种能控制DNA的转录、细胞因子合成的蛋白复合物,广泛存在于神经元及胶质细胞中,能够调节多种基因的表达并参与免疫反应[17]。iNOS是NF-κB信号转导通路中的重要转导分子,iNOS基因的部分启动子序列能与NF-κB特异性结合,从而使NF-κB被激活并转移至细胞核内,发挥转录因子的作用,编码相应产物(如iNOS、TNF-α、IL-6等)[18]。因此,阻断此通路对于活化小胶质细胞引起的神经炎性疾病的治疗具有重要意义。本实验进一步探索了马钱子苷干预对小胶质细胞的NF-κB信号通路的影响,我们的研究发现,当LPS处理后iNOS蛋白表达量增加,这让NF-κB的核转移程度显著升高,NF-κB信号通路被激活,细胞表现为M1型。但低、中、高剂量的马钱子苷能抑制NF-κB的核转移,从而抑制细胞向M1表型转化。上述结果提示,马钱子苷可抑制小胶质细胞的M1型活化,降低炎症因子表达,其相关分子机制可能与抑制NF-κB信号通路激活有关。

