马钱子苷对神经干细胞的增殖、存活和分化的调节作用
张进强,易赛妮,申琳敏,李良远,肖承鸿,唐鑫,刘芹,苏大鹏,胥春云,周涛
(贵州中医药大学,贵州 贵阳 550025)
神经干细胞是一类具有自我更新、分裂及多向分化能力的干细胞亚群,广泛存在于哺乳动物脑内的嗅球、海马齿状回、大脑皮层等部位,是构成神经发生的重要细胞基础[1-2]。传统认为神经发生过程只存在于胚胎发育过程中,在哺乳动物成年后,神经发生过程便会停止。但近年的研究发现,成年哺乳动物的海马颗粒细胞下层区和室管膜下区存在一定数量的神经干细胞,在特定条件下,这些神经干细胞可分化为神经元或胶质细胞,从而参与神经功能的修复过程[3]。已有研究证明,成年哺乳动物的神经发生在脑损伤、脑缺血、癫痫和抑郁、阿尔茨海默病等疾病的治疗中发挥了积极的作用,药理学调控神经干细胞功能可为神经系统疾病的治疗开辟新的研究领域[4-5]。
马钱子苷(Loganin)为常用中药山茱萸(CornusofficinalisSieb.et Zucc.)的主要活性成分,又名马钱素、番木鳖苷,属于环烯醚萜类化合物,已发现其有良好的抗炎、免疫调节及神经保护作用[6]。本实验基于马钱子苷对神经系统的调节作用,从成年小鼠大脑中分离培养神经干细胞,观察不同浓度的马钱子苷对神经干细胞增殖、存活和分化的影响,为神经干细胞治疗中枢神经系统疾病的研究奠定理论和实验基础。
1 材料与方法
1.1 材料
成年C57BL/6J小鼠(8周龄)购自湖南省长沙市天勤生物技术有限公司(质量合格证号SCXK(湘)2019-0014);DMEM/F12高糖培养基(货号:12400-024)、表皮生长因子蛋白EGF(货号:PHG0311)、N 2 Supplement(货号:17502048)、B-27添加剂(货号:17504-044)购自美国Gibco公司;细胞生长因子FGF(货号:13256029)购自美国Invitrogen公司;抗支原体试剂(货号:1944020)、青链霉素混合液(货号:P1400)购自北京索莱宝科技有限公司;GFAP抗体(货号:80788S)、MAP2抗体(货号:8707S)、BrdU抗体(货号:5292S)购自美国Cell Signaling Technology公司;Olig 2抗体(货号:ab236540)购自美国Abacm公司;马钱子苷(货号:FY1475,纯度98%)、水合氯醛(货号:302-17-0)购自四川生物工程有限公司。
1.2 神经干细胞的分离与培养
成年C57BL/6J小鼠用水合氯醛麻醉,用75%的乙醇浸泡消毒10 s,于超净工作台中颈椎脱臼处死,取出完整大脑放入装有无菌PBS的培养皿中,剥去脑膜,保留神经干组织转移至装有无菌PBS的培养皿中,吹打,使组织分散后移至15 mL离心管内,500 r/min离心2 min,弃上清,迅速加入0.25%胰酶细胞消化液1 mL,于37 ℃水浴锅中消化5 min,加入胎牛血清终止消化,1200 r/min离心5 min,弃上清,加入6 mL增殖培养基(含有94.29% DMEM/F12高糖、1.94% B-27、0.97% N2、20 ng/mL的EGF、FGF各0.19%、1.21%双抗和1.21%抗支原体试剂)。将细胞悬液稀释到1×105并接种于24孔板中,放入37 ℃,5% CO2的培养箱中培养。每天利用倒置显微镜观察细胞生长情况并拍照记录。
1.3 神经干细胞增殖培养及药物处理
收集生长状态良好的第二代神经干细胞球,500 r/min离心3 min,弃上清,加1 mL胰酶吹打,5 min后加入3 mL DMEMF12,1000 r/min离心5 min,去上清,加入增殖培养基至6 mL,接种于24孔板中,放入37 ℃,5% CO2的培养箱中培养。细胞分为4个组,分别为空白组(用无血清培养基培养)、马钱子苷处理组(浓度分别为50、100、200 μmol/L 3组)。每组3个复孔,连续7 d观察并拍照记录各组神经球的直径和数量。
1.4 神经干细胞分化培养及药物处理
收集生长状态良好的第二代神经干细胞球,500 r/min离心3 min,弃上清,加入3 mL分化培养基(含89.9% DMEM/F12高糖、0.9% N2、1.8% B-27、1.2% 双抗、1.2% 抗支原体、5% 驴血清)吹打,1000 r/min离心5 min,去上清,加入分化培养基至6 mL,接种于24孔板中,放入37 ℃,5% CO2的培养箱中培养。细胞分为4个组,分别为空白组(用分化培养基培养)、马钱子苷处理组(浓度分别为50 、100、200 μmol/L 3组),每2 d进行半量换液,吸除各孔500 μL分化培养基,再各加500 μL新的分化培养基。每组3个复孔,连续观察,7 d后进行免疫荧光染色。
1.5 细胞固定及免疫荧光染色
在神经干细胞有丝分裂研究中,神经干细胞培养6.5 d后,用100 ng/mL的5-溴-2-脱氧脲苷(BrdU)处理神经干细胞,12 h后进行细胞固定。在分化研究中,分化培养的神经干细胞在培养第7 d进行固定。细胞固定时,吸弃24孔板中的分化培养基,各孔中加500 μL 4%多聚甲醛固定30 min,加入300 μL的0.5%的TritonX-100通透15 min,加300 μL的10% 驴血清封闭1 h,吸去驴血清,每孔加一抗(BrdU、MAP 2、GFAP、Olig 2),4 ℃孵育过夜。24 h后PBS洗涤3次,每次3 min,避光下加入二抗,37 ℃孵育1 h,PBS洗涤3次,最后滴加5 μL抗荧光衰减封片剂,取出载玻片,用盖玻片覆盖,在激光共聚焦电子显微镜下观察。
1.6 显微成像及图片分析
将分化培养的神经干细胞空白组和给药马钱子苷组中的3个复孔各选具有代表性的5个视野连续7 d拍照并观察细胞生长情况。培养7 d后分化的神经干细胞经免疫荧光染色送往Servicebio公司进行普通切片扫描(荧光双标,三色)。将切片扫描后的图片经过CaseViewer软件打开,空白组和马钱子苷组的各3个复孔均选取5个具代表性视野截屏,然后借助ImageJ软件计数并统计。
1.7 数据统计及显著性分析

2 结果与分析
2.1 马钱子苷对神经干细胞增殖和存活的影响
将培养的成年神经干细胞分离成单细胞,细胞边缘具有折光性(图1(a))。分离培养3 d的神经干细胞是由5~25个单细胞聚集而成的球形(图1(b));分离培养5 d后,神经干细胞由12~65个单细胞聚集而成,体积相对增大,神经球边缘较规整(图1(c));分离培养7 d后,神经干细胞由20~110个单细胞聚集而成神经球,体积大,神经球直径约150 μmol/L,边缘规整且折光性强。
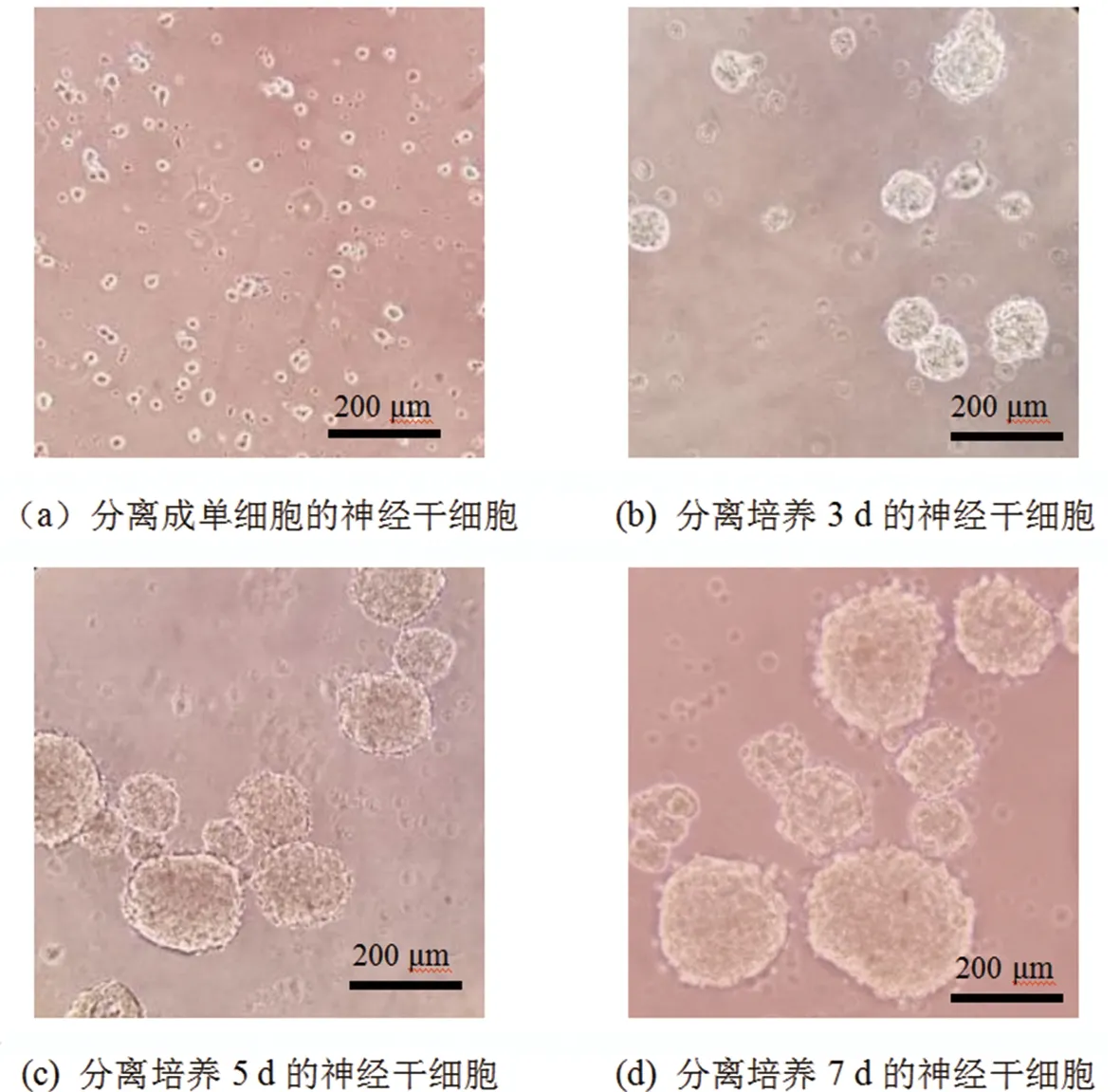
图1 成年小鼠神经干细胞纯化Fig.1 Purification of adult mouse neural stem cells
在不同浓度马钱子苷干预下,增殖培养1 d和3 d的神经干细胞细胞直径和神经球数量与对照组相比均无明显差异(P>0.05)(图2(a)、2(b));神经干细胞在含有低、中、高浓度(50、100、200 μmol/L)马钱子苷的增殖培养基中培养5 d后,各组神经球的直径均明显变大(P<0.05),其中,马钱子苷低、中、高剂量组的神经球直径分别增加了28.0%、30.4%、41.6%,与此同时,马钱子苷中、高剂量组中神经干细胞成球的数量在培养5 d后与对照相比也显著增加(P<0.05),分别增加了53.8%和34.6%;而低剂量组的神经球数量与对照相比无明显变化(P>0.05)(图2(c))。神经干细胞在含有低、中、高浓度马钱子苷的增殖培养基中培养7 d后,各组神经球的直径与对照相比进一步增大(P<0.05),神经球直径分别增加了20.6%、33.3%、46.6%,与此同时,马钱子苷低、中、高剂量组中神经干细胞成球的数量在培养7 d后与对照相比也显著增加(P<0.05),分别增加了44.4%、66.6%和63.8%(图2(d))。

注:A~D为增殖培养的神经干细胞显微图;E和F为增殖培养的神经球直径及数量统计图;CK为对照组,数据显示为*P<0.05,**P<0.01 ,***P<0.005 相比CK组,单因素方差分析。图2 马钱子苷干预对神经干细胞增殖和存活的影响Fig.2 Effects of Loganin on the proliferation and survival of neural stem cells
2.2 马钱子苷对神经干细胞有丝分裂的影响
单细胞增殖活性检测结果显示,神经干细胞在含有中、高剂量马钱子苷的增殖培养基中培养12 h后,完成有丝分裂的神经干细胞(BrdU阳性标记)的细胞数量与对照组相比有显著增加(P<0.05),而低剂量组的BrdU阳性标记的神经干细胞数量与对照相比无明显变化(P>0.05)(图3)。
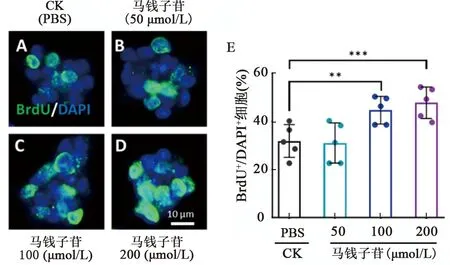
注:A~D,有丝分裂后的神经干细胞的免疫荧光染色图,BrdU(绿色)标记完成有丝分裂后的细胞,DAPI(蓝色)标记所有细胞核;E为各组中完成有丝分裂的神经干细胞占总细胞的百分比;CK为对照组,数据显示为相比CK组,单因素方差分析。图3 马钱子苷干预对神经干细胞有丝分裂的影响Fig.3 Effects of Loganin on the caryomitosis of neural stem cells
2.3 马钱子苷对神经干细胞分化的影响
神经干细胞在含有低、中、高浓度马钱子苷的分化培养基中培养3 d后,采用免疫细胞化学染色检验神经干细胞的分化情况。结果显示,与对照组相比,低剂量马钱子苷处理组的神经干细胞发生分化的比率由60.3%增加到74.5%(P<0.01),而未分化的神经干细胞的比例由39.7%减少到25.5%(P<0.01);而马钱子苷中、高剂量组的神经干细胞分化率被显著抑制(P<0.05),未分化的神经干细胞的比例显著升高(P<0.05)(图4)。
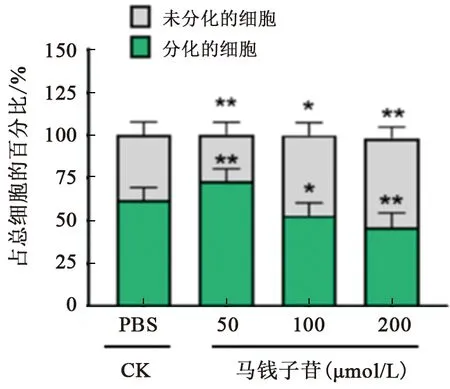
注:CK为对照组,数据显示为*P<0.05,**P<0.01 相比 CK组,单因素方差分析。图4 马钱子苷干预对神经干细胞分化的影响Fig.4 Effects of Loganin on the differentiation of neural stem cells
2.4 马钱子苷对神经再生的影响
神经干细胞在含有低、中、高浓度马钱子苷的分化培养基中培养7 d后,采用免疫细胞化学染色检验神经再生情况。结果显示,与对照组相比,低剂量马钱子苷处理后,MAP2标记的细胞(神经元)数量及比例显著增加(P<0.01),马钱子苷中剂量组的MAP2标记的细胞数量及比例无明显变化(P>0.05),马钱子苷高剂量组的MAP2标记的细胞数量及比例显著减少(P<0.05)(图5)。
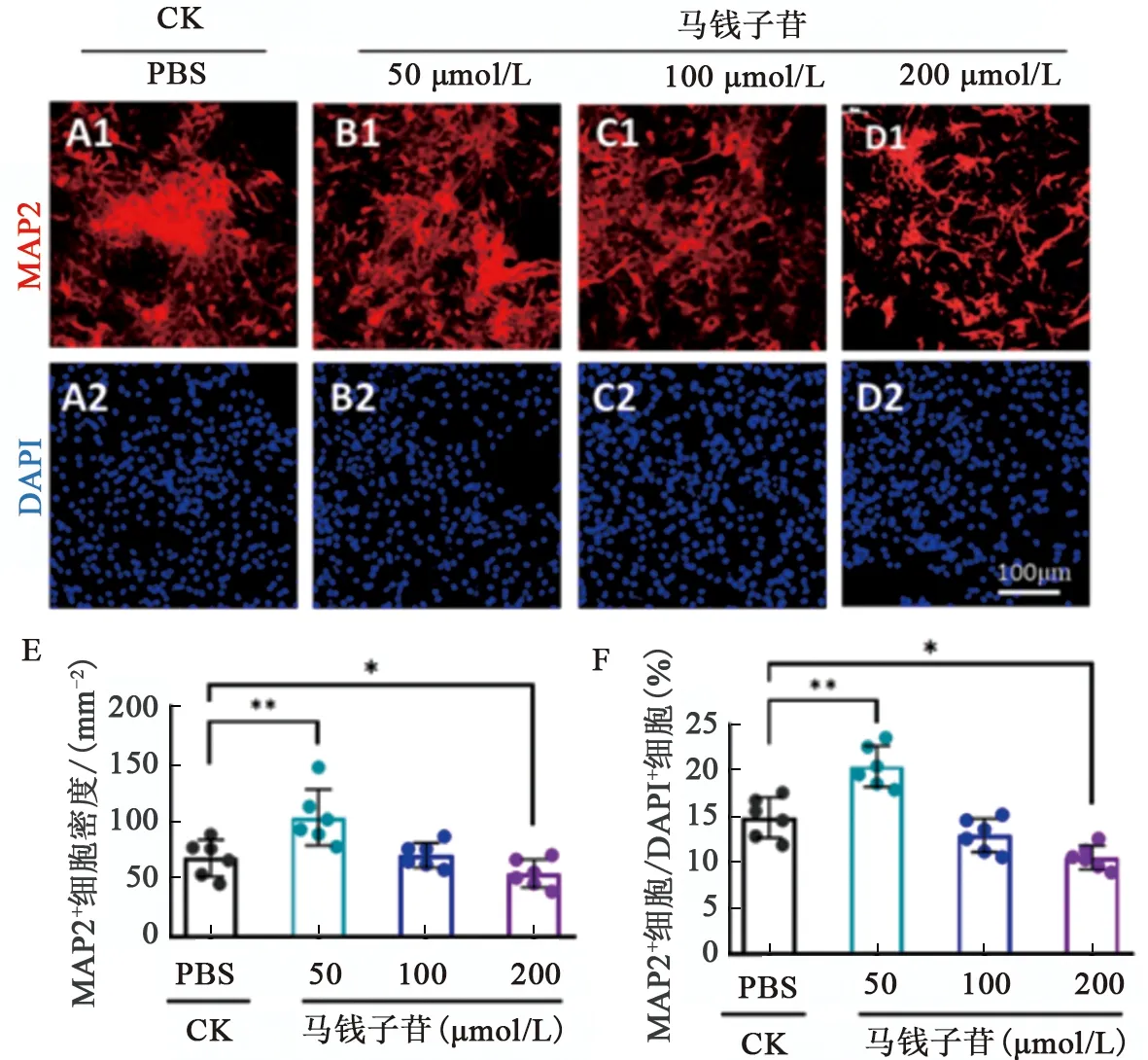
注:A1~D2为神经干细胞向神经元分化的免疫荧光染色图,MAP2(红色)标记神经元,DAPI(蓝色)标记所有细胞核;E和F为统计各组中神经元的数量及分化比例;CK为对照组,数据显示为 相比CK组,单因素方差分析。图5 马钱子苷对神经再生的影响Fig.5 Effects of Loganin on neurogenesis
2.5 马钱子苷对星形胶质细胞再生的影响
神经干细胞在含有低、中、高浓度马钱子苷的分化培养基中培养7 d后,采用免疫细胞化学染色检验星形胶质细胞再生情况。结果显示,与对照组相比,低剂量马钱子苷处理后,GFAP标记的细胞(星形胶质细胞)数量及比例显著增加(P<0.05),马钱子苷中、高剂量组的GFAP标记的细胞数量及比例无明显变化(P>0.05)(图6)。
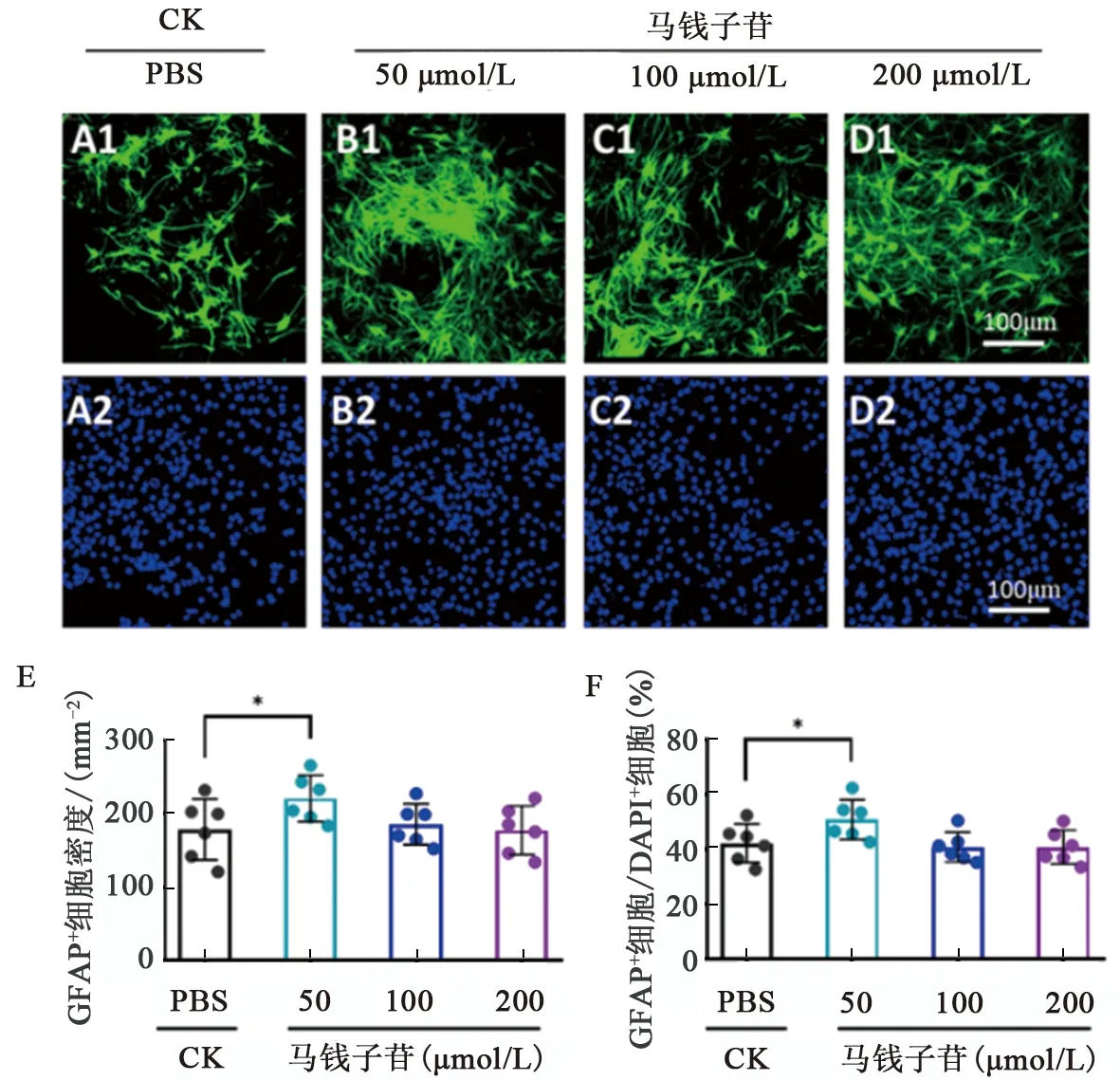
注:A1~D2为神经干细胞向星形胶质细胞分化的免疫荧光染色图,GFAP(绿色)标记星形胶质细胞,DAPI(蓝色)标记所有细胞核;E和F为统计各组中星形胶质细胞的数量及分化比例;CK为对照组,数据显示为 相比CK组,单因素方差分析。图6 马钱子苷对星形胶质细胞再生的影响Fig.6 Effects of Loganin on astrocyte regeneration
2.6 马钱子苷对少突胶质细胞再生的影响
神经干细胞在含有低、中、高浓度马钱子苷的分化培养基中培养7 d后,采用免疫细胞化学染色检验少突胶质细胞再生情况。结果显示,与对照组相比,马钱子苷低、中、高剂量组的Olig 2标记的细胞(少突胶质细胞)数量及比例无明显变化(P>0.05)(图7)。

注:A1~D2为神经干细胞向少突胶质细胞分化的免疫荧光染色图,Olig 2(红色)标记少突胶质细胞,DAPI(蓝色)标记所有细胞核;E和F为统计各组中少突胶质细胞的数量及分化比例;CK为对照组。图7 马钱子苷对少突胶质细胞再生的影响Fig.7 Effects of Loganin on oligodendrocyte regeneration
3 讨论
成年哺乳动物大脑中的神经干细胞是一类具有增殖和分化潜能的干细胞亚群,在神经组织受损时,神经干细胞经历增殖、分化、迁移、存活和成熟等一系列过程,将新生神经元整合到受损脑区,取代受损神经细胞,并建立新的神经通路,从而起到神经组织修复的作用[7-11],提高神经干细胞的增殖和分化能力有利于神经组织的修复。本研究发现成年小鼠神经干细胞在含有中、高浓度马钱子苷的增殖培养基中培养5 d后,神经球的数量与对照相比显著增加,表明中、高剂量的马钱子苷能够促进成年小鼠神经干细胞的存活。这与以前报道的结果相一致[12]。神经干细胞增殖过程通常与其有丝分裂的速度有关[3]。本研究发现,中、高剂量的马钱子苷能够促进神经干细胞的有丝分裂过程,并增加神经球的直径,表明中、高剂量的马钱子苷能够通过促进成年小鼠神经干细胞的有丝分裂活性来提高其增殖能力。
在适宜条件下,神经干细胞能够分化成神经元、星形胶质细胞或少突胶质细胞,该过程称为细胞的“命运决定”[2]。在神经干细胞分化的过程中,特殊药物的干预能够影响细胞的命运决定[10-12]。本研究发现,低剂量马钱子苷处理显著促进神经干细胞发生分化,并增加神经元和星形胶质细胞的数量及比例,这一结果表明低剂量的马钱子苷为神经干细胞提供了一个适宜于分化的条件,有利于神经元和星形胶质细胞再生。但中、高剂量马钱子苷会减少分化的神经干细胞数量,原因可能在于高浓度的药物干预对于细胞来说是一个危险信号,这种危险信号可促进神经干细胞数量的增多,并累积大量未分化的神经干细胞,这些累计的细胞可分化为神经元和星形胶质细胞等从而应对风险。故高浓度的马钱子苷更偏向于促进神经干细胞的增殖,相当于为神经干细胞提供一个足够的、可供分化的“库存”。
神经干细胞的增殖和分化并非是两个相互独立的过程,在成年哺乳动物大脑中,通常需要维持一定数量的神经干细胞[3]。因此,在正常生理条件下,神经干细胞的增殖和分化几乎是同步进行的。但是,在病理条件下,神经干细胞的增殖能力可能会受到抑制,进而影响新生神经元的数量,神经元代偿不足而导致病情恶化。药物对神经干细胞增殖分化的调节作用均有明显的剂量效应,浓度过高或过低都有可能呈现相反的效果[10]。本研究发现50 μmol/L的马钱子苷能够促进神经干细胞分化,同时也能轻微地促进神经干细胞增殖,提示该剂量可能是一个较好的处理剂量。中、高剂量的马钱子苷能够显著促进神经干细胞增殖,但会抑制神经干细胞分化,这一结果提示,在治疗疾病时,可先用高剂量马钱子苷诱导神经干细胞增殖,让体内形成大量神经干细胞,再用低剂量马钱子苷诱导神经干细胞分化,便可形成最多数量的新生神经元。这些研究结果可为神经疾病的药物治疗提供线索。

