清胃散合玉女煎对牙周炎大鼠炎症因子和细胞外基质金属蛋白酶的影响*
孙欣彤 于艳华 李梦佳 王左敏
牙周炎是由细菌引起的一种常见的口腔疾病,其主要特征为牙齿支持组织被破坏、牙周附着物和骨质丧失,该疾病已影响着世界7.43 亿人口,是最常见的6 大疾病之一[1,2],且该病属于慢性炎症,随着病情的发展可损伤牙周组织,引起牙周溢脓甚至导致牙齿松动[3]。引起牙周炎的病因较为复杂,而口腔内微生物大量繁殖,特别是龈沟处菌斑微生物异常繁殖是导致牙周炎的重要原因[4]。牙周炎的发生常会导致患者牙齿松动、牙龈出血、牙槽骨吸收等一系列症状,严重影响患者的口腔健康。临床治疗牙周炎的常规方法以西医基础治疗为主,但目前治疗效果一般,难以达到根治的目的,而且容易反复发作[5]。此外,虽然抗生素治疗可减轻牙周组织的破坏,但由于牙周复杂的结构和细菌的耐药性,很难完全清除牙周中的病原菌[6]。而手术治疗也只适用于少数牙周炎患者,而且术后原部位复发的风险较大[7]。近些年,中医治疗牙周炎的效果较为显著,清胃散和玉女煎是经典的中药方剂,具有清热、滋补肾阴、控制口腔感染、治疗口腔炎症等功效[8]。
有研究指出,细胞外基质(ECM)的降解是牙齿支持组织破坏的第一个阶段[9]。基质金属蛋白酶(MMPs)是一类分解细胞外基质组分的锌蛋白酶,在ECM 降解中起重要作用,此外,炎症因子与牙周炎的发生发展密切相关。因此,本研究探讨清胃散合玉女煎对牙周炎大鼠炎症因子和细胞外基质金属蛋白酶的影响,望为临床治疗提供参考。
1.材料与方法
1.1 实验动物 选取4 周龄健康specific pathogen-free(SPF)级Sprague-Dawley(SD)大鼠60只,雌雄各半,体质量180~220g,平均(200±10)g,购自中国医学科学院放射医学研究所动物实验中心(批准号:CNU IACUC-YB-2018-51),饲养于23~25℃、相对湿度45%~60%及光照12h 的环境中。
1.2 药物与试剂 清胃散的组成方剂:黄连10g、生地黄12g、当归12g、升麻6g、甘草10g和丹皮10g。玉女煎的组成方剂:生石膏30g、熟地黄12g、知母12g、麦冬9g、牛膝9g 和丹皮10g。首次加15 倍量水浸泡30min,煎煮1.5h,第2 次加水10 倍量,煎煮1h,合并煎煮液后,减压浓缩至原药材量∶煎煮体积=1∶1。
Trizol 试剂(美国Invitrogen Carlsbad),免疫荧光制剂和无酶的RNA(美国MA),龙胆紫溶液(青岛海博生物),聚丙烯酰胺(上海源叶生物),15%过硫酸铵钠(江苏艾康生物)和四甲基乙二胺(中国西格玛奥德里奇),直径0.2mm 口腔正畸用结扎细钢丝(杭州奥索),牙周探针(上海艾欣),光学显微镜(德国ZEISS),酶联免疫吸附实验所用试剂盒均购置于赛默飞世尔科技有限公司;生化实验所用试剂购置中生北控股份有限公司。
1.3 实验方法及造模 60 只SD 大鼠随机均分为对照组(正常饲养)、模型组和治疗组。模型组和治疗组大鼠腹腔注射氯胺酮以全身麻醉,以口腔正畸用结扎钢丝及棉线结扎双侧第1 磨牙,尽可能避免结扎后滑脱,结扎后定期复查;采用高糖高粘饮食联合涂菌法建立牙周炎模型。此外,治疗组大鼠采用清胃散合玉女煎汤剂灌胃,0.1mL·kg-1/ d,连续30d,模型组和对照组灌以等体积的无菌蒸馏水。
1.4 观察指标
1.4.1 实时荧光定量PCR(real timequantitative PCR,RT-PCR)法检测大鼠龈沟液中的细菌 各组大鼠干预30 d 后,吸潮纸收集龈沟液,采用RT-PCR 技术检测龈沟液中牙龈卟啉单细胞菌(Porphyrin gingival monocyte,Pg)、福赛类杆菌(Tacillus forsythiae,Tf)及放线杆菌(Actinobacillus actinomycetemcomitans,Aa)的含量,扩增体系包含cDNA 2μL、正向引物0.4μL、反向引物0.4μL、H2O27.2μL 和SYBR 10μL,扩增条件为95℃预变性15min、95℃35 循环变性15s、58℃退火15s及72℃延伸30s。
1.4.2 牙龈指数(Periodontal index,GI)、附着丧失水平(attachment loss,AL) 及龈沟出血指数(sulcus bleeding index,SBI)检测 各组大鼠干预30 d 后,处死并检测GI、AL 及SBI。GI 测定方法:用探针按照顺时针的方向,由远→颊→近→近→颊→远,每个牙检查4 个面,分别记分,即颊(唇)侧乳头、颊(唇)远中乳头、颊(唇)侧龈缘、整个舌面龈缘,牙龈健康为0 分,牙龈轻度炎症(牙龈的色有轻度改变并轻度水肿,探诊不出血)为1 分,牙龈中等炎症(牙龈色红,水肿光亮,探诊出血)为2 分,牙龈严重炎症(牙龈明显红肿或有溃疡,并有自动出血倾向)为3 分;得分越高,情况越差[13]。AL 测定方法:应用牙周探针探测龈沟,当探针超过组织学深度达到结合上皮后,正常数值为2~3mm,患有牙周炎时,探针深度超过3mm 时,用测量数据减去2~3mm 即为附着丧失水平[13]。SBI分为6 级,其中0 级为牙龈健康、无出血现象,1 级为探针有出血、龈沟无水肿及颜色改变,2 级为探诊出血、龈沟有颜色改变、但无水肿现象,3 级为探诊出血、龈沟有颜色改变及轻度水肿现象,4 级为探诊出血、龈沟有颜色改变及水肿现象明显,5 级为自发性出血,龈沟重度水肿及颜色改变明显[14]。
1.4.3 炎症因子和细胞外MMPs 检测 各组大鼠处死后取其部分牙龈组织,打碎离心取上清液,采用酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)检测牙龈组织上清液和龈沟液中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及白细胞介素-1β(interleukin-1β,IL-1β)及白细胞介素-6(interleukin-6,IL-6)的浓度;采用日立-7180 全自动生化分析仪检测各组大鼠龈沟液天冬氨酸转移酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)水平。采用ELISA 测定各组大鼠龈沟液中基质金属蛋白酶-1(matrix metalloproteinase-1,MMP-1)、基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2) 及基质金属蛋白酶-9 (matrix metalloproteinase-9,MMP-9)。
1.5 统计学分析 采用SPSS21.0 进行数据处理与分析,计数资料以百分率(%)表示,采用χ2检验;计量资料以()表示,采用t 检验,以P<0.05表示差异有统计学意义。
2.结果
2.1 各组大鼠牙周组织组织学变化情况 采用苏木精和伊红染色观察各组大鼠牙周组织组织学变化,对照组牙周组织完整,有少量炎症细胞浸润。模型组炎症明显,炎症细胞浸润增加。治疗组大鼠炎症细胞浸润明显减少,水肿改变减轻(图1)。

图1 各组大鼠牙周组织组织学变化情况
2.2 各组Pg、Tf、Aa 检出率比较 治疗组经治疗后,Pg、Tf、Aa 检出率分别为5.00%、0.00%和0.00%均显著低于模型组的18%、17%和7%,差异具有统计学意义(P<0.05),而与对照组检出率比较无明显差异(P>0.05),见表1。
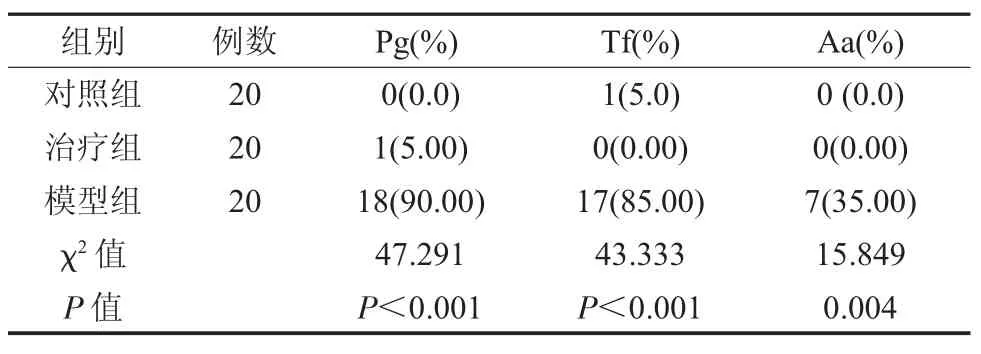
表1 各组Pg、Tf、Aa 检出率比较(%)
2.3 各组牙周指标比较 治疗组经治疗后,GI、AL、SBI 指标分别为0.15±0.05、0.63±0.17、1.01±0.22 均显著低于模型组的0.35±0.11、0.83±0.16、2.17±0.53,差异具有统计学意义(P<0.05),而与对照组比较无明显差异(P>0.05),见表2。
表2 各组牙周指标比较()
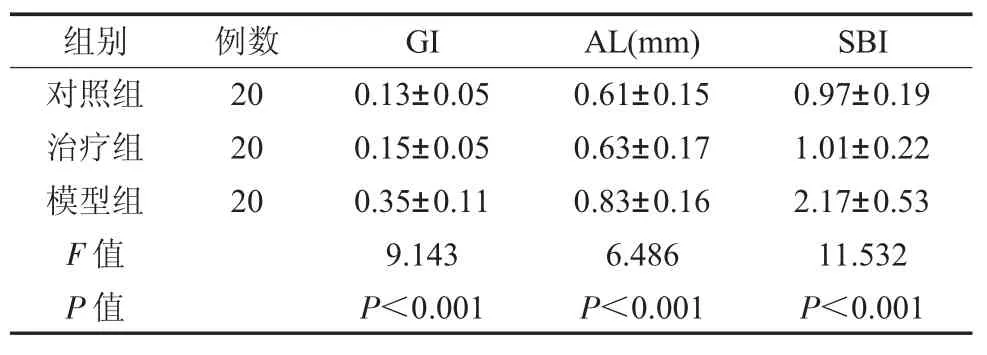
表2 各组牙周指标比较()
2.4 各组组织上清液中炎症因子水平比较 治疗组经治疗后,组织上清液中炎症因子TNF-α、IL-1β 和IL-6 水平分别为62.14±2.21ng/ ml、198.45±4.12pg/ ml、189.11±2.14pg/ ml 相比对照组明显较高(P<0.05),但均显著低于模型组的96.19±3.27ng/ ml、291.22±5.79pg/ ml、272.82±4.30pg/ ml,差异具有统计学意义(P<0.05),见表3。
表3 各组组织上清液中炎症因子水平比较()
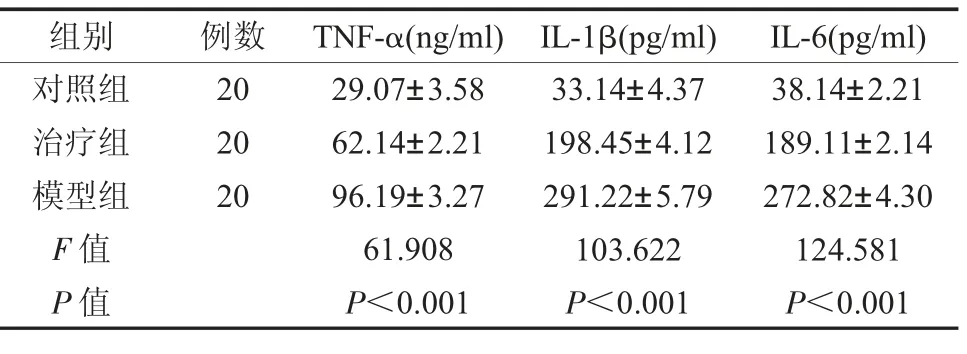
表3 各组组织上清液中炎症因子水平比较()
2.5 各组龈沟液中炎症因子水平比较 治疗组经治疗后,龈沟液中炎症因子TNF-α、IL-1β 和IL-6 水平分别为92.74±2.18ng/ ml、57.45±5.14pg/ ml、228.07±2.81pg/ ml 相比对照组明显较高(P<0.05),但均显著低于模型组的136.91±1.75ng/ ml、375.63±6.67pg/ ml、357.37±1.61pg/ ml,差异具有统计学意义(P<0.05),见表4。
表4 各组龈沟液中炎症因子水平比较()
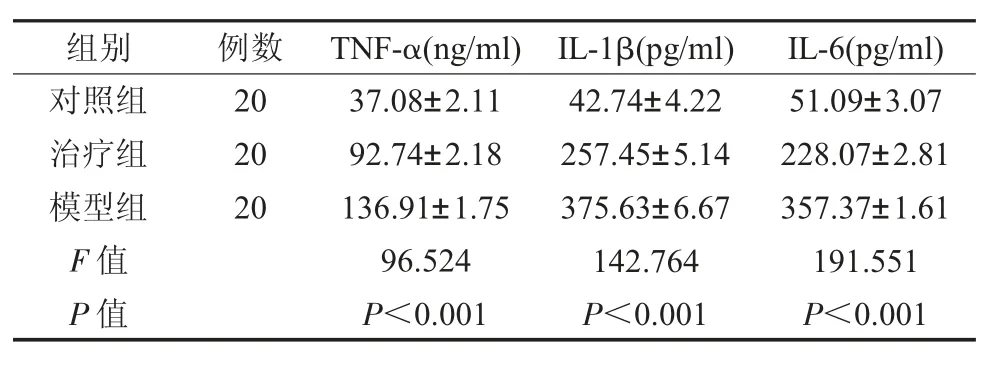
表4 各组龈沟液中炎症因子水平比较()
2.6 各组AST、ALP、ALT 水平比较 治疗组经治疗后,AST、ALP、ALT 水平分别为167.10±11.40U/ L、127.90±11.10U/ L、138.07±7.83U/ L,相比对照组明显较高(P<0.05),但均显著低于模型组的251.40±9.24U/ L、184.20±7.80U/ L、217.37±8.61U/ L,差异具有统计学意义(P<0.05),见表5。
表5 各组AST、ALP、ALT水平比较()

表5 各组AST、ALP、ALT水平比较()
2.7 各组MMP-1、MMP-2、MMP-9 水平比较 治疗组经治疗后,基质金属蛋白酶MMP-1、MMP-2、MMP-9 水平分别为0.05±0.01ng/ ml、85.70±1.14ng/ ml、84.46±5.83ng/ ml 相比对照组明显较高(P<0.05),但均显著低于模型组的0.11±0.01ng/ ml、105.19±1.03ng/ ml、130.99±4.54ng/ ml,差异具有统计学意义(P<0.05),见表6。
表6 各组MMP-1、MMP-2、MMP-9 水平比较()
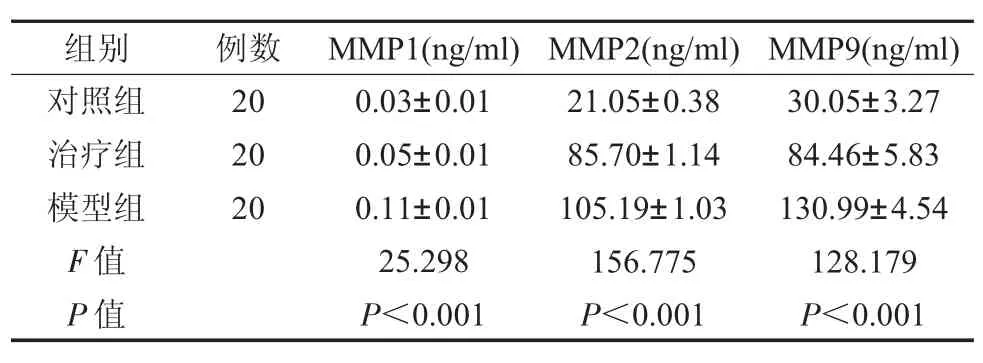
表6 各组MMP-1、MMP-2、MMP-9 水平比较()
3.讨论
牙周炎是一种常见的慢性疾病,严重影响患者的生活质量,该病形成的主要原因为牙龈、牙体相交结合部位与牙龈沟中累积的微生物病原菌异常繁殖,导致牙周组织炎症的发生[10-11]。可见,微生物等病原菌感染是诱发牙周炎的始动因子,对牙周致病病原菌进行密切观测和治疗将有助于牙周炎的疗效判断[12,13]。尽管常规治疗可清除菌斑,控制炎症,但对已受损的牙骨、牙周组织却无法进行修复。中医认为牙周炎的发生与胃肾失调相关,“清热泻火”、“安肾固齿”是治疗牙周炎的主要原则[14]。玉女煎可滋肾清火,安肾固齿,清胃散具有清热解毒、抗炎抑菌等功效,是治疗牙周炎的经典处方。研究表明,诱发牙周炎的始动因子为革兰氏阴性菌,主要包括牙龈卟啉单细胞菌、福赛类杆菌、放线杆菌等[15]。本研究通过PCR 技术检测用药治疗后大鼠龈沟液中牙龈卟啉单细胞菌、福赛类杆菌、放线杆菌后发现,相比模型组其检出率显著下降,可见清胃散合玉女煎可有效抑制和清除牙周炎龈沟液中有害病原菌,与刘小龙研究结果较为一致[16]。此外,本研究通过观察用药治疗后大鼠牙周指数、附着丧失及龈沟出血指数发现,与模型组相比牙周指标均显著降低,说明清胃散合玉女煎可显著改善牙周指标,保护牙周组织健康。
牙周炎的发生常伴有不同程度的炎症反应,炎性细胞因子常作为监测和诊断牙周炎症严重程度的敏感标记物[17]。牙周受致病菌感染,导致牙周膜、牙骨质、牙龈等组织受到炎症性的损坏,引发宿主细胞的免疫反应,炎性因子水平升高又会导致牙周组织继发性损伤[18]。同时,致病菌及其毒性产物又可刺激牙周组织TNF-α、IL-1β、IL-6 等炎性因子的表达,激活牙周破骨细胞核胶原酶,导致牙周组织进一步受到破坏[19,20]。TNF-α 是一种介导多向性炎症反应和免疫调节的致炎因子,既可促进骨吸收,也可促进炎症的发生[21]。IL-1β、IL-6 为白细胞介素,为主要的促炎性细胞因子,主要分布在血清和龈沟液中,常作为监测牙周炎严重程度的观测指标[22]。研究指出,牙周炎发生时牙龈组织及龈沟液中TNF-α 和白细胞介素水平均显著上升,促进牙周炎的发展[23]。本研究发现,经用药治疗后大鼠牙龈组织上清液和龈沟液中TNF-α、IL-1β、IL-6 水平均显著低于模型组。可见,清胃散合玉女煎对降低炎症因子水平具有良好的效果,与李树生等[24]研究结果较为一致。
牙周炎患者龈沟液中天冬氨酸氯基转移酶、碱性磷酸酶、丙氨酸氨基转移酶之间存在一定的相关性,且与探针深度、附着丧失、牙龈指数呈正相关,当牙周组织发生病变时,上皮细胞或细菌细胞中释放出许多具有组织特异性的酶,其中包括ALT、AST、LDH、GGT 和ALP,其水平改变均有助于牙周病诊断。龈沟液中AST、ALP 和ALT 的水平能反映牙周炎的严重程度,可作为牙周炎检测指标[25,26]。治疗组经治疗后,AST、ALP、ALT 水平均显著低于模型组,说明清胃散合玉女煎对改善病情具有一定的积极作用。基质金属蛋白酶在牙周炎的发生发展中起着重要的作用,直接参与牙周组织的损伤过程,其广泛存在于牙周炎组织中,可作为检测牙周组织损伤程度的标志物[27]。研究指出,MMP 家族可有效降解细胞外基质,在牙周炎发生时气表达水平异常升高,降低MMPs 水平对改善病情具有重要作用[28]。本研究表明,治疗组经治疗后基质金属蛋白酶MMP-1、MMP-2、MMP-9 水平均显著低于模型组,由此可见,清胃散合玉女煎治疗可抑制病情发展,促进受损牙周组织的恢复。
综上所述,清胃散合玉女煎中药方剂可有效消除牙周炎大鼠龈沟液中致病菌,改善牙周指标,降低炎症因子、基质金属蛋白酶水平,促进牙周组织恢复,有望成为治疗牙周病的新方法。

