柠檬醛对中药材黄曲霉菌的抑制研究
夏诗琪,贾全全,王培玲,胡小红,朱灵芝,朱培林*,王宗德
(1. 江西省林业科学院,江西 南昌 330032;2. 江西农业大学 林学院/国家林草局木本香料(华东)工程技术研究中心/国家林草局江西省樟树工程技术研究中心,江西 南昌 330045)
【研究意义】我国是中药材种植大国,中药材从采收到使用往往储藏数月至数年,期间会因为空气湿度、温度等外界因素的影响,使中药材发生霉变[1]。黄曲霉菌是能引起药材霉变的优势菌种,中药材感染黄曲霉菌不仅导致中药材中有效成分的降低,影响中药材品质,而且存在食用安全隐患[2]。黄曲霉菌产生的代谢产物黄曲霉毒素B1具有强致癌性[3]。目前,研究人员更多关注的是感染黄曲霉毒素的花生、玉米、大米等粮食作物,并开展了黄曲霉菌的分离鉴定、产毒力研究和防控等方面的研究[4-6]。然而,近年来,中药材中黄曲霉毒素超标事件频发,中药材黄曲霉菌的分离分析和防治具有非常重要的研究意义。【前人研究进展】中药材储藏往往采用干燥法、低温冷藏法、硫磺熏蒸等简单传统的手段来控制霉变[7],该类方法缺乏长效性,还可能造成化学试剂残留,危害健康[8]。天然植物的某些次生代谢产物如植物精油具有广谱抑菌活性,可开发成防霉剂使用,已成为目前绿色防霉的研究热点[9-10]。【本研究切入点】山苍子是江西特色树种,资源丰富。大量研究表明山苍子精油中的主成分柠檬醛对植物病原菌[11]、食源性致病菌[12]、木腐真菌[13]有广谱高效的抑制作用。柠檬醛防治黄曲霉菌的研究较少,大部分仅仅以标准模式菌株作为研究对象,结果缺乏说服力[14]。【拟解决的关键问题】拟从霉变药材中分离鉴定黄曲霉菌,比较分析柠檬醛对源自中药材的黄曲霉菌的体外抑菌效果,并将分离得到的黄曲霉菌接种到药材中,研究柠檬醛的实际防霉效果,为天然柠檬醛防霉剂的开发和中药材黄曲霉菌的防控提供前期研究基础。
1 材料与方法
1.1 试验耗材与设备
马铃薯葡萄糖琼脂(PDA),青岛海博生物技术有限公司;十六烷基三甲基溴化铵(CTAB),氯仿,异戊烷,醋酸钾,异丙醇,乙醇,TE缓冲液均为分析纯,购于上海阿拉丁生化科技股份有限公司;酶mix混合剂,湖南擎科生物技术有限公司;ITS1引物5′TCCGTAGGTGAACCTGCGG3′和ITS4引物5′TCCTCCGCTTATTGATATGC3′,厦门宝诚生物科技有限公司;天然柠檬醛(>96%),江西麻山化工有限公司;黄曲霉菌CGMCC 3.4408,中国工业微生物菌种管理保藏中心。
恒温培养箱,上海三发科学仪器有限公司;显微镜,上海光学仪器六厂;离心机,上海卢湘仪离心机仪器有限公司;T100 PCR仪,美国伯乐公司。
1.2 试验方法
1.2.1黄曲霉菌分离纯化收集霉变中药材(泽泻、枳壳等),用无菌水将霉变药材上的疑似霉菌洗脱,用点样法将洗脱下来的水点到PDA培养基上,28 ℃培养1~2 d,将长出的单菌落接到新的培养皿中,若不纯则需多次反复纯化。
1.2.2形态学鉴定纯菌落培养出来后,挑取少量菌丝在显微镜下观察其微观形态。
1.2.3分子学鉴定(1)DNA提取。1)从培养皿上刮取适量菌丝,加入60 ℃预热的十六烷基三甲基溴化铵(CTAB)进行研磨。研磨后将研磨液转移到离心管中,60 ℃水浴保温30~60 min。2)加入适量氯仿/异戊醇(24﹕1)溶液,混合均匀,11 400 r/min离心15 min。3)收集上清液,加入等体积氯仿/异戊醇(24:1),混合均匀,11 400 r/min离心15 min。4)重复步骤3。5)收集上清液,加入10%总体积的5 mol/L醋酸钾溶液,加入2/3总体积的异丙醇,混匀静置,冷冻过夜。6)出现沉淀后,11 400 r/min离心5 min。7)弃去液相,加入400 μL 70%乙醇,震荡洗涤,11 400 r/min离心5 min。8)重复步骤7。9)弃去液相,DNA干燥后加入50~100 μL TE缓冲液,于37 ℃下溶解DNA后在-20 ℃保存备用。
(2)扩增。向提取的DNA中依次加入9.5 μL 双蒸水、12.5 μL酶mix混合剂,1 μL ITS1正向引物,1 μL ITS4反向引物,1 μL模板DNA,于PCR仪上扩增。ITS1(TCCGTAGGTGAACCTGCGG)和ITS4(TCCTCCGCTTATTGATATGC)为引物扩增ITS序列。扩增条件为95 ℃预变性5 min,95 ℃变性40 s,50 ℃退火40 s,72 ℃延伸1 min,35个循环,72 ℃后延伸10 min。扩增产物送北京博迈德生物有限公司测序。
1.2.4序列比对与系统发育树构建获得的序列用Bioedit v7.0.9软件打开并核对峰图和碱基序列。将自测序列通过NCBI进行比对,选择并下载可靠的序列建立矩阵(表1)。借助MEGA5.0软件进行序列比对并修整,截平首位后保存用于发育树的构建。系统发育树的建立采用最大似然法,借助于RaxML v7.2.6软件完成。

表1 用于系统发育分析的序列信息及GenBank登录号
1.2.5孢子悬浮液制备选取菌落转为黄绿色的黄曲霉菌培养皿,取5 mL无菌水(含1%吐温-80)于培养皿中,用接种环将孢子轻轻刮下,将含有孢子的无菌水转移到含有玻璃珠的离心管中,震荡1 min,过滤出去杂质和菌丝,收集滤液备用。用血球计数板和显微镜计算孢子数量。
1.2.6黄曲霉菌产毒力的测定取3个装有25 mL PDB培养基锥形瓶,分别加入BZ、ZX、ZK孢子悬浮液(孢子悬浮液终浓度为105CFU/mL),于26 ℃条件下振荡培养6 d。培养结束后,抽滤,菌球干燥后称量,滤液收集后送至人人实验(北京)科技有限公司检测黄曲霉毒素含量(方法:参照GB 5009.22—2016食品安全国家标准 食品中黄曲霉毒素B族和G族的测定方法)。
1.2.7体外抑菌实验配制不同浓度的柠檬醛,取1 mL柠檬醛和50 ℃ 24 mL PDA培养基充分混合后倒平板,使化合物的终浓度分别为90,180,360,720,1 440 mg/L。每个培养皿上均匀涂布100 μL 1×106CFU/mL的孢子悬浮液,以无菌水为对照,于26 ℃条件下培养40 h后计算孢子数量,建立毒力方程。具体方法是使用DPS 7.05软件将化合物浓度转化为对数,将抑制率转化为概率。结果表明,浓度与抑制率呈一元线性回归关系。通过分析显着的线性关系,可以比较化合物与病原菌毒力的强弱,并可计算出作为药物毒性重要指标的有效抑制浓度(EC50)。
1.2.8柠檬醛对实际药材样本感染黄曲霉菌的防控研究本试验基于“反式培养”模式(人为对未染菌药材接种)考察染菌枳壳、泽泻的霉变情况。制备黄曲霉菌ZX、ZK孢子悬浮液,药材以每一份10 g进行储藏研究,每一份中接种5 mL 1×106CFU/mL的孢子悬浮液(泽泻接种ZX,枳壳接种ZK),待菌液吸收完全后,采用不直接接触的方式,用小盒子装上柠檬醛放置在每份药材里,柠檬醛的含量分别为0,1,2,4,8,16 μL/g。在30 ℃,90%湿度下储藏一段时间。每天观察记录霉变情况。
2 结果与分析
2.1 形态学研究结果
从中药材上分离得到2株疑似黄曲霉菌的菌株,编号为ZK和ZX,其在PDA上的单菌落形态如图1所示,菌落质地为致密丝绒状,有时中央部分呈絮状;菌落基本呈圆形,平坦或现辐射状至不规则的沟纹;颜色最初呈白色,随后变黄色,然后变成黄绿色,老后颜色变暗。根据GB 4789.16—2016,从菌落形态上分析,该两株菌基本符合黄曲霉菌的国标描述。

图1 ZK和ZX在PDA上的菌落形态
菌株在显微镜下呈现的结构如图2所示,可以看出ZK和ZX的结构与黄曲霉菌3.4408基本类似,且和GB 4789.16—2016里关于黄曲霉菌的产孢结构和分生孢子的形态描述基本一致,即菌丝具分隔,分生孢子头呈球状,分生孢子小梗柱状;分生孢子梗壁厚,无色,粗糙;分生孢子多为球形或近球形、粗糙。

图2 显微镜下黄曲霉菌3.4408(BZ)和2株疑似菌(ZK和ZX)的形态
2.2 分子学研究结果
经测序,得到2条ITS序列,分别为ZK和ZX。通过将所得到的序列在GenBank中进行Blast搜索和比对,ZK的序列比对后结果为Aspergillus flavus,相似性为 98.59%~100%;ZX的序列比对后的结果为Aspergillus flavus,相似性为98.42%~99.82%。
比对后的ITS数据包括本研究测序得到的2条新序列及从GenBank中下载的19条序列,分属于曲霉属的 6个种,即:Aspergillus flavus(6条),Aspergillus pseudoglaucus(3条),Aspergillus proliferans(1条),Aspergillus ruber(3条),Aspergillus carneus(3条),Aspergillus destruens(2条)以及一条外群序列(Neocarpenteles acanthosporum,EF669992)。比对后并切除模糊区域后的序列,包括缺失位点,总长度为619 bp。经 RaxML v7.2.6软件分析后,得到的最大似然(ML)系统发育树如图3所示。系统发育树包括6种共19个代表菌株以及一个外群。本研究获得的序列均与Aspergillus flavus聚于同一分支,且支持率达到100%。

图3 ZK和ZX的系统发育树
2.3 黄曲霉菌产毒力的测定结果
黄曲霉菌纯培养6 d后的菌球干质量和黄曲霉毒素B1产量结果如表2所示,整体上看菌球的干质量和毒素含量成正比,黄曲霉菌的生长量越大,产毒越高。比较同一物种不同菌株之间存在明显的个体差异,黄曲霉菌标准模式菌株CGMCC 3.4408(BZ)与ZK之间的产毒量相差3个数量级。《中国药典2020》规定药材中黄曲霉毒素B1的限量标准为5 µg/kg,本试验中ZK产毒量3.01 µg/kg,产毒能力较弱,而ZX产毒量345 µg/kg,说明药材源的黄曲霉菌存在一定的产毒能力,不能忽视其危害,被污染的中药材存在饮食风险。

表2 黄曲霉菌生长量和产毒量结果
2.4 柠檬醛体外抑菌实验结果
通过孢子计数试验,研究了柠檬醛对ZK和ZX的体外抑制作用。高浓度下,柠檬醛能完全抑制黄曲霉菌BZ,且对ZK和ZX有强抑制作用,EC50分别为163.65 mg/L,719.42 mg/L和689.19 mg/L(表3)。柠檬醛对不同来源黄曲霉菌的抑制作用不同,柠檬醛可以作为一种有效的抑菌活性物质抑制中药材黄曲霉变。
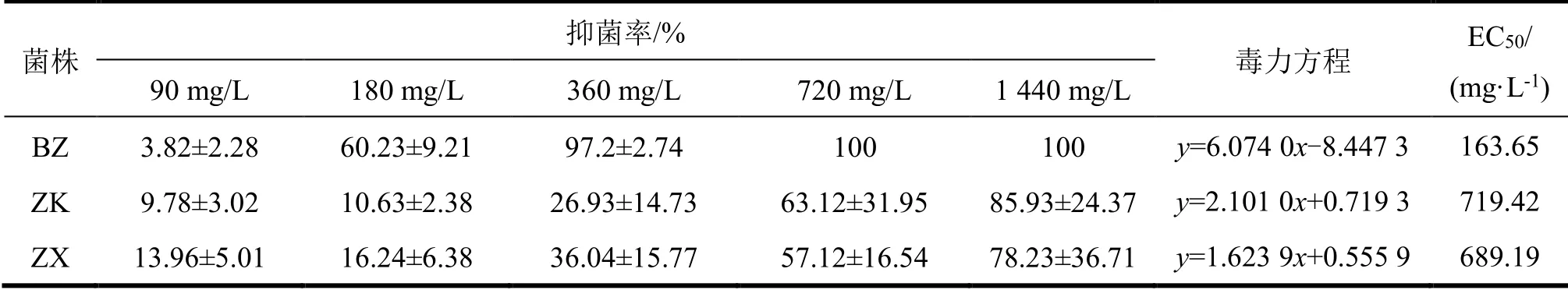
表3 柠檬醛对黄曲霉菌的抑制效果
2.5 柠檬醛对药材染菌防控结果
黄曲霉菌的适宜生长条件为25~30 ℃,相对湿度80%~90%,本实验以泽泻、枳壳为研究对象,分离得到的黄曲霉菌能成功感染泽泻和枳壳,如图4中的CK所示,药材表面长出黄绿色菌丝。从总体上看,随着柠檬醛浓度的增大,药材表面霉变程度减弱,柠檬醛浓度为4 μL/g时能完全抑制泽泻霉变,柠檬醛浓度为8 μL/g时能完全抑制枳壳霉变,表明柠檬醛对中药材由黄曲霉菌感染引起的霉变由较好的防控作用。

图4 柠檬醛对药材感染黄曲霉菌的抑制结果
3 结论与讨论
微生物的分类鉴定方法主要包括传统的形态学方法和现代的分子生物学方法,依据形态特征进行分类的方法是微生物分类鉴定的主要手段。然而仅凭裸眼观察很难区分形态相近的种,近年来随着科学的进步发展,分子生物学方法的优势越来越明显。朱丽萍等[15]用ISSR分子生物学分类法鉴定了25株红曲菌株,该方法为红曲菌株的分类鉴定提供综合参考信息。本研究同样以形态学观察为基础,以分子学手段为辅助,有效鉴定目标菌,提高了研究的可信度和科学性。
对黄曲霉菌的防控研究大多采用标准模式菌株为对象,可能是基于可靠性和可比较性的角度去考虑。然而仅以标准模式菌株作为研究对象缺乏科学性,研究抑菌活性物质对中药材霉变的控制效果,不仅仅要研究其对黄曲霉菌标准菌株的抑制作用,对能感染中药材的黄曲霉菌的抑制研究很有必要。此外,本研究设计了实际中药材样本感染黄曲霉菌的实验,相比于体外抑菌实验,模拟中药材染菌更能说明柠檬醛抑菌的可靠性,以及应用于霉变防控的可行性。
本研究结果还能说明来源于不同中药材品种的黄曲霉菌的产毒能力存在差异,因此在今后中药材储藏中,可以依据菌株间产毒差异性从而筛选出不产毒菌株,深入探索抑制黄曲霉生长及黄曲霉毒素产生的机制,为中药材储藏中黄曲霉菌的防控提供理论指导。
此外,经查阅文献,抑菌圈是抑菌研究的常用方法。但是,抑菌圈只能定性说明某活性物质对目标菌有抑制能力,抑制能力的强弱无法定量分析。本实验对黄曲霉菌的抑菌研究方法是孢子计数法,这是一种定量方法。通过比较EC50能客观的判断柠檬醛对标准菌株和中药材源菌株的抑制效果。
本研究以实际中药材样本探索了柠檬醛对中药材黄曲霉菌感染的防控作用,下一步,要深入研究黄曲霉菌的抑制机制,为黄曲霉菌的抑制和天然柠檬醛防霉剂的开发提供更可靠的数据支撑。

