青海省BYDV株系鉴定及BYDV-GAV燕麦分离物基因组序列的测定与分析
乔世英,季英华,魏有海,闫佳会,郭青云
(1.青海大学农林科学院/青海省农业有害生物综合治理重点试验室/农业农村部西宁作物有害生物科学观测试验站,青海西宁 810016; 2.江苏省农业科学院植物保护研究所/江苏省食品质量安全重点试验室-省部共建国家重点试验室培养基地,江苏南京 210014)
大麦黄矮病毒(barley yellow dwarf virus,BYDV)引起的小麦黄矮病是一种全球范围内的麦类作物病害,该病害最早在美国的加利福尼亚州被发现并报道[1],此后陆续在土耳其[2]、法国[3]、巴西[4]、巴基斯坦[5]等地流行并报道。我国小麦黄矮病最早发生于20世纪六七十年代,在主要的粮食作物种植区均有大面积流行,对我国粮食生产造成严重损失。近几年,小麦黄矮病在全国范围内的流行发生趋势减弱,但在青海省的小麦产区仍有较大面积的发生[6-7]。
BYDV为黄症病毒科(Luteovidae)单链RNA病毒,基因组全长约 5.7 kb,蚜虫是其主要的传毒介体[8-9]。该病毒侵染小麦后,植株变矮,叶片由叶尖至叶柄处逐渐变黄,在小麦抽穗期会产生不抽穗或穗发育不良的症状[10-12];燕麦被侵染后会出现红叶病,在染病后期被侵染叶片褪绿变红,相对于健康叶片有明显的增厚,危害严重时,叶片后期褪绿变为紫色[13-14]。BYDV株系的划分主要依据其蚜虫的传播专化性,在国际分类上,BYDV株系可划分BYDV-RPV、BYDV-RMV、BYDV-SGV、BYDV-PAV和BYDV-MAV 5个株系;国内学者将BYDV株系划分为BYDV-GAV、BYDV-GPV、BYDV-PAV和BYDV-RMV 4个株系,其中,BYDV-RPV株系由禾谷缢管蚜(Rpopalosiphumpadi)传播,BYDV-RMV株系由玉米蚜(R.maidis)传播,BYDV-SGV株系由麦二叉蚜(Schizaphisguaminum)传播,BYDV-PAV株系由禾谷缢管蚜和麦长管蚜(Sitobionavenae)传播,BYDV-MAV株系由麦长管蚜传播,BYDV-GAV株系由麦二叉蚜和麦长管蚜传播,BYDV-GPV株系由麦二叉蚜和禾谷缢管蚜传播[15-16],其中BYDV-GAV为我国流行株系,BYDV-GPV为我国特有株系[17]。
小麦、青稞、燕麦[18]是青海省的主要麦类种植作物,近年来黄矮病不断发生,对我省作物生产造成严重损失。翟 浩等[12]对青海省西宁市、互助县、乐都县及贵德县小麦田间疑似黄矮病样品进行相关研究,发现BYDV-GAV为青海省小麦黄矮病的主要流行株系。李廷芳等[19]研究发现,青海省青稞分离物与BYDV-GAV渭南小麦分离物亲缘关系较近,是中国BYDV-GAV的一个分离物。但目前有关整个青海省主要粮食作物种植区BYDV流行株系尚未见报道,且青海省燕麦BYDV-GAV株系全基因组也未见相关报道。因此,本研究以采集到的90份全省粮食作物种植区田间疑似黄矮病样品为试验对象,采样地点覆盖到各州县,避免局部地区采样的弊端,对所有采集样品进行RT-PCR检测,明确青海省BYDV的流行株系,并通过分子克隆技术获得燕麦BYDV-GAV全基因组序列,全面阐述了青海省小麦黄矮病的发生情况、流行株系分布等,以期为后期小麦黄矮病抗病品种的选育及病害防治工作奠定基础。
1 材料与方法
1.1 试验材料
于2019年7月至9月在青海省各州县采集田间小麦(53份)、青稞(12份)、燕麦(25份)黄矮病疑似样品共90份,分别采自西宁市(13份)、海东市(25份)、海西州(23份)、海南州(21份)、黄南州(4份)和玉树州(4份)。样品采集后立即冻存于液氮罐中,带回试验室存于-80 ℃冰箱。
1.2 引物的设计与合成
利用NCBI网站与软件Primer Primer 5设计本试验所需的检测引物与全基因组扩增引物,引物序列信息见表1。

表1 本研究用到的引物信息
1.3 试验方法
1.3.1 RNA的提取
取待测样品50~100 mg,采用Trizol法提取总RNA,提取的RNA用25 μL的RNase Free ddH2O进行溶解并保存于 -80 ℃冰箱中。
1.3.2 RT-PCR检测
采用PrimeScriptTMRT Master Mix反转录试剂盒(宝生物工程有限公司)进行RNA反转录,反应体系为20 μL,包括RNA 1 μL,PrimeScriptTMRT Master Mix 4 μL,RNase Free ddH2O补足到20 μL,反应程序:37 ℃ 15 min, 85 ℃ 5 s,反应终止后将样品迅速置于冰上,并保存于-20 ℃冰箱中。以合成的cDNA为模板进行PCR检测,反应体系为20 μL,包括cDNA 1 μL,2×Taq Master Mix(南京诺唯赞生物科技有限公司) 10 μL,上、下游引物(10 μmol·L-1)各 1 μL,RNase Free ddH2O补足至20 μL。PCR反应程序:94 ℃ 5 min;94 ℃ 45 s,退火45 s(各引物退火温度见表1),72 ℃ 3.5 min,35个循环; 72 ℃ 10 min,反应结束后4 ℃保存。取5 μL反应产物进行1%琼脂糖凝胶电泳检测。
1.3.3 燕麦BYDV-GAV全基因组序列的克隆
反转录过程采用反转录试剂盒(大连宝日医生物技术有限公司)进行一系列试验操作。PCR反应体系为25 μL,包括cDNA 1 μL,2×Phata Max Buffer(南京诺唯赞生物科技有限公司)12.5 μL,Phata Max Super-Fidelity DNA Polymerase 0.5 μL,dNTP Mix(10 mmol·L-1)0.5 μL,上、下游引物(10 μmol·L-1)各1 μL,ddH2O补足至25 μL。PCR反应程序:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 3.5 min,共35个循环; 72 ℃补充延伸10 min,反应结束后4 ℃保存。取 3 μL PCR产物与5×Loading buffer混合后进行1%琼脂糖凝胶电泳检测。选取较亮的目的条带,利用Axygen公司的琼脂糖凝胶回收试剂盒进行目的片段回收,回收产物连接至pEASY-Blunt Zero克隆载体(北京全式金生物技术有限公司),热击法转入大肠杆菌Trans-T1感受态细胞(北京全式金生物技术有限公司)中,选取阳性克隆 送测。
1.3.4 序列分析
利用DNAStar软件进行序列比对及拼接等,所得基因组序列通过NCBI网站(http://www.ncbi.n/m.nih.gov/BLAST/Blast.cgi)进行BLAST比对,利用MEGA 6.0软件构建系统进化树。
2 结果与分析
2.1 田间植株症状
田间植株感染BYDVS后症状主要表现为植株明显变矮、叶黄化等症状。小麦上的症状一般为植株叶片从叶尖开始变黄,叶片显现黄绿相间条纹,植株变矮,丛枝等;燕麦感染BYDV后表现为燕麦红叶病,植株叶片明显变红增厚,危害严重时叶尖完全褪绿枯死,下部叶片呈紫红色;青稞受BYDV侵染后,主要表现为叶片出现黄绿相间的条纹,植株明显变矮(图1)。

图1 青海省小麦、燕麦和青稞田间病害症状
2.2 RT-PCR检测结果
利用引物GAV-F/R、PAVL1/R1、MAVL1/R1、SGVL2/R2、RMVL1/R1、RPVL/R对所有黄矮病疑似样品进行RT-PCR检测,结果(图2)发现,部分样品利用引物GAV-F/R、RPVL/R、MAVL1/R1、SGVL2/R2和PAVL1/R1扩增可分别得到约600、400、200、250和250 bp的目的条带。PCR检测结果显示,部分样品存在病毒株系复合侵染的现象,除能检测到BYDV-GAV株系外,还能检测到其他株系。如在小麦样品中,19QGW2、19QJW2、19QJW3同时检测到BYDV-GAV和BYDV-MAV株系,19QJW4同时检测到BYDV-GAV和BYDV-RPV株系,19QHW2、19QXW1、19QAW3同时检测到BYDV-MAV、BYDV-GAV和BYDV-RPV株系,19QRW4同时检测到BYDV-GAV、BYDV-RPV和BYDV-PAV株系;在燕麦样品中,19QGO2同时检测到BYDV-MAV、BYDV-GAV和BYDV-RPV株系,19QLO1、19QPO1、19QBO1、19QDO2同时检测到与BYDV-MAV和BYDV-GAV株系,19QDO1同时检测到BYDV-GAV和BYDV-SGV株系;在青稞样品中,19QNB1、19QPB1同时能检测到BYDV-MAV和BYDV-GAV株系。

A:引物GAV-F/R的部分样品扩增结果;B:引物RPVL/R的部分样品扩增结果;C:引物MAVL1/R1的部分样品扩增结果;D:引物SGVL2/R2的部分样品扩增结果;E:引物PAVL1/R1的部分样品扩增结果。Maker:DL5000;其他泳道为供试材料在采集样品中的代号,其中19代表采集年份2019,第一个字母Q代表青海省,第二个字母代表采样地点(G表示贵德县,D表示都兰县,N表示贵南县,P表示共和县,L表示乐都县,J表示尖扎县,H表示化隆县,X表示循化县,A表示平安县,M表示民和县,R表示湟中县,B表示德令哈市,Z表示互助县,T表示大通县),第三个字母代表寄主(W为小麦,O为燕麦,B为青稞),CK1~CK3分别代表健康小麦、燕麦、青稞 植株。
2.3 不同寄主、地区BYDV株系的分布情况
检测结果(表2)显示,BYDV-GAV为青海省主要流行株系,检出率为90.0%,其他株系检出率表现为BYDV-MAV(51.1%)>BYDV-RPV(7.8%)>BYDV-PAV(6.7%)=SGV (6.7%)。采集样品感染BYDV的植株中,小麦占主要部分,其他依次为燕麦、青稞。从株系看,BYDV-GAV株系在小麦和燕麦样品中检出率较高,分别为 92.5%和92.0%,BYDV-PAV株系在青稞中检出率最高,为16.7%;BYDV-MAV株系在小麦中检出率较高,为58.5%;BYDV-RPV株系在小麦中检出率最高,为9.4%;BYDV-SGV株系在小麦中检出率最高,为9.4%,但其在青稞样品中未被检测到。方差分析结果显示,不同寄主不同株系间无显著差异。少量样品中也检测到BYDV-GPV株系的侵染,后期对该株系进行了进一步的克隆与验证(待发表)。
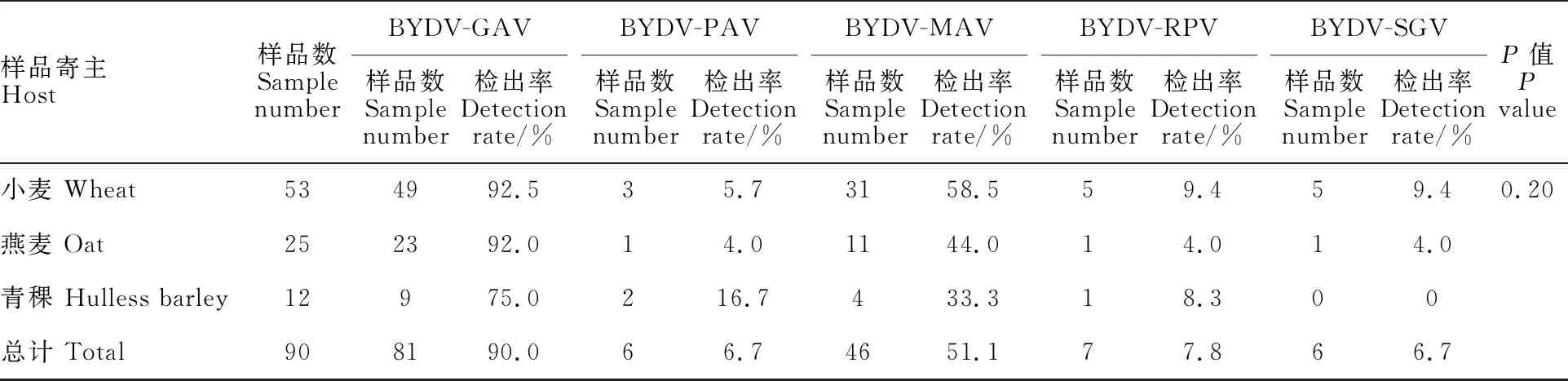
表2 不同寄主感染BYDV的检测结果
从表3可以看出,BYDV-GAV株系在西宁市、海东市、黄南州样品中检出率较高,均超过90%,其他依次为玉树州、海西州、海南州,均超过60%;BYDV-PAV株系在西宁市、海东市、黄南州、玉树州样品中均检测到,但所占比例较小,在海南州和海西州未检测到BYDV-PAV株系;BYV-MAV株系在西宁市、海东市、海南州、黄南州样品中检出率都为50%左右,但海西州检出率较低,为26.1%,玉树州样品中未检测到该株系;BYDV-RPV株系只在西宁市、海东市、黄南州样品中检测到,且所占比例较小,在海南州、海西州、玉树州样品中未检测到该株系;BYDV-SGV株系在西宁市、海东市、海南州、海西州均检测到,但该株系所检测到的样品数极少,且在黄南州和玉树州样品中未检测到该株系。经方差分析,不同地区不同株系间无显著差异。
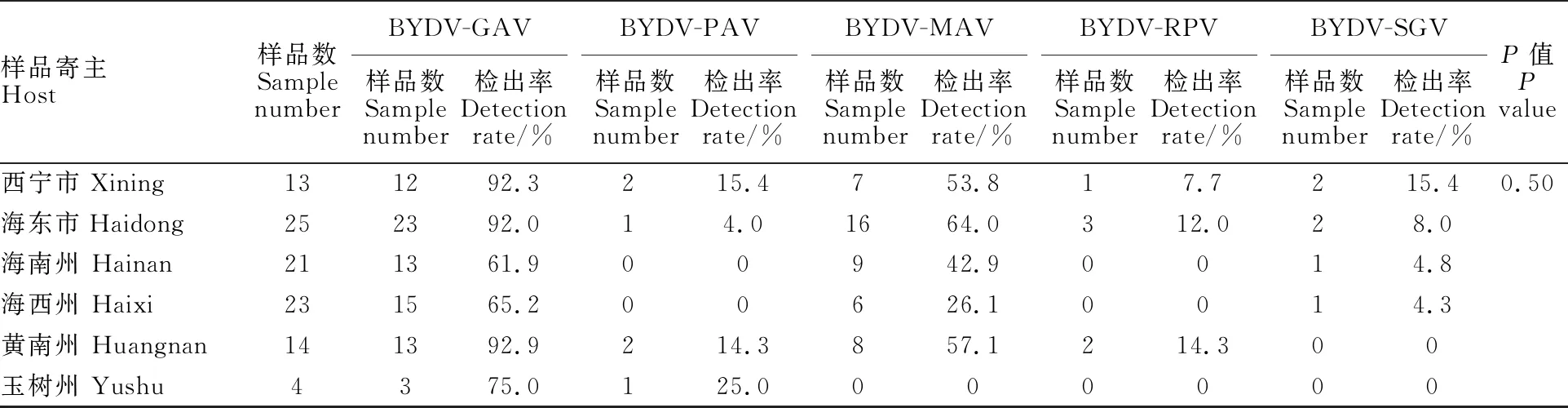
表3 青海省各市(州)小麦黄矮病株系的分布
2.4 青海省BYDV-GAV燕麦分离物的分子鉴定结果及全基因序列分析
2.4.1 BYDV-GAV燕麦分离物分子鉴定结果
利用设计的BYDV-GAV 特异性引物 GAV-F/R对采集到的25份燕麦样品进行RT-PCR检测,结果(图3)发现,部分燕麦样品扩增到大小约600 bp的条带,与目的条带(600 bp)大小一致。
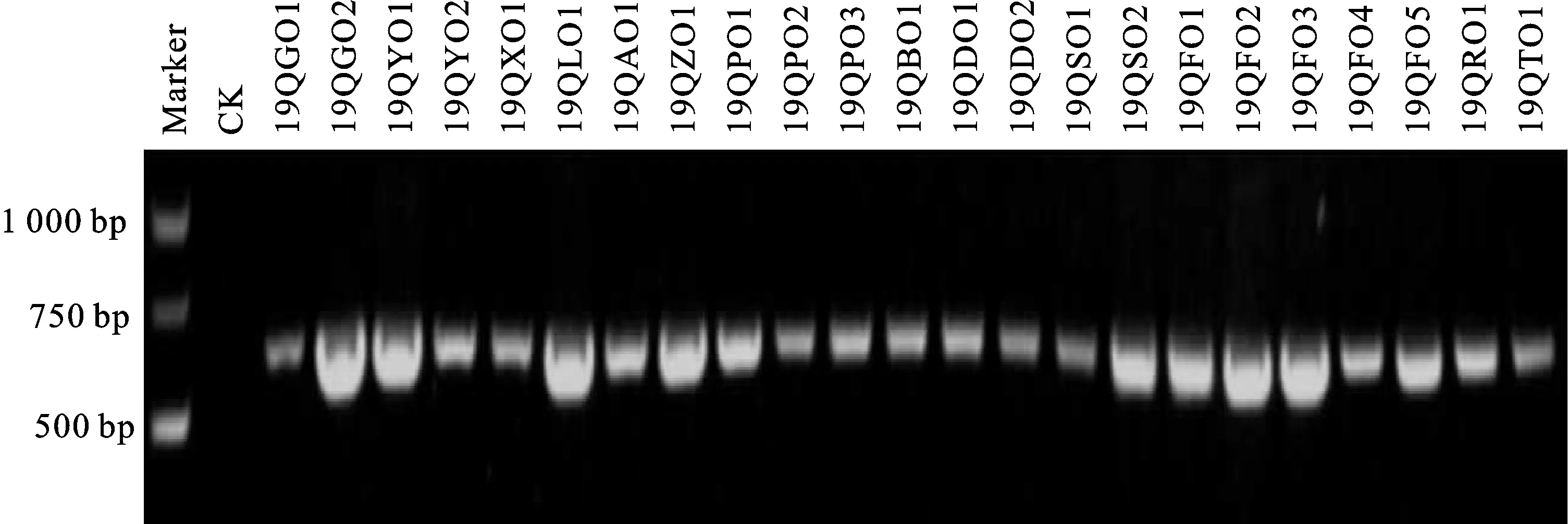
Maker:DL 5000 marker;CK:健康燕麦植株;19QGO1~19QTO1:燕麦样品,字母代表含义详见图2。
2.4.2 BYDV-GAV燕麦分离物全基因组克隆及序列分析
为进一步确定病毒株系,选取其中一个燕麦样品(19QPO3)进行BYDV-GAV的全基因组克隆。根据BYDV-GAV(EU402390)基因组序列特征,分段设计引物BYD-1sbF/BYD-1R和BYD-2bsF/BYD-2xmR克隆青海省BYDV-GAV燕麦分离物全基因组序列(图4)。以典型样品19QPO3总RNA为模板,利用RT-PCR技术进行扩增,得到2.8 kb左右的目的条带(图5)。
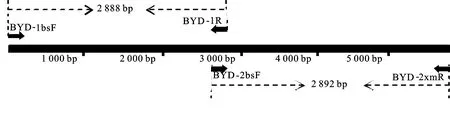
图4 BYDV-GAV分段扩增策略
图5 用引物BYDV-1bsF/1R和BYDV-2bsF/2xmR扩增出的条带
应用DNAStar软件对测序结果进行比对与序列拼接,发现19QPO3的基因组全长为5 685 bp,包括6个开放阅读框和4个非编码区。对19QPO3进行BLAST分析可知,其与中国的BYDV-GAV序列同源性较高(96.85%~ 98.08%)(表4)。系统进化分析(图6)可以看出,19QPO3聚类到中国BYDV-GAV小麦分离物的分支上。综合上述结果可得,本试验所得燕麦分离物为中国BYDV-GAV的一个分离物。
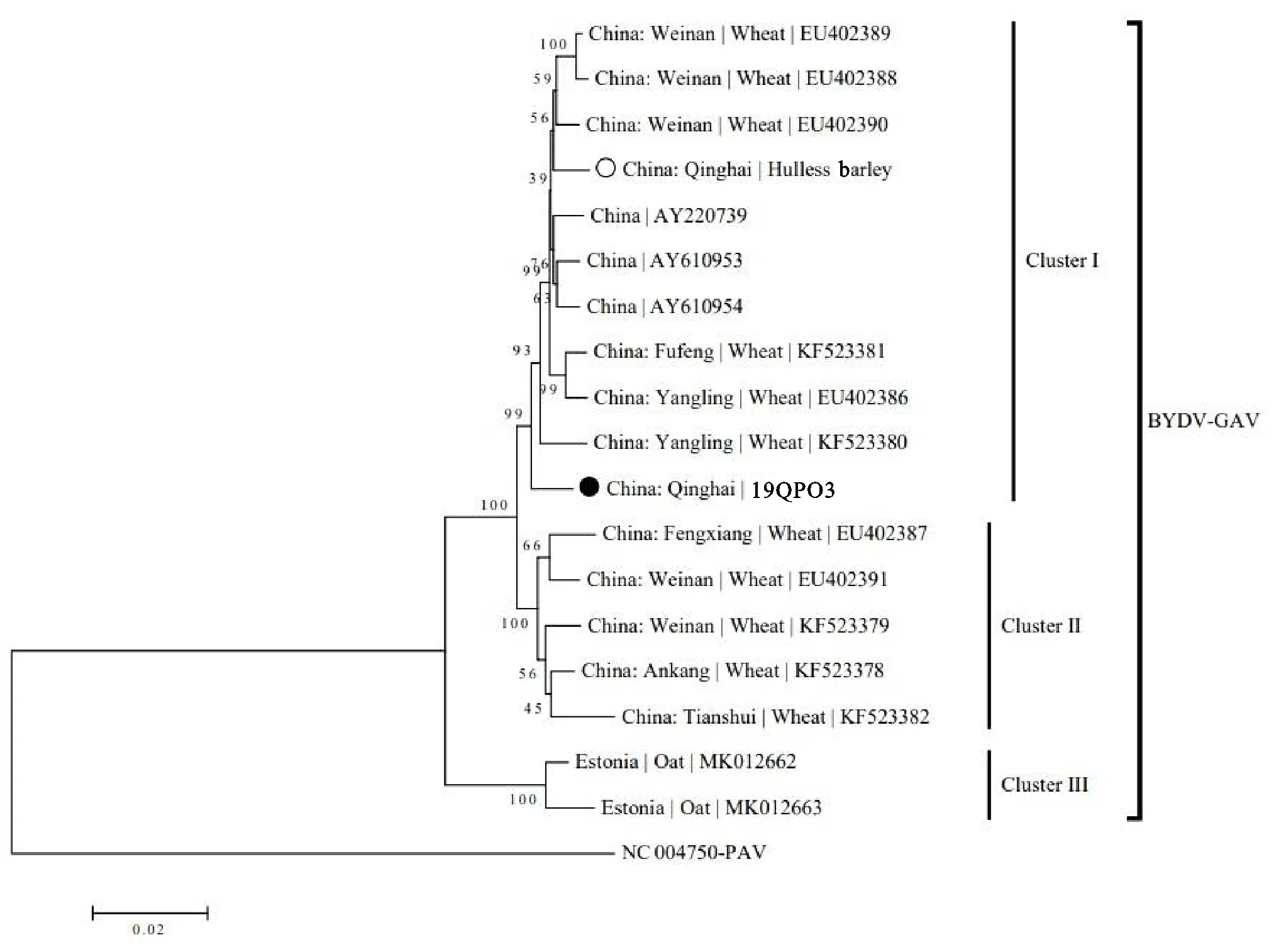
各枝上的数字是1 000次Bootstrap自导复制的置信度。●:本试验测定的青海省燕麦分离物;○:之前报道的青海省青稞分离物。
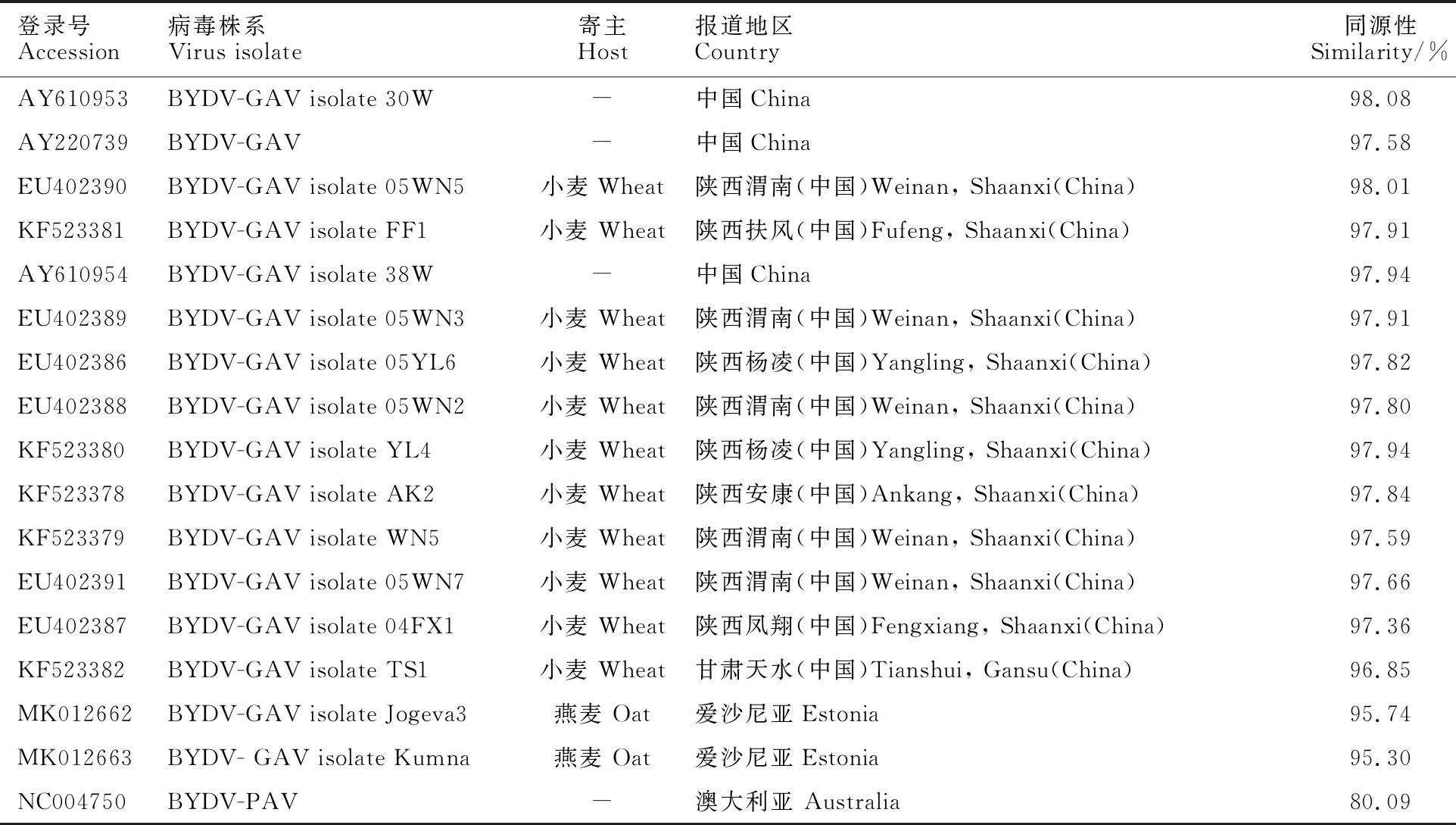
表4 聚类分析中所涉及的序列信息
在系统进化关系上,BYDV-GAV分为三个组,中国的BYDV-GAV分离物聚类到两个组内,其中陕西渭南的三个分离物(登录号:EU402389、EU402388和EU402390)、杨凌的两个分离物(登录号:EU402386和KF523380)、陕西扶风的一个分离物(登录号:KF523381)与中国的其他三个分离物(登录号:AY220739、AY610953和AY610954)共同聚类到一个组上(Cluster I)。陕西凤翔的一个分离物(登录号:EU402387)、渭南的两个分离物(登录号:EU402391和KF523379)、安康的一个分离物(登录号:KF523378)和甘肃天水的一个分离物(登录号:KF523382)共同聚类到一个组上(Cluster II)。爱沙尼亚的两个分离物(登录号:MK012662和MK012663)聚类到一个组上(Cluster III)。其中,本试验所得燕麦分离物19QPO3聚类到第一组内,与陕西杨凌的两个分离物亲缘关系较近,同源性较高,分别为97.82%和97.94%,与之前在青海省所得的青稞分离物聚类到不同小支上[19],同源性相对较远。
3 讨 论
小麦在世界粮食作物中占据重要地位,在我国的麦类粮食作物中亦占据着重要地位[20]。近年来,有学者发现,造成小麦病毒病害的病原主要有大麦黄矮病毒(BYDV),小麦矮缩病毒(WDV)、小麦条纹花叶病毒(WSMV)等[21-22]。晋治波[23]通过试验得到中国BYDV-GAV基因组全序列,并进行相关序列分析,结果表明,该病毒株系包含6个开放阅读框,编码4个主要蛋白。
青海省地处青藏高原,地理位置较为特殊,主要种植小麦、燕麦和青稞,本试验采集了青海省6个州市的田间小麦黄矮病疑似病样进行RT-PCR检测。病样的采集结果因青海省种植区域分布的不同存在一定的差异。检测结果表明,青海省小麦黄矮病株系的分布不管是从寄主区分还是从地理环境区分,其主要流行株系均为BYDV-GAV株系,与刘 楠等[24]、翟 浩等[12]的检测鉴定结果相一致。试验结果也显示,所采集样品除存在BYDV-GAV株系与其他株系复合侵染的现象外,也存在少量的BYDV-PAV、BYDV-SGV株系的复合侵染现象,对于这一结果的产生还需进行进一步的验证。此次试验病样的采样地点分布于整个青海省,部分采样点间海拔跨度较大,地理环境相差较大,植株所处生长期不同,发病时期不一致,这些因素对于检测结果都存在一定的影响。
通过本试验所得的燕麦分离物19QPO3与已报道的BYDV-GAV分离物构建系统进化树,并进行聚类分析,结果表明,19QPO3与已报道的中国BYDV-GAV分离物聚类到一个分支上,说明19QPO3为中国BYDV-GAV的一个分离物,且与陕西杨凌小麦分离物(登录号:KF523380)亲缘关系相对较近。系统进化树分析可见,本试验所得的BYDV-GAV燕麦分离物19QPO3与之前得到的青海青稞分离物14Qh8-1[19]虽共同聚类到一个组内,但分布在不同支上,且亲缘关系较远,产生此结果的原因可能是寄主基因突变、地理环境等因素的影响,但还需进一步试验验证。
近年来,青海省小麦黄矮病的发生呈现日渐严重的趋势,因此对于该病害的研究具有一定的科学意义。研究并确定青海省小麦黄矮病的主要流行株系,可更好地了解小麦黄矮病在青海省内的发生流行趋势,为该病害的防治提供一定的理论参考。本试验获得的青海省BYDV-GAV燕麦分离物的基因组全长序列为后期试验的进行提供部分参考依据,也为进一步探究该病害在青海省内的发生流行趋势及该病害的进化变异规律提供一定的理论基础。

