小麦 TaCSL1基因的克隆及表达模式分析
陈 恒,刘迎春,刘育秀,田仁美,周新颖,于利伟,谢彦周,高 欣
(西北农林科技大学农学院,陕西杨凌 712100)
在植物体内,羟基化氨基酸可用来治疗抑郁症、糖尿病、癌症等疾病[1-5]。目前主要有三种途径获取:从含有羟基化氨基酸的物种中提取、化学合成和生物催化法。其中,提取和化学合成过程繁琐、效率低下[6]。与之相比,生物催化法不仅高效快速,而且具有高对映选择性,因此,发掘和利用高效稳定的羟基化酶尤为重要[4]。
Clavaminate Synthase-Like(CSL)家族是一类非血红素铁和α-酮戊二酸依赖的氧化还原酶家族,可催化氨基酸羟基化[7]。该家族的VioC、MppO和AsoN酶在抗生素紫霉素、甘露霉素、达托霉素的合成中,可催化L-精氨酸、L-天冬酰胺的羟基化[8-10]。CSL家族酶类在辅因子Fe2+、α-酮戊二酸和O2的共同作用下,经过复杂的特异位点配位键结合、代换和释放过程,可将氨基酸底物羟基化并释放出CO2和琥铂酸[7]。Bastard等[7]研究发现,CSL酶具有高度的区域和立体结构选择性,以及严格的底物特异性。
CSL家族相关基因的研究大多局限于微生物中,在模式植物拟南芥中也仅有初步研究。Bitto等[11]通过研究拟南芥At3g21360基因编码蛋白的晶体结构,证实该蛋白属于CSL家族,这是植物中首个被研究报道的CSL基因。异源六倍体小麦由于基因组庞大、基因拷贝数多等问题,基因克隆和功能解析研究工作在很长一段时间内受到制约[12-13]。近几年来,基因组测序技术的快速发展、小麦全基因组参考序列的发布以及基因组重测序项目的推进,促进了小麦重要功能基因的克隆和重要性状的分子机制研究等工作[14]。羟基化氨基酸早已被人们认识和使用,但是小麦CSL基因的发掘以及该基因表达特性和生物学功能的研究还未见报道。因此,本研究以中国春为材料,以拟南芥基因At3g21360(GenBank Accession:NC_003074.8)序列为探针,比对小麦全基因组数据库,对TaCSL1基因进行同源克隆,利用生物信息学分析该基因及其编码蛋白序列,采用实时定量PCR技术分析该基因的时空表达模式,以期明确该基因的基本结构和表达特征,为进一步研究其生物学功能提供科学依据。
1 材料与方法
1.1 试验材料
本研究所用小麦材料为中国春,于2018-2019年种植于西北农林科技大学农学院作物标本区试验地(108°4′E,34°16′N),株距5 cm,行距25 cm,行长1 m,正常肥水管理。在小麦幼苗期取叶片,用于提取DNA。在小麦苗期、拔节期、孕穗期、抽穗期以及开花后9 d和25 d,分别取小麦根、叶片、节间、旗叶鞘、穗下茎、幼穗、颖壳、雌蕊、雄蕊、籽粒等组织样品,液氮速冻后,保存于 -80 ℃冰箱,用于提取RNA。
1.2 DNA、RNA的提取和cDNA第一链的合成
采用CTAB法[15]提取小麦叶片全基因组DNA,并用核酸蛋白分析仪(Nano Drop 2000)检测DNA浓度,根据所测浓度稀释至100 ng·μL-1作为工作液,-20 ℃保存。使用RNA提取试剂盒Tissue RNA Isolation Kit(诺唯赞,南京)提取小麦不同生长发育阶段和不同组织部位的总RNA,-80 ℃保存。使用反转录酶试剂盒Hiscrip@Q Select RT SuperMix for qPCR(+gDNA wiper)(诺唯赞,南京)合成cDNA第一链,-20 ℃保存。
1.3 TaCSL1基因全长与基因编码区的克隆
以拟南芥At3g21360基因的cDNA序列为探针搜索Ensembl Plants小麦基因组数据库(http://plants.ensembl.org/Triticum_aestivum/Tools/Blast?db=core),得到位于小麦A、B、D三个亚基因组上的三个部分同源基因:TraesCS3A02G108700、TraesCS3B02G127700和TraesCS3D02G110500。这三个基因长度分别为2 310、2 437和2 472 bp,均包含一个长度为 1 005 bp的编码区。比对这三个同源基因的序列,使用Primer Premier 5在这三条序列的两端差异部分分别设计用于克隆基因全长和基因编码区的引物(表1)。引物由生工生物工程(上海)股份有限公司合成。
使用La Taq DNA聚合酶试剂盒(TaKaRa,日本)扩增基因全长和和基因编码区。PCR扩增体系为50 μL,包含100 ng·μL-1的模板1 μL(扩增基因全长模板为全基因组DNA,扩增基因编码区模板为cDNA),10×Buffer 5 μL,200 μmol·L-1的dNTPs 8 μL,5 U·μL-1的La Taq DNA聚合酶1 μL,10 μmol·L-1的上、下游引物各1 μL,ddH2O补齐至50 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,扩增基因全长72 ℃延伸3 min、扩增基因编码区72 ℃延伸1 min,共35个循环;72 ℃再延伸5 min。
使用1%琼脂糖凝胶电泳分离PCR扩增产物,使用DNA凝胶回收试剂盒(TaKaRa,日本)纯化目的基因。将目的基因连接到pMD18-T载体(TaKaRa,日本)上,然后转化大肠杆菌DH5α感受态细胞(诺唯赞,南京)。过夜培养后挑取单菌落,使用2×Taq Master Mix DNA聚合酶(诺唯赞,南京)对阳性单克隆进行PCR鉴定,由生工生物工程(上海)股份有限公司进行测序,每个基因测序三个阳性单克隆。使用DNAstar Megalign 5.01进行基因编码区序列比对。
1.4 TaCSL1基因编码蛋白的生物信息学分析
以TaCSL1-3A蛋白序列为探针,在NCBI(https://www.ncbi.nlm.nih.gov/)搜索不同物种的同源蛋白,使用DNAstar Megalign 5.01进行TaCSL1-3A、TaCSL1-3B、TaCSL1-3D和拟南芥At3g21360(XP_002883301.1)蛋白序列的多重比对。使用MEGA 7.0构建基于neighbor-joining的系统发育树。运用在线工具ExPASy-ProtParam(https://web.expasy.org/protparam/)和InterPro Scan(http://www.ebi.ac.uk/interpro/search/sequence/)分别预测TaCSL1基因编码蛋白的理化性质和保守结构域。
1.5 TaCSL1基因的表达特性分析
使用Primer Premier 5在TaCSL1-3A、TaCSL1-3B和TaCSL1-3D基因编码区内设计特异性引物(表1)。引物由生工生物工程(上海)股份有限公司合成。使用2×RealStar Green Power Mixture试剂盒(GenStar BioSolution,北京)和StepOnePlus实时荧光定量PCR系统(ABI,美国)进行三个部分同源基因的表达量分析。qRT-PCR扩增体系为20 μL,包含20 ng·μL-1的cDNA模板1 μL,10 μmol·L-1的上、下游引物各0.5 μL,2×RealStar Green Power Mixture 10 μL,ROX Reference Dye 0.4 μL,ddH2O补齐至20 μL。PCR反应程序:95 ℃预变性10 min; 95 ℃变性15 s,60 ℃退火/延伸1 min,共40个循环。每个样品设置3个生物学重复。目的基因相对表达量的计算采用2-△△Ct法[16],用Excel 2010分析数据并作图。

表1 本研究所用的引物
2 结果与分析
2.1 TaCSL1基因的克隆与序列分析结果
以中国春全基因组DNA为模板,用三对引物TaCSL1-3A-gF/R、TaCSL1-3B-gF/R和TaCSL1-3D-gF/R分别进行PCR扩增,得到全基因组目的产物(图1A);以中国春总cDNA第一链为模板,用三对引物TaCSL1-3A-cF/R、TaCSL1-3B-cF/R和TaCSL1-3D-cF/R分别进行PCR扩增,得到编码区单一产物(图1B)。命名该基因为TaCSL1,来自A、B、D三个亚基因组的部分同源基因分别命名为TaCSL1-3A、TaCSL1-3B和TaCSL1-3D。经测序与序列比对,发现TaCSL1-3A、TaCSL1-3B、TaCSL1-3D与TraesCS3A02G108700、TraesCS3B02G127700、TraesCS3D02G110500的编码区序列一致。三个部分同源基因均包含3个外显子和2个内含子,3个外显子长度分别为392 bp、250 bp和363 bp,但内含子长度不同。TaCSL1-3A基因的2个内含子长度分别为338 bp和683 bp;TaCSL1-3B基因的2个内含子长度分别为252 bp和788 bp;TaCSL1-3D基因的2个内含子长度分别为314 bp和812 bp。编码区序列比对结果表明,三个部分同源基因之间存在43个单核苷酸突变位点,其中有义突变11个,沉默突变32个(图2)。TaCSL1-3A和TaCSL1-3B基因的核酸序列相似性为95.7%,TaCSL1-3A和TaCSL1-3D基因的核酸序列相似性为96.3%,TaCSL1-3B和TaCSL1-3D基因的核酸序列相似性为96.4%。TaCSL1-3A和TaCSL1-3B蛋白序列相似性为97.3%,TaCSL1-3A和TaCSL1-3D蛋白序列相似性为97.6%,TaCSL1-3B和TaCSL1-3D蛋白序列相似性为97.9%,说明该基因在小麦进化过程中十分保守。

A:基因全长电泳图;B:基因编码区电泳图;M1:Maker DL5000;M2:Maker DL2000。箭头所指为目的条带。
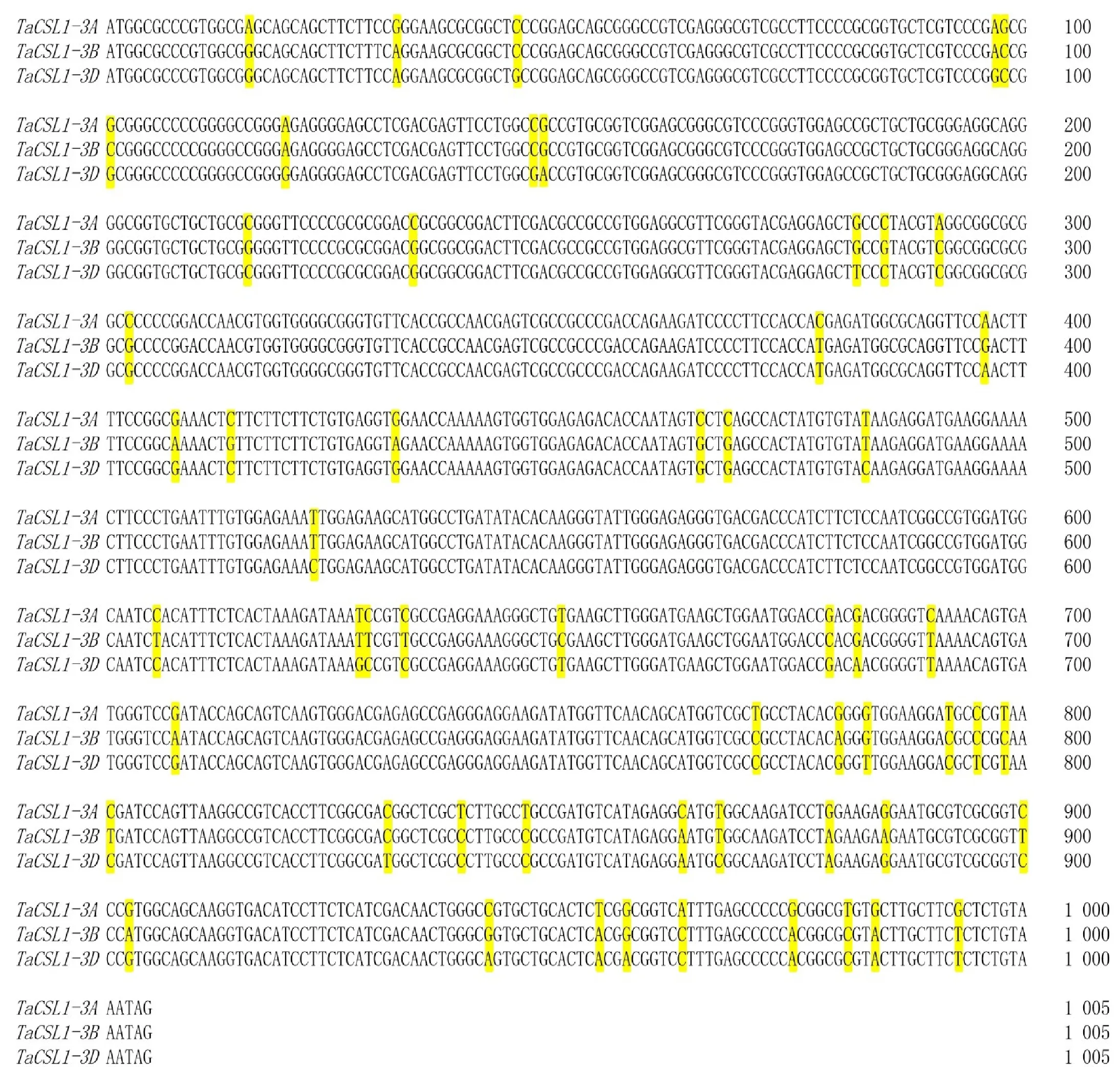
黄色阴影表示三个部分同源基因 TaCSL1-3A(GenBank Accession: MW725303)、 TaCSL1-3B(GenBank Accession: MW755354)和 TaCSL1-3D(GenBank Accession: MW755355)之间存在的序列多态性。
2.2 TaCSL1基因编码蛋白的生物学信息
对TaCSL1基因编码蛋白的理化性质进行分析,结果表明,TaCSL1-3A、TaCSL1-3B和TaCSL1-3D蛋白氨基酸长度均为334 aa,分子量为36 695.88~36 780.99,理论等电点为 5.48~ 5.59,说明该蛋白属于中性蛋白;带负电荷的氨基酸残基数均为46,带正电荷的氨基酸残基数为 39~40,总平均亲水性为-0.237~-0.217,表明该蛋白为亲水蛋白;稳定性系数为48.33~50.17,表明该蛋白不稳定。因其序列差异很小, 三个部分同源基因所编码的蛋白理化性质差异也很小。利用在线工具InterProScan预测TaCSL1-3A蛋白的保守结构域,结果(图3)表明,该蛋白第10~331位氨基酸为典型的CSL家族保守结构域,与该家族的其他蛋白具有相似的结构特征。

图3 TaCSL1-3A蛋白的保守结构域分析
TaCSL1蛋白与拟南芥CSL蛋白的氨基酸序列比对结果表明,TaCSL1-3A、TaCSL1-3B和TaCSL1-3D蛋白与拟南芥CSL蛋白的相似性分别为69.6%、69.6%和69.0%,蛋白序列C端较N端相对更保守(图4)。小麦与其他物种CSL蛋白的进化分析结果表明,CSL蛋白被分为两大类,即单子叶类和双子叶类。TaCSL1-3D蛋白与粗山羊草CSL蛋白进化关系最近,TaCSL1-3A、TaCSL1-3B与TaCSL1-3D蛋白进化关系也较近,三个蛋白在进化树上处于同一大分支上(图5)。

XP_002883301.1为拟南芥CLS蛋白的GenBank登录号。黄色阴影表示TaCSL1蛋白与拟南芥CSL同源蛋白的序列多态性。

图5 小麦TaCSL1蛋白与其他物种CSL蛋白的进化分析
2.3 TaCSL1基因的表达特性分析
在小麦的籽粒、颖壳、雌蕊、雄蕊、穗下茎、旗叶、倒二叶、旗叶鞘、节间、根等组织中均检测到TaCSL1-3A、TaCSL1-3B、TaCSL1-3D基因的表达,除开花后第9 d的旗叶鞘中TaCSL1-B的表达量较高外,三个基因在各个时期叶中的相对表达量均高于其他组织。比较不同生长发育时期的叶/旗叶组织可知,该基因在幼苗期至孕穗期,相对表达量总体提高,抽穗期明显降低,开花后再次提高,生育末期降低(表2)。
三个部分同源基因的相对表达量在部分组织中存在显著差异。总的来说,TaCSL1-3A相对表达量一直处于较低状态,TaCSL1-3D的相对表达量在孕穗期之前较高,TaCSL1-3B的相对表达量在孕穗期之后较高(表2)。
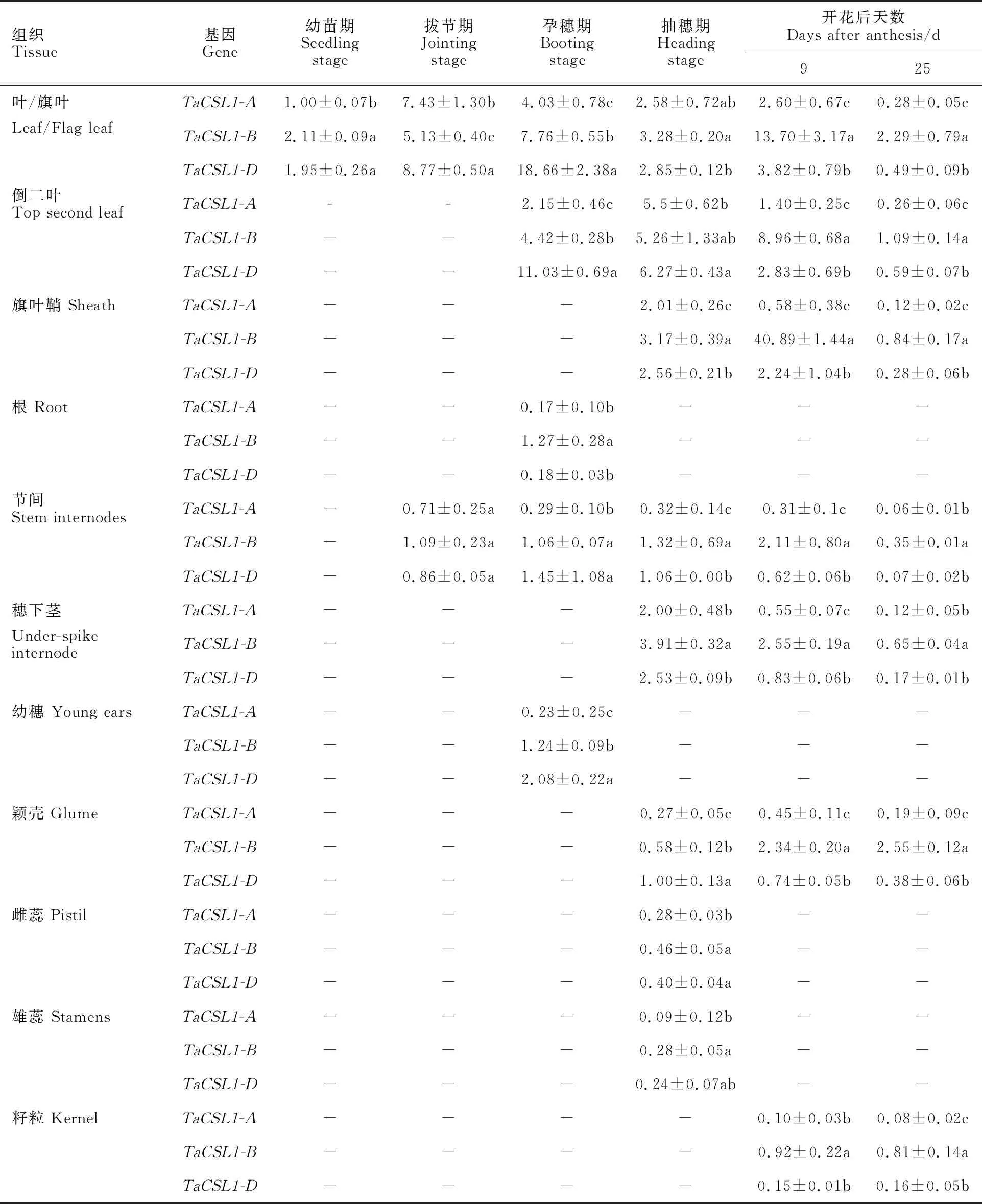
表2 小麦 TaCSL1在不同发育时期的组织器官中的相对表达量
3 讨 论
本研究根据拟南芥CSL基因At3g21360序列,利用同源克隆的方法,首次在小麦中克隆了TaCSL1基因,并获得了三个部分同源基因TaCSL1-3A、TaCSL1-3B、TaCSL1-3D的全长序列和编码区序列。与参考序列比对,TaCSL1-3A、TaCSL1-3B和TaCSL1-3D序列与参考序列一致。编码区序列比对结果表明,三个部分同源基因之间存在43个单核苷酸突变位点,其中有义突变11个,沉默突变32个。说明该基因在小麦进化过程中十分保守。通过与拟南芥的同源基因进行序列比对,发现TaCSL1-3A蛋白序列与拟南芥At3g21360蛋白序列相似度为69.6%,说明该蛋白序列在植物中相对保守[18]。根据进化树分析可知,小麦TaCSL1基因编码的蛋白与其祖先粗山羊草进化关系较近,其次是其他单子叶草本植物,而与双子叶植物进化关系较远。这说明该基因可能在单、双子叶分化之前就已经产生[19]。TaCSL1蛋白理化性质分析表明,该蛋白属于中性、亲水、不稳定蛋白,说明该蛋白作为一种酶,参与酶促反应之后容易分解[20]。
实时荧光定量PCR分析表明,TaCSL1-3A、TaCSL1-3B、TaCSL1-3D在小麦各个生长发育时期和组织部位都有表达,说明三个基因在小麦生长过程中都发挥作用,三者的功能也可能存在冗余[21]。TaCSL1基因在小麦叶片组织中相对表达水平较高,表明该基因主要在小麦叶片中发挥功能。开花后第9 d旗叶鞘中TaCSL1-3B的表达量相对较高,原因可能是异常环境诱导的结果。TaCSL1-3D在小麦孕穗期之前相对表达量较高,而TaCSL1-3B在小麦孕穗期之后相对表达量较高,表明三者的功能存在分化。
Bastard等[7]研究表明,CSL家族酶类具有严格的底物特异性,而江 倩[22]研究表明,一种CSL酶可以催化氧化多种底物,并且除了催化产生羟基化产物外,还能产生酰基产物。实时荧光定量PCR分析结果表明,TaCSL1基因在小麦全生育期和所有检测组织部位中均有表达,说明该基因是一个组成型表达基因[21],可预测该基因参与植物体内重要的生化过程。富含羟脯氨酸糖蛋白是细胞壁的构成部分,脯氨酸羟基化酶基因是一种组成型表达基因[23],TaCSL1基因是否是脯氨酸羟基化酶基因还有待进一步考证。
植物保卫素是植物受到生物或非生物因子侵袭时在体内合成并积累的低分子量抗菌性物质,其种类繁多、结构各异、代谢途径复杂[23]。(S)-4-羟基苯甘氨酸、(2S,3R)-3-羟基-亮氨酸和(2S,3R)-3-羟基-苯丙氨酸是植物保卫素的构成部分[24-25],因而,推测羟基化氨基酸可能是未被分离出来的植保素或其构成部分。后期可将该基因在小麦体内进行过表达或沉默,通过人工接种病菌,进一步研究该基因是否与植物抗病过程相关。
——紫 苏

