从鲜三七中提取三七总皂苷和淀粉的工艺研究
钱如贵,袁玲玲,许 娟,曹粉仙,王叶晓旭
(昆明邦宇制药有限公司·云南昆明·650211)
三七总皂苷是三七的主要有效成分,用于高脂血症、高血压、动脉粥样硬化、心肌缺血、缺血性脑卒中等心脑血管疾病的预防和治疗[1]。 三七总皂苷多从三七Panax notoginseng (Burk.)F.H.Chen 的干燥根和根茎中提取,处理步骤较多。
近年来, 有多篇关于从鲜三七中提取三七总皂苷的研究报道[2-4],以鲜三七为原料的提取方法与传统工艺大致相同,在部分步骤中增加磨浆、酶解、干燥等处理工序,以提高三七总皂苷的提取效率,但是,现有技术仍存在乙醇用量大、操作繁琐、需要反复加热、药渣难以再利用、能耗高、环保压力大等技术问题。
针对现有技术中存在的不足, 本文研究从鲜三七中同时提取三七总皂苷和淀粉的工艺,鲜三七经洗净、磨浆、静置处理,收集沉淀,干燥,得三七淀粉;上清液过滤后,先通过离子交换树脂脱色,再通过大孔吸附树脂纯化,乙醇洗脱液浓缩,干燥,得符合药用要求的三七总皂苷。
1 材料与方法
1.1 实验材料
鲜三七(20210105),生长3 年以上,购自文山赞七科技有限公司;食用乙醇(20190701),云南杨林工业开发区汕滇药业有限公司;LX-60 大孔吸附树脂、LX-T5离子交换树脂, 西安蓝晓科技新材料股份有限公司;ZTC1+1 澄清剂,武汉正天成澄清技术有限公司。
三七总皂苷(111920-201606),中国食品药品检定研究院;可溶性淀粉(1406002-200814),中国药品生物制品检定所; 乙腈 (192563), 色谱级,Fisher Chemical;分析用甲醇、乙醇、碘、碘化钾,均为国产AR。
1.2 仪器设备
AgiIent 1260 Infinity Ⅱ高效液相色谱仪(G7111B四元泵,G7115A 紫外检测器),Agilent Technologies Inc.;Waters 2489 高效液相色谱仪 (515 泵,2489 检测器),Waters Inc.;C18色谱柱 (250mm × 4. 6mm,5μm),汉邦Phecda;UV-1700 紫外可见分光光度计, 日本岛津。
1.3 三七总皂苷含量测定
鲜三七经磨浆后,精密量取5ml,加入乙醇5ml,混匀后静置2h 以上,滤过,取续滤液,即得供试品溶液;干燥三七参照《中国药典》方法处理,其它样品以乙醇溶液适当稀释,过滤即可。取供试品溶液,按照《中国药典》(2020 年版)一部“三七总皂苷” 方法测定含量(三七皂苷R1、 人参皂苷Rg1、 人参皂苷Re、 人参皂苷Rb1、人参皂苷Rd 总量)。
1.4 淀粉含量测定
参照文献[5-6]方法,精密量取1~5ml 鲜三七磨浆液,或称取制备所得三七淀粉样品适量,置具塞试管中,加入纯化水5~10ml,水浴至完全糊化,保持5min,冷却至室温,转移至100ml 量瓶中,加水稀释至刻度,摇匀,作为样品储备液。 分别取不同浓度的标准曲线溶液及供试品储备液10ml,加碘试液0.5ml,混匀,测定575nm处吸光度,根据标准曲线计算样品中淀粉含量。
2 结果与分析
2.1 鲜三七含量测定
取鲜三七,加入15 倍量纯化水磨浆,测得三七总皂苷含量为2.83%,淀粉含量7.82%;取鲜三七,切成3~5mm 薄片,经105℃干燥后,测得鲜三七中水分含量67.62%; 干燥后的三七粉碎, 测定三七总皂苷含量8.40%、淀粉27.53%,计算干燥后三七总皂苷回收率为96.11%。
2.2 磨浆加水量考察
取洗净的鲜三七,切碎,称取4 份,每份20.0g,按照5 ~25 倍量分别加入纯化水100、200、300、400、500ml,磨浆2min,经300 目滤布过滤,取样测定三七总皂苷和淀粉含量,根据溶液体积计算成分提取量,并根据2.1 结果计算转移率,结果见表1。
根据表1 结果可知,鲜三七磨浆加水量10~25 倍,三七总皂苷、 淀粉转移率分别达到95%、80%以上,结合实际工艺,加水量过大,药液浓度降低,后期处理耗时增加,因此,选择磨浆加水量为鲜三七量的15 倍。

表1 鲜三七磨浆加水量对提取效率的影响Table 1 Effect of the water amount on the transfer rate of notoginseng total saponins and starch
2.3 静置时间考察
参照文献[7]方法,取鲜三七,切碎,称取600g,加入纯化水9000ml 磨浆, 经300 目滤布过滤, 得到浆液9420ml, 混匀后, 量取9 份, 每份1000ml, 取1 份4000rpm 离心10min, 其余8 份在室温下分别静置1~24h,收集沉淀50℃干燥,称取干重,检测淀粉含量,计算1000ml 原液中淀粉转移率,结果见表2。
根据表2 结果可知,采用离心方式提取淀粉,转移率较高,但其它成分也进入沉淀,导致成品纯度较低,且操作繁琐。 采用静置方式提取淀粉,操作简便,静置8h 以上,淀粉沉淀已基本完全,根据实验情况,可选择静置时间8~24h。

表2 静置时间对淀粉提取率的影响Table 2 Effect of standing time on the starch transfer rate
2.4 鲜三七液的前处理
鲜三七浆经静置后,大量淀粉已从溶液中沉淀,但上清液仍较为浑浊,较难过滤,参照文献[8-9]方法,取静置后的上清液6 份,每份100ml,加入ZTC1+1 澄清剂A、B 组分,搅拌均匀,常温下放置4h,观察澄清效果,先取上清液加入1%硅藻土过滤,最后再过滤沉淀,取滤液检测并根据原液含量计算三七总皂苷转移率,优选澄清剂用量,结果见表3。

表3 澄清剂用量对三七总皂苷转移率的影响Table 3 Effect of clarificant amount on the transfer rate of notoginseng total saponins
根据表3 结果可知, 当ZTC1+1 澄清剂用量2%时,能去除鲜三七液中大量胶体物质,提高过滤效率,且对上清液中三七总皂苷转移率影响较小。
2.5 脱色工艺选择
参照文献[10]方法,取经2.4 处理的澄清溶液6 份,每份500ml, 分别加入经预处理并沥水的LX-94、LXT5、LX-TN2、LXD-020 离子交换树脂30g,另取1 份加入活性炭5g,每30min 振荡或搅拌1 次,静态吸附4h,过滤,与原液比较颜色变化,取样检测溶液中三七总皂苷含量,优选脱色效果好、且对三七总皂苷吸附较少的脱色树脂,结果见表4。

表4 脱色树脂选择Table 4 Resin selecting for decolorition of notoginseng total saponins
根据表4 结果可知,1%活性炭脱色效果最佳,但对三七总皂苷吸附作用强, 因此该脱色方法不可取;LX-T5 对三七总皂苷吸附率较低,对鲜三七溶液脱色效果较好,因此,优选脱色树脂为LX-T5 型离子交换树脂。
根据脱色树脂选择结果,取LX-T5 离子交换树脂100ml 装柱,长径比8∶1,经预处理后,取澄清的鲜三七溶液3600ml, 以400~600ml/h 流速通过树脂脱色,依次收集流出液,按照中国药典方法检查溶液颜色,检查溶液颜色,在100~2500ml 范围内,脱色液均为无色,随后逐渐出现淡黄色至黄色 (深于0.5 号黄色标准比色液), 说明在装柱长径比8∶1、 流速4~6BV/h 条件下,LX-T5 离子交换树脂用于鲜三七溶液脱色的饱和上样量为25BV。
2.5 纯化工艺选择
参照文献[11]方法,取经磨浆、静置、澄清、过滤、脱色处理的鲜三七溶液2 份,每份400ml,分别加入预处理并沥水的D101 和LX-60 大孔吸附树脂20g,每30min 振摇1 次,静态吸附4h,过滤,取滤液,为吸附液; 树脂以纯化水洗涤后沥干, 加入80%乙醇溶液200ml,每30min 振摇1 次,静态解析2h,过滤,取滤液,为解析液。 取吸附液和解析液,测定三七总皂苷含量,根据溶液体积计算树脂饱和吸附量、解析量,结果见表5。

表5 大孔吸附树脂选择Table 4 Resin selecting for purification of notoginseng total saponins
根据静态实验结果可知,LX-60 对三七总皂苷的吸附率低于常规使用的D101,但解吸率较高,总体性能优异,因此,选择LX-60 大孔吸附树脂用于三七总皂苷的纯化。
根据上述实验结果, 取LX-60 大孔吸附树脂150ml 装柱,长径比5∶1,经预处理后,取经脱色的鲜三七溶液6500ml,以600~800ml/h 流速通过树脂,依次收集流出液,取样制备供试品溶液,HPLC 检测流出液中三七总皂苷含量,结果见图1。

图1 LX-60 大孔树脂对三七总皂苷的饱和吸附量Figure 1 Saturated extent adsorption of notoginseng total saponins by LX-60
吸附完全后,树脂先以纯化水冲洗,再用80%乙醇溶液600ml、95%乙醇300ml 以1~2BV/h 流速依次洗脱,每150ml 收集1 份,取样适当稀释后制备供试品溶液,HPLC 检测洗脱液中三七总皂苷含量,结果见图2。
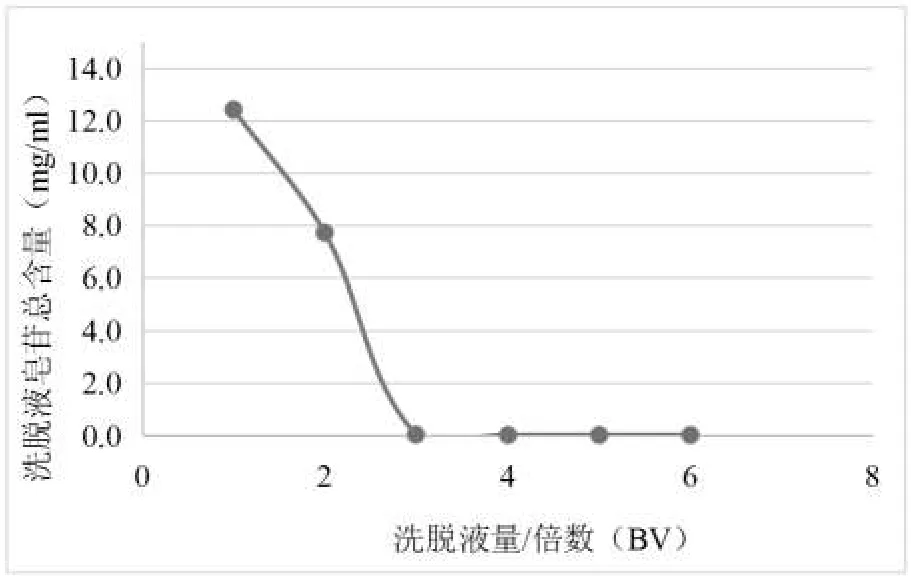
图2 洗脱终点考察曲线Figure 2 Solvent amount for notoginseng total saponins eluting from LX-60
根据图1 可知, 当鲜三七溶液上样量超过22BV时,三七总皂苷开始渗漏;当上样量达到38BV 时,树脂吸附饱和。 为了保证吸附效率, 减少三七总皂苷损失,选择动态吸附参数为长径比5∶1、流速4~5BV/h,上样量为30BV。
根据图2 可知, 当80%乙醇溶液用量为3BV 时,能将90%的三七总皂苷从LX-60 大孔吸附树脂上洗脱;用量为4BV 时,洗脱完全。
2.6 工艺小试
根据工艺研究结果,取鲜三七,洗净,称取1000g,切碎,加入纯化水15L 磨浆,以300 目滤布过滤,静置24h,沉淀以纯化水洗涤3 次,50℃干燥,得三七淀粉;上清液加入ZTC1+1 澄清剂溶液A、B 组分各300ml,静置4h 以上,先在上清液中加入硅藻土150g 过滤,再过滤沉淀,合并滤液,通过预处理的LX-T5 离子交换树脂(600ml,长径比9∶1,流速40~60ml/min)脱色,再通过预处理的LX-60 大孔吸附树脂(500ml,长径比5∶1,流速30~50ml/min),纯化水冲洗树脂,加入80%乙醇溶液2L 以10~15ml/min 流速洗脱,洗脱液60℃减压浓缩回收乙醇,60℃真空干燥,得三七总皂苷。 实验共进行3 批,收集三七淀粉、三七总皂苷,检测含量,计算提取得率,结果见表6。
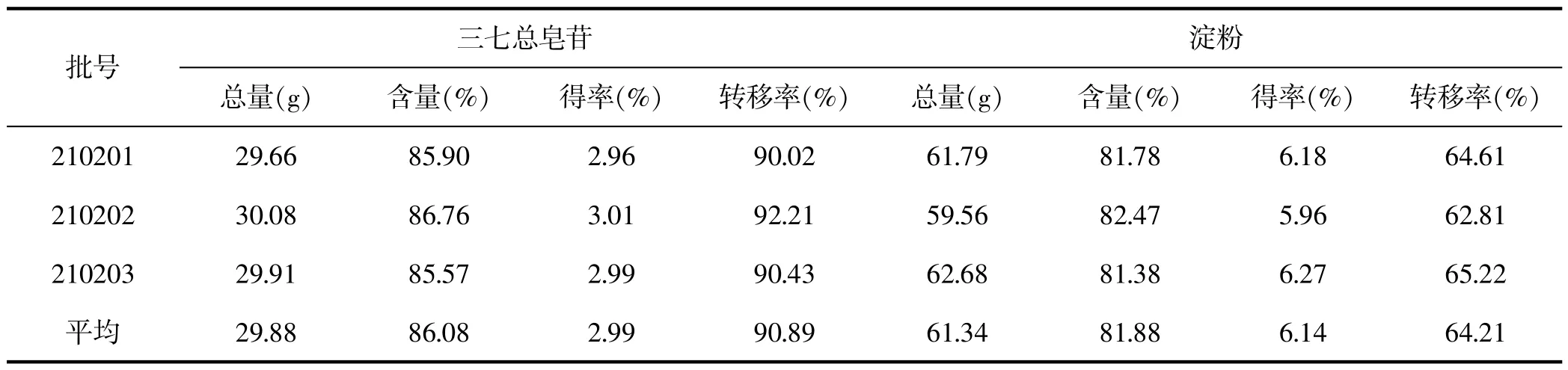
表6 工艺小试3 批结果统计Table 6 Verification of extraction process by 3 batches
3 结论
采用本文提供的工艺,以鲜三七为原料,可同时提取三七总皂苷和淀粉, 其中, 三七总皂苷提取率达到90%以上, 成品含量达到80%以上; 淀粉提取率超过60%,含量达到80%以上。
4 讨论
现有三七提取技术, 采用药材三七或鲜三七为原料,经过适当破碎处理后,大多采用乙醇为提取溶剂,经热回流或渗漉提取,提取液回收乙醇至无醇味,然后通过大孔树脂纯化,经乙醇洗脱后,回收乙醇,洗脱液再经过脱色处理,脱色液浓缩干燥后,制备得到符合药用要求的三七总皂苷,有两个步骤使用乙醇作为溶剂,需要经过2~3 次乙醇回收或浓缩处理, 因操作步骤较多,提取效率较低,生产成本和能耗较高。此外,鲜三七中淀粉含量约为8%, 折合三七药材中淀粉含量超过25%,采用常规技术提取三七总皂苷,所含淀粉难以实现资源利用,往往随药渣一起废弃,造成环境污染。
本文采用鲜三七为原料,洗净后直接磨浆,细胞破壁更为彻底, 促进了淀粉浸出和三七总皂苷在水中溶出,静置后收集淀粉,上清液澄清、过滤后,先经过树脂脱色处理,脱色液直接通过大孔树脂纯化三七总皂苷,乙醇洗脱液经浓缩、干燥,只有1 个步骤使用乙醇作为溶剂, 只经过1 次乙醇回收和浓缩处理, 工艺效率较高;同时,因操作步骤简化,加热次数减少,主要成分损耗降低,并有效解决了淀粉、果胶、可溶性纤维、蛋白质等成分对三七总皂苷提取带来的影响。因此,本文提供的工艺,有利于提高三七总皂苷的提取率,降低生产成本和能耗,减少资源浪费和环境污染,值得在工业生产中推广应用。

